Antibiotik beta-laktam: Perbedaan antara revisi
Tidak ada ringkasan suntingan |
Tidak ada ringkasan suntingan |
||
| Baris 1: | Baris 1: | ||
{{inuse|3 Mei}} |
{{inuse|3 Mei}} |
||
[[Berkas:Betalactam.svg|200px|right|thumb|Struktur cincin beta-laktam.]] |
[[Berkas:Betalactam.svg|200px|right|thumb|Struktur cincin beta-laktam.]] |
||
Antibiotik beta-laktam adalah golongan antibiotika yang memiliki kesamaan komponen struktur berupa adanya cincin beta-laktam dan umumnya digunakan untuk mengatasi infeksi bakteri<ref name="a">{{cite book |last= Madigan MT, Martinko JM, |first= |authorlink= |coauthors= |title= Brock Biology of Microorganisms |year= 2000|publisher= Prentice Hall |location= |id= ISBN 978-0-13-081922-2}}</ref>. Terdapat sekitar ± 56 macam antibotik beta-laktam yang memiliki antivitas antimikrobial pada bagian cincing beta-laktamnya dan apabila cincin tersebut dipotong oleh mikoorganisme makan akan terjadi resistensi terhadap antibiotik tersebut<ref name="b">{{cite book |last= Richard Schwalbe, Lynn Steele-Moore, Avery C. Goodwin|first= |authorlink= |coauthors= |title= Antimicrobial susceptibility testing protocols|year= 2007|publisher= CRC Press|location= |id= ISBN 978-0824741006}}</ref>. |
Antibiotik beta-laktam adalah golongan [antibiotika] yang memiliki kesamaan komponen struktur berupa adanya cincin beta-laktam dan umumnya digunakan untuk mengatasi infeksi bakteri<ref name="a">{{cite book |last= Madigan MT, Martinko JM, |first= |authorlink= |coauthors= |title= Brock Biology of Microorganisms |year= 2000|publisher= Prentice Hall |location= |id= ISBN 978-0-13-081922-2}}</ref>. Terdapat sekitar ± 56 macam antibotik beta-laktam yang memiliki antivitas antimikrobial pada bagian cincing beta-laktamnya dan apabila cincin tersebut dipotong oleh mikoorganisme makan akan terjadi resistensi terhadap antibiotik tersebut<ref name="b">{{cite book |last= Richard Schwalbe, Lynn Steele-Moore, Avery C. Goodwin|first= |authorlink= |coauthors= |title= Antimicrobial susceptibility testing protocols|year= 2007|publisher= CRC Press|location= |id= ISBN 978-0824741006}}</ref>. |
||
== Jenis-jenis == |
== Jenis-jenis == |
||
| Baris 20: | Baris 20: | ||
=== Penisilin === |
=== Penisilin === |
||
Berdasarkan spektrum aktivitas antimikrobialnya, penisilin terbagi menjadi 4 kelompok, yaitu penisilin dini (terdahulu), penisilin spektruk luas, penisilin anti-stafilokokal, dan penisilin anti-pseudomonasl (spektrum diperluas)<ref name="x"></ref>. Penisilin dini memiliki kemampuan aktif melawan bakteri yang sensitif, seperti golongan '''Streptococcus''' beta-hemolitik, '''Streptococcus''' alfa-hemolitik dikombinasikan dengan aminoglikosida), ''pneumococcus'', ''meningococcus'', dan kelompok ''Clostridium'' selain ''C. difficile''<ref name="x"></ref>. Contoh dari penisilin terdahulu adalah penisilin G dan penisilin V<ref name="a"></ref>. Penisilin spektrum luas memiliki kemampuan untuk melawan bakteri enterik dan lebih mudah diabsorpsi oleh bakteri gram negatif namun masih rentan terhadap degradasi beta-laktamase, contohnya ampisilin, amoksisilin, mesilinam, ''bacampicillin'', dll<ref name="x"></ref>. Penisilin anti-stafilokokal dikembangkan pada tahun 1950-an untuk mengatasi ''S. aureus'' yang memproduksi beta-laktamase dan memiliki keunggulan tahan terhadap aktivitas beta-laktamase<ref name="x"></ref>. Contoh dari golongan ini adalah ''methicillin'' dan ''cloxacillin''<ref name="x"></ref>. Penisilin anti-pseudomonal dibuat untuk mengatasi infeksi bakteri gram negatif basil, termasuk Pseudomonas aeruginosa, contoh dari penisilin golongan ini adalah carbenicillin, ticarcillin, Azlocillin, dan piperacillin<ref name="x"></ref>. |
Berdasarkan spektrum aktivitas antimikrobialnya, [[penisilin]] terbagi menjadi 4 kelompok, yaitu penisilin dini (terdahulu), penisilin spektruk luas, penisilin anti-stafilokokal, dan penisilin anti-pseudomonasl (spektrum diperluas)<ref name="x"></ref>. Penisilin dini memiliki kemampuan aktif melawan bakteri yang sensitif, seperti golongan '''Streptococcus''' beta-hemolitik, '''Streptococcus''' alfa-hemolitik dikombinasikan dengan aminoglikosida), ''pneumococcus'', ''meningococcus'', dan kelompok ''[[Clostridium]]'' selain ''C. difficile''<ref name="x"></ref>. Contoh dari penisilin terdahulu adalah penisilin G dan penisilin V<ref name="a"></ref>. Penisilin spektrum luas memiliki kemampuan untuk melawan bakteri enterik dan lebih mudah diabsorpsi oleh bakteri gram negatif namun masih rentan terhadap degradasi beta-laktamase, contohnya ampisilin, amoksisilin, mesilinam, ''bacampicillin'', dll<ref name="x"></ref>. Penisilin anti-stafilokokal dikembangkan pada tahun 1950-an untuk mengatasi ''S. aureus'' yang memproduksi beta-laktamase dan memiliki keunggulan tahan terhadap aktivitas beta-laktamase<ref name="x"></ref>. Contoh dari golongan ini adalah ''methicillin'' dan ''cloxacillin''<ref name="x"></ref>. Penisilin anti-pseudomonal dibuat untuk mengatasi infeksi bakteri gram negatif basil, termasuk ''Pseudomonas aeruginosa'', contoh dari penisilin golongan ini adalah carbenicillin, ticarcillin, Azlocillin, dan piperacillin<ref name="x"></ref>. |
||
=== Sefalosporin === |
=== Sefalosporin === |
||
| Baris 26: | Baris 26: | ||
=== Carbapenem === |
=== Carbapenem === |
||
Hanya terdapat satu agen antibiotik dari golongan carbapenem yang digunakan untuk perawatan klinis, yaitu imipenem yang memiliki kemampuan antibakterial yang sangat baik untuk melawan bakteri gram negatif-basil (termasuk P. aeruginosa, Staphylococcus, dan bacteroides)<ref name="x"></ref>. Penggunaan imipenem harus dikombinasikan dengan inhibitor enzim tertentu untuk melindunginya dari degragasi enzim dari liver di dalam tubuh<ref>{{cite journal |
Hanya terdapat satu agen antibiotik dari golongan carbapenem yang digunakan untuk perawatan klinis, yaitu imipenem yang memiliki kemampuan antibakterial yang sangat baik untuk melawan bakteri gram negatif-basil (termasuk [[P. aeruginosa]], ''[[Staphylococcus]]'', dan [[bacteroides]])<ref name="x"></ref>. Penggunaan imipenem harus dikombinasikan dengan inhibitor enzim tertentu untuk melindunginya dari degragasi enzim dari liver di dalam tubuh<ref>{{cite journal |
||
| author = MICHAEL D. REED, ROBERT C. STERN, CHERYL A. O'BRIEN, TOYOKO S. YAMASHITA, CAROLYN M. MYERS, JEFFREY L. BLUMERI |
| author = MICHAEL D. REED, ROBERT C. STERN, CHERYL A. O'BRIEN, TOYOKO S. YAMASHITA, CAROLYN M. MYERS, JEFFREY L. BLUMERI |
||
| year = 1985 |
| year = 1985 |
||
| Baris 47: | Baris 47: | ||
== Mekanisme kerja == |
== Mekanisme kerja == |
||
Antibiotik beta-laktamase bekerja membunuh bakteri dengan cara menginhibisi sintesis dinding selnya<ref name="c">{{cite book |last= Steeve Giguère|first= |authorlink= |coauthors= |title= Antimicrobial therapy in veterinary medicine|year= 2007|publisher= Wiley-Blackwell|location= |id= ISBN 978-0813806563}}</ref>. Pada proses pembentukan dinding sel, terjadi reaksi transpeptidasi yang dikatalis oleh enzim transpeptidase dancmenghasilkan ikatan silang antara dua rantai peptida-glukan<ref name="c"></ref>. Enzim transpeptidase yang terletak pada membran sitoplasma bakteri tersebut juga dapat mengikat antibiotik beta-laktam sehingga menyebabkan enzim ini tidak mampu mengkatalisis reaksi transpeptidasi walaupun dinding sel tetap terus dibentuk<ref="c"></ref>. Dinding sel yang terbentuk tidak memiliki ikatan silang dan peptidoglikan yang terbentuk tidak sempurna sehingga lebih lemah dan mudah terdegradasi<ref name="c"></ref>. Pada kondisi normal, perbedaan tekanan osmotik di dalam sel bakteri gram negatif dan di lingkungan akan membuat terjadinya lisis sel<ref name="c"></ref>. Selain itu, kompleks protein transpeptidase dan antibiotik beta-laktam akan menstimulasi senyawa autolisin yang dapat mendigesti dinding sel bakteri tersebut<ref name="c"></ref>. Dengan demikian, bakteri yang kehilangan dinding sel maupun mengalami lisis akan mati<ref name="c"></ref>. |
Antibiotik beta-laktamase bekerja membunuh bakteri dengan cara menginhibisi sintesis dinding selnya<ref name="c">{{cite book |last= Steeve Giguère|first= |authorlink= |coauthors= |title= Antimicrobial therapy in veterinary medicine|year= 2007|publisher= Wiley-Blackwell|location= |id= ISBN 978-0813806563}}</ref>. Pada proses pembentukan dinding sel, terjadi reaksi transpeptidasi yang dikatalis oleh enzim transpeptidase dancmenghasilkan ikatan silang antara dua rantai peptida-glukan<ref name="c"></ref>. Enzim [[transpeptidase]] yang terletak pada membran sitoplasma bakteri tersebut juga dapat mengikat antibiotik beta-laktam sehingga menyebabkan enzim ini tidak mampu mengkatalisis reaksi transpeptidasi walaupun dinding sel tetap terus dibentuk<ref="c"></ref>. Dinding sel yang terbentuk tidak memiliki ikatan silang dan peptidoglikan yang terbentuk tidak sempurna sehingga lebih lemah dan mudah terdegradasi<ref name="c"></ref>. Pada kondisi normal, perbedaan tekanan osmotik di dalam sel bakteri gram negatif dan di lingkungan akan membuat terjadinya lisis sel<ref name="c"></ref>. Selain itu, kompleks protein transpeptidase dan antibiotik beta-laktam akan menstimulasi senyawa autolisin yang dapat mendigesti dinding sel bakteri tersebut<ref name="c"></ref>. Dengan demikian, bakteri yang kehilangan [[dinding sel]] maupun mengalami [[lisis]] akan mati<ref name="c"></ref>. |
||
== Mekanisme resistensi == |
== Mekanisme resistensi == |
||
Beberapa bakteri diketahui memiliki resitensi terhadap antibiotik beta-laktam, salah satu diantaranya adalah golongan ''Streptococcus |
Beberapa bakteri diketahui memiliki resitensi terhadap antibiotik beta-laktam, salah satu diantaranya adalah golongan ''[[Streptococcus aureu]]s'' resisten-metisilin (''Methicillin resistant'' ''Staphylococcus aureus''/MRSA)<ref>{{cite book |last= Office of Technology Assessment Congress of United States|first= |authorlink= |coauthors= |title= Impacts of Antibiotic-Resistant Bacteria|year= 1995|publisher= Diane Publishing Co.|location= |id= }}</ref>. Bakteri-bakteri yang resisten terhadap antibiotik beta-laktam memiliki 3 mekanisme reistensi, yaitu destruksi antibiotik dengan beta-laktamase, menurunkan penetrasi antibiotik untuk berikatan dengan [[protein]] transpepidase, dan menurunkan afinitas ikatan antara protein pengikat tersebut dengan senyawa antibiotik<ref name="l">{{cite journal |
||
| author = R. Fontana, P. Canepari, M. M. Lleò, G. Satta |
| author = R. Fontana, P. Canepari, M. M. Lleò, G. Satta |
||
| year = 1990 |
| year = 1990 |
||
| Baris 63: | Baris 63: | ||
| url = http://www.springerlink.com/content/j7m800101937421v/ |
| url = http://www.springerlink.com/content/j7m800101937421v/ |
||
}} |
}} |
||
</ref>. Beberapa bakteri seperti ''Haemophilus influenzae'', golongan ''Staphylococcus'', dan sebagian besar bakteri enterik berbentuk batang memiliki enzim beta-laktamase yang dapat memecah cincin beta-laktam pada antibiotik tersebut dan membuatnya menjadi tidak aktif<ref name="l"></ref>. Secara detail, mekanisme yang terjadi diawali dengan pemutusan ikatan C-N pada cincin beta-laktam dan mengakibatkan antibiotik tidak dapat berikatan dengan protein transpeptdase sehingga terjadi kehilangan kemampuan untuk menginhibisi pembentukan dinding sel bakteri<ref name="h">{{cite book |last= Ṛuben Vardanyan, Victor J. Hruby|first= |authorlink= |coauthors= |title= Synthesis of essential drugs|year= 2006|publisher= Elsevier Science|location= |id= ISBN 978-0444521668}}</ref>. Beberapa studi menyatakan bahwa selain ditemukan secara alami pada bakteri gram positif dan negatif, gen penyandi enzim beta-laktamase juga ditemukan pada plasmida dan transposon sehingga dapat ditransfer antarspesies bakteri<ref name="o">{{cite book |last= Sherry F. Queener, J. Alan Webber|first= |authorlink= |coauthors= |title= Beta-lactam antibiotics for clinical use|year= 1986|publisher= Informa Healthcare|location= |id= ISBN 978-0824773861}}</ref>. Hal ini menyebabkan kemampuan resistensi akan antibiotik beta-laktam dapat menyebar dengan cepat<ref name="o"></ref>. Difusi antibiotik beta laktam ke dalam sel bakteri terjadi melalui perantaraan protein transmembran yang disebut ''porine'' dan kemampuan difusinya dipengaruhi oleh ukuran, muatan, dan sifat hidrofilik dari suatu antibiotik<ref name="h"></ref>. |
</ref>. Beberapa bakteri seperti ''Haemophilus influenzae'', golongan ''Staphylococcus'', dan sebagian besar bakteri enterik berbentuk batang memiliki enzim beta-laktamase yang dapat memecah cincin beta-laktam pada antibiotik tersebut dan membuatnya menjadi tidak aktif<ref name="l"></ref>. Secara detail, mekanisme yang terjadi diawali dengan pemutusan ikatan C-N pada cincin beta-laktam dan mengakibatkan antibiotik tidak dapat berikatan dengan protein transpeptdase sehingga terjadi kehilangan kemampuan untuk menginhibisi pembentukan dinding sel bakteri<ref name="h">{{cite book |last= Ṛuben Vardanyan, Victor J. Hruby|first= |authorlink= |coauthors= |title= Synthesis of essential drugs|year= 2006|publisher= Elsevier Science|location= |id= ISBN 978-0444521668}}</ref>. Beberapa studi menyatakan bahwa selain ditemukan secara alami pada [[bakteri]] gram positif dan negatif, gen penyandi enzim beta-laktamase juga ditemukan pada plasmida dan transposon sehingga dapat ditransfer antarspesies bakteri<ref name="o">{{cite book |last= Sherry F. Queener, J. Alan Webber|first= |authorlink= |coauthors= |title= Beta-lactam antibiotics for clinical use|year= 1986|publisher= Informa Healthcare|location= |id= ISBN 978-0824773861}}</ref>. Hal ini menyebabkan kemampuan resistensi akan antibiotik beta-laktam dapat menyebar dengan cepat<ref name="o"></ref>. Difusi antibiotik beta laktam ke dalam sel bakteri terjadi melalui perantaraan [[protein transmembran]] yang disebut ''porine'' dan kemampuan difusinya dipengaruhi oleh ukuran, muatan, dan sifat [[hidrofilik]] dari suatu antibiotik<ref name="h"></ref>. |
||
== Mengatasi resistensi antibiotik beta-laktam == |
== Mengatasi resistensi antibiotik beta-laktam == |
||
[[Berkas:Clavulanic acid structure.svg|thumb|200px|right|Asam klavulanat, inhibitor beta-laktamase.]] |
[[Berkas:Clavulanic acid structure.svg|thumb|200px|right|Asam klavulanat, inhibitor beta-laktamase.]] |
||
Untuk mengatasi degradasi cincing beta-laktam, beberapa antibiotik beta-laktam dikombinasikan dengan senyawa inhibitor enzim beta-laktamase seperti asam clavulanat, ''tazobactam'', atau ''sulbactam''<ref name="b"></ref>. Salah satu antibiotik beta-laktam yang resisten beta laktamase adalah augmentin, kombinasi amoxycillin dan asam klavulanat |
Untuk mengatasi degradasi cincing beta-laktam, beberapa antibiotik beta-laktam dikombinasikan dengan senyawa [[inhibitor enzim]] beta-laktamase seperti asam clavulanat, ''tazobactam'', atau ''sulbactam''<ref name="b"></ref>. Salah satu antibiotik beta-laktam yang resisten beta laktamase adalah augmentin, kombinasi amoxycillin dan asam klavulanat. Augmentin terbukti telah berhasil mengatasi infeksi bakteri pada saluran kemih dan kulit<ref>{{cite journal |
||
| author = Tan TH, Tay L, Yeo M, Feng PH |
| author = Tan TH, Tay L, Yeo M, Feng PH |
||
| year = |
| year = |
||
| Baris 82: | Baris 82: | ||
| accessdate = |
| accessdate = |
||
}} |
}} |
||
</ref>. Asam klavulanat yng diproduksi dari hasil fermentasi ''Streptomyces clavuligerus'' memiliki kemampuan untuk menghambat sisi aktif enzim beta-laktamase sehingga menyebabkan enzim tersebut menjadi inaktif<ref>{{cite journal |
</ref>. Asam klavulanat yng diproduksi dari hasil [[fermentasi]] ''Streptomyces clavuligerus'' memiliki kemampuan untuk menghambat sisi aktif enzim beta-laktamase sehingga menyebabkan enzim tersebut menjadi inaktif<ref>{{cite journal |
||
| author = C. READING, M. COLE |
| author = C. READING, M. COLE |
||
| year = 1997 |
| year = 1997 |
||
| Baris 104: | Baris 104: | ||
[[Kategori: Antibiotika]] |
[[Kategori: Antibiotika]] |
||
[[en:Beta-lactam antibiotic]] |
|||
[[cs:Beta-laktamová antibiotika]] |
|||
[[da:Β-lactamantibiotika]] |
|||
[[de:Β-Lactam-Antibiotika]] |
|||
[[es:Antibiótico betalactámico]] |
|||
[[eu:Betalaktamiko]] |
|||
[[fr:Antibiotique bêta-lactamine]] |
|||
[[ko:베타-락탐계열 항생제]] |
|||
[[hr:Beta-laktamski antibiotik]] |
|||
[[it:Beta-lattamici]] |
|||
[[nl:Bèta-lactam-antibioticum]] |
|||
[[ja:Β-ラクタム系抗生物質]] |
|||
[[pl:Antybiotyki beta-laktamowe]] |
|||
[[pt:Antibiótico betalactâmico]] |
|||
[[ru:Бета-лактамные антибиотики]] |
|||
[[sk:Beta-laktámové antibiotikum]] |
|||
[[sl:Betalaktamski antibiotik]] |
|||
[[fi:Beetalaktaami]] |
|||
[[sv:Beta-laktam]] |
|||
[[zh:Β-内酰胺类抗生素]] |
|||
Revisi per 1 Mei 2010 14.48
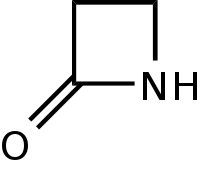
Antibiotik beta-laktam adalah golongan [antibiotika] yang memiliki kesamaan komponen struktur berupa adanya cincin beta-laktam dan umumnya digunakan untuk mengatasi infeksi bakteri[1]. Terdapat sekitar ± 56 macam antibotik beta-laktam yang memiliki antivitas antimikrobial pada bagian cincing beta-laktamnya dan apabila cincin tersebut dipotong oleh mikoorganisme makan akan terjadi resistensi terhadap antibiotik tersebut[2].
Jenis-jenis
Antibiotik beta-laktam terbagi menjadi 4 golongan utama, yaitu penisilin, sefalosporin, carbapenem, dan monobactam[3].
Penisilin
Berdasarkan spektrum aktivitas antimikrobialnya, penisilin terbagi menjadi 4 kelompok, yaitu penisilin dini (terdahulu), penisilin spektruk luas, penisilin anti-stafilokokal, dan penisilin anti-pseudomonasl (spektrum diperluas)[3]. Penisilin dini memiliki kemampuan aktif melawan bakteri yang sensitif, seperti golongan Streptococcus beta-hemolitik, Streptococcus alfa-hemolitik dikombinasikan dengan aminoglikosida), pneumococcus, meningococcus, dan kelompok Clostridium selain C. difficile[3]. Contoh dari penisilin terdahulu adalah penisilin G dan penisilin V[1]. Penisilin spektrum luas memiliki kemampuan untuk melawan bakteri enterik dan lebih mudah diabsorpsi oleh bakteri gram negatif namun masih rentan terhadap degradasi beta-laktamase, contohnya ampisilin, amoksisilin, mesilinam, bacampicillin, dll[3]. Penisilin anti-stafilokokal dikembangkan pada tahun 1950-an untuk mengatasi S. aureus yang memproduksi beta-laktamase dan memiliki keunggulan tahan terhadap aktivitas beta-laktamase[3]. Contoh dari golongan ini adalah methicillin dan cloxacillin[3]. Penisilin anti-pseudomonal dibuat untuk mengatasi infeksi bakteri gram negatif basil, termasuk Pseudomonas aeruginosa, contoh dari penisilin golongan ini adalah carbenicillin, ticarcillin, Azlocillin, dan piperacillin[3].
Sefalosporin
Antibioik sefalosporin terbagi menjadi 3 generasi, yang pertama adalah cephalothin dan cephaloridine yang sudah tidak banyak digunakan[3]. Generasi kedua (antara lain: cefuroxime, cefaclor, cefadroxil, cefoxitin, dll.) digunakan secara luas untuk mengatasi infeksi berat dan beberapa di antaranya memiliki aktivitas melawan bakteri anaerob[3]. Generasi ketiga dari sefalosporin (di antaranya: ceftazidime, cefotetan, latamoxef, cefotetan, dll.) dibuat pada tahun 1980-an untuk mengatasi infeksi sistemik berat karena bakteri gram negatif-basil[3].
Carbapenem
Hanya terdapat satu agen antibiotik dari golongan carbapenem yang digunakan untuk perawatan klinis, yaitu imipenem yang memiliki kemampuan antibakterial yang sangat baik untuk melawan bakteri gram negatif-basil (termasuk P. aeruginosa, Staphylococcus, dan bacteroides)[3]. Penggunaan imipenem harus dikombinasikan dengan inhibitor enzim tertentu untuk melindunginya dari degragasi enzim dari liver di dalam tubuh[4].
Monobactam
Golongan ini memiliki struktur cincin beta-laktam yang tidak terikat ke cincin kedua dalam molekulnya[3]. Salah satu antibiotik golongan ini yang umum digunakan adalah aztreonam yang memiliki aktif melawan berbagai bakteri gram negatif, termasuk P. aeruginosa[3].
Mekanisme kerja
Antibiotik beta-laktamase bekerja membunuh bakteri dengan cara menginhibisi sintesis dinding selnya[5]. Pada proses pembentukan dinding sel, terjadi reaksi transpeptidasi yang dikatalis oleh enzim transpeptidase dancmenghasilkan ikatan silang antara dua rantai peptida-glukan[5]. Enzim transpeptidase yang terletak pada membran sitoplasma bakteri tersebut juga dapat mengikat antibiotik beta-laktam sehingga menyebabkan enzim ini tidak mampu mengkatalisis reaksi transpeptidasi walaupun dinding sel tetap terus dibentuk<ref="c"></ref>. Dinding sel yang terbentuk tidak memiliki ikatan silang dan peptidoglikan yang terbentuk tidak sempurna sehingga lebih lemah dan mudah terdegradasi[5]. Pada kondisi normal, perbedaan tekanan osmotik di dalam sel bakteri gram negatif dan di lingkungan akan membuat terjadinya lisis sel[5]. Selain itu, kompleks protein transpeptidase dan antibiotik beta-laktam akan menstimulasi senyawa autolisin yang dapat mendigesti dinding sel bakteri tersebut[5]. Dengan demikian, bakteri yang kehilangan dinding sel maupun mengalami lisis akan mati[5].
Mekanisme resistensi
Beberapa bakteri diketahui memiliki resitensi terhadap antibiotik beta-laktam, salah satu diantaranya adalah golongan Streptococcus aureus resisten-metisilin (Methicillin resistant Staphylococcus aureus/MRSA)[6]. Bakteri-bakteri yang resisten terhadap antibiotik beta-laktam memiliki 3 mekanisme reistensi, yaitu destruksi antibiotik dengan beta-laktamase, menurunkan penetrasi antibiotik untuk berikatan dengan protein transpepidase, dan menurunkan afinitas ikatan antara protein pengikat tersebut dengan senyawa antibiotik[7]. Beberapa bakteri seperti Haemophilus influenzae, golongan Staphylococcus, dan sebagian besar bakteri enterik berbentuk batang memiliki enzim beta-laktamase yang dapat memecah cincin beta-laktam pada antibiotik tersebut dan membuatnya menjadi tidak aktif[7]. Secara detail, mekanisme yang terjadi diawali dengan pemutusan ikatan C-N pada cincin beta-laktam dan mengakibatkan antibiotik tidak dapat berikatan dengan protein transpeptdase sehingga terjadi kehilangan kemampuan untuk menginhibisi pembentukan dinding sel bakteri[8]. Beberapa studi menyatakan bahwa selain ditemukan secara alami pada bakteri gram positif dan negatif, gen penyandi enzim beta-laktamase juga ditemukan pada plasmida dan transposon sehingga dapat ditransfer antarspesies bakteri[9]. Hal ini menyebabkan kemampuan resistensi akan antibiotik beta-laktam dapat menyebar dengan cepat[9]. Difusi antibiotik beta laktam ke dalam sel bakteri terjadi melalui perantaraan protein transmembran yang disebut porine dan kemampuan difusinya dipengaruhi oleh ukuran, muatan, dan sifat hidrofilik dari suatu antibiotik[8].
Mengatasi resistensi antibiotik beta-laktam

Untuk mengatasi degradasi cincing beta-laktam, beberapa antibiotik beta-laktam dikombinasikan dengan senyawa inhibitor enzim beta-laktamase seperti asam clavulanat, tazobactam, atau sulbactam[2]. Salah satu antibiotik beta-laktam yang resisten beta laktamase adalah augmentin, kombinasi amoxycillin dan asam klavulanat. Augmentin terbukti telah berhasil mengatasi infeksi bakteri pada saluran kemih dan kulit[10]. Asam klavulanat yng diproduksi dari hasil fermentasi Streptomyces clavuligerus memiliki kemampuan untuk menghambat sisi aktif enzim beta-laktamase sehingga menyebabkan enzim tersebut menjadi inaktif[11]. Beberapa jenis antibiotik beta-laktam (contohnya nafcillin) juga memiliki sifat resisten terhadap beta-laktamase karena memiliki rantai samping dengan letak khusus[2].
Referensi
- ^ a b Madigan MT, Martinko JM, (2000). Brock Biology of Microorganisms. Prentice Hall. ISBN 978-0-13-081922-2.
- ^ a b c Richard Schwalbe, Lynn Steele-Moore, Avery C. Goodwin (2007). Antimicrobial susceptibility testing protocols. CRC Press. ISBN 978-0824741006.
- ^ a b c d e f g h i j k l m Brian I. Duerden (1987). "Beta-Lactam Antibiotics in Systemic Infections" (PDF). Phil J Microbiol Infect Dis. 16 (2): 61–64.
- ^ MICHAEL D. REED, ROBERT C. STERN, CHERYL A. O'BRIEN, TOYOKO S. YAMASHITA, CAROLYN M. MYERS, JEFFREY L. BLUMERI (1985). "Pharmacokinetics of Imipenem and Cilastatin in Patients with Cystic Fibrosis" (PDF). ANTIMICROBIAL AGENTS AND CHEMOTHERAPY. 27 (4): 583–588.
- ^ a b c d e f Steeve Giguère (2007). Antimicrobial therapy in veterinary medicine. Wiley-Blackwell. ISBN 978-0813806563.
- ^ Office of Technology Assessment Congress of United States (1995). Impacts of Antibiotic-Resistant Bacteria. Diane Publishing Co.
- ^ a b R. Fontana, P. Canepari, M. M. Lleò, G. Satta (1990). "Mechanisms of resistance of enterococci to beta-lactam antibiotics". European Journal of Clinical Microbiology & Infectious Diseases. 9 (2): 103–105. doi:10.1007/BF01963633.
- ^ a b Ṛuben Vardanyan, Victor J. Hruby (2006). Synthesis of essential drugs. Elsevier Science. ISBN 978-0444521668.
- ^ a b Sherry F. Queener, J. Alan Webber (1986). Beta-lactam antibiotics for clinical use. Informa Healthcare. ISBN 978-0824773861.
- ^ Tan TH, Tay L, Yeo M, Feng PH. "Augmentin (Amoxycillin and clavulanic acid) in the treatment of urinary tact infections and skin and soft tissue infections" (PDF). Singapore Medical Journal (SMJ): 299–302.
- ^ C. READING, M. COLE (1997). "Clavulanic Acid: a Beta-Lactamase-Inhibiting Beta-Lactam from Streptomyces clavuligerus". ANTIMICROBIAL AGENT8 AIM CHEMOTHERAPY7. 11 (5): 852–857.
