Akuaporin
| Akuaporin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikasi | |||||||||
| Simbol | Aquaporin | ||||||||
| Pfam | PF00230 | ||||||||
| InterPro | IPR000425 | ||||||||
| PROSITE | PDOC00193 | ||||||||
| SCOP | 1fx8 | ||||||||
| SUPERFAMILY | 1fx8 | ||||||||
| TCDB | 1.A.8 | ||||||||
| |||||||||
Akuaporin, juga disebut saluran air, adalah protein membran integral yang tersusun dari famili besar protein intrinsik mayor yang membentuk pori pada membran sel, terutama memfasilitasi transpor air antarsel.[1] Berbagai membran sel dari bakteri, jamur, hewan, dan tumbuhan berbeda memiliki akuaporin yang menembusnya sehingga air dapat mengalir lebih cepat ke dalam dan ke luar sel dibandingkan dengan berdifusi melalui fosfolipid dwilapis.[2]
Nobel Kimia 2003 dianugrahkan bersama kepada Peter Agre atas penemuan akuaporin[3] dan Roderick MacKinnon atas penelitiannya pada struktur dan mekanisme saluran kalium.[4]
Kerusakan genetik yang melibatkan gen akuaporin telah berkaitan dengan sejumlah penyakit manusia, seperti diabetes insipidus nefrogenik dan optika neuromielitis.[5][6][7][8]
Sejarah
Mekanisme transpor air terfasilitasi dan kemungkinan keberadaan pori air telah menarik peneliti sejak tahun 1957.[9] Pada banyak sel, air berpindah ke dalam dan ke luar dengan osmosis melalui komponen lipid membran sel. Akibat dari permeabilitas air yang relatif tinggi pada beberapa sel epitel, sudah lama dicurigai bahwa terdapat beberapa mekanisme tambahan untuk transpor air melintasi membran. Solomon dan rekannya melakukan penelitian perintis pada permeabilitas air melintasi membran sel pada akhir 1950-an.[10][11] Pada pertengahan 1960-an, hipotesis alternatif ("model partisi–difusi") berusaha menetapkan bahwa molekul air terpartisi antara fase air dan fase lipid serta kemudian berdifusi melalui membran, melintasinya hingga interfase selanjutnya, meninggalkan lipid dan kembali ke fase air.[12][13] Penelitian oleh Parisi, Edelman, Carvounis, dan kawan-kawan menekankan tidak hanya pentingnya keberadaan saluran air, tetapi juga kemungkinan untuk meregulasi sifat permeabilitasnya.[14][15][16] Pada tahun 1990, eksperimen Verkman mendemonstrasikan ekspresi saluran air fungsional, mengindikasikan bahwa saluran air merupakan protein efektif.[17][18]
Penemuan
Saluran air belum ditemukan hingga tahun 1992 ketika akuaporin pertama, 'akuaporin-1' (semula dikenal sebagai CHIP 28), dilaporkan oleh Peter Agre, Universitas Johns Hopkins.[19] Pada tahun 1999, bersama dengan tim peneliti lainnya, Agre melaporkan gambar beresolusi tinggi pertama dari struktur tiga-dimensional akuaporin, dinamai, akuaporin-1.[20] Penelitian lanjutan menggunakan simulasi superkomputer mengidentifikasi jalur air ketika berpindah melalui saluran dan mendemonstrasikan bagaimana pori dapat membebaskan air untuk melaluinya tanpa lewatnya zat terlarut kecil.[21] Penelitian perintis yang menyusul penemuan saluran air oleh Agre dan koleganya membuat Agre memenangkan Penghargaan Nobel Kimia pada tahun 2003.[4] Agre mengatakan bahwa ia menemukan akuaporin "secara tidak sengaja." Ia sedang mempelajari antigen golongan darah Rh dan mengisolasi molekul Rh, tetapi molekul kedua sebesar 28 kilodalton (dan oleh sebab itu disebut 28K) tetap muncul. Pada awalnya mereka berpikir bahwa molekul tersebut merupakan fragmen molekul Rh, atau kontaminan, tetapi menjadi jenis molekul baru dengan fungsi yang tidak diketahui. Molekul ini muncul pada struktur seperti tubulus ginjal dan sel darah merah, serta terkait dengan protein asal beragam, seperti pada otak lalat buah, bakteri, lensa mata, dan jaringan tumbuhan.[20]
Akan tetapi, laporan pertama transpor air dimediasi protein melalui membran dilaporkan oleh Gheorghe Benga pada tahun 1986, sebelum publikasi pertama Agre pada topik tersebut.[22][23] Hal ini menyebabkan kontroversi karena karya Benga cukup diakui oleh Agre maupun Komite Penghargaan Nobel.[24]
Fungsi

Akuaporin merupakan "sistem leding untuk sel". Air berpindah melalui sel dalam jalur terorganisasi, sangat cepat pada jaringan yang memiliki saluran air akuaporin.[25] Bertahun-tahun, ilmuwan berasumsi bahwa air merembes melalui membran sel, dan sebagian air melakukannya. Akan tetapi, pernyataan ini tidak dapat menjelaskan bagaimana air dapat berpindah dengan sangat cepat melalui beberapa sel.[25]
Akuaporin secara selektif menyalurkan molekul air ke dalam dan ke luar sel, sembari mencegah lewatnya ion dan zat terlarut lainnya. Juga dikenal sebagai saluran air, akuaporin merupakan protein pori membran integral. Beberapa di antaranya, dikenal sebagai akuagliseroporin, juga memtranspor molekul terlarut takbermuatan lainnya, termasuk amonia, CO2, gliserol, dan urea. Sebagai contoh, saluran akuaporin 3 memiliki pori selebar 8–10 Ångström dan membebaskan lewatnya molekul hidrofilik berkisar antara 150 hingga 200 Da. Akan tetapi, pori air sepenuhnya menghalangi ion, seperti proton, penting untuk melindungi perbedaan potensial elektrokimia membran.[26]
Molekul air melintas melalui pori saluran dalam satu berkas. Keberadaan saluran air meningkatkan permeabilitas membran untuk air. Saluran air ini juga penting untuk sistem transpor air dalan tumbuhan[27] dan toleran terhadap tekanan kekeringan serta garam tinggi.[28]
Struktur


Protein akuaporin tersusun atas berkas enam heliks-α transmembran. Struktur ini tertanam di dalam membran sel. Ujung amino dan karboksil menghadap ke bagian dalam sel.[26][29] Belahan amino dan karboksil serupa satu sama lain, tampaknya mengulangi pola nukleotida. Beberapa peneliti meyakini bahwa hal ini tercipta oleh penggandaan gen awal berukuran setengah. Di antara heliks terdapat lima wilayah (A–E) yang menggelung ke dalam atau ke luar membran sel, dua di antaranya hidrofobik (B, E), dengan pola asparagin–prolin–alanin ("motif NPA"). Susunan ini menciptakan bentuk jam pasir tersendiri, membuat saluran air menyempit di bagian tengah dan melebar pada setiap ujungnya.
Tempat lain dan bahkan lebih sempit di dalam saluran adalah "filter selektivitas ar/R", gugusan asam amino yang memungkinkan akuaporin untuk memperbolehkan melintas atau menghalangi secara selektif molekul yang berbeda.
Akuaporin membentuk empat gugus bagian di dalam membran sel, dengan setiap empat monomer berlaku sebagai saluran air.[26] Akuaporin yang berbeda memiliki ukuran saluran air yang berbeda pula, jenis terkecil hanya memungkinkan air yang melintasinya.
Profil sinar-X menunjukkan bahwa akuaporin memiliki dua gerbang berbentuk kerucut. Bentuk jam pasir ini mungkin merupakan hasil dari proses seleksi alam terhadap permeabilitas optimal. Telah ditunjukkan bahwa gerbang kerucut dengan sudut buka yang sesuai memang menyediakan peningkatan besar permeabilitas saluran hidrodinamik.[30]
Motif NPA
Saluran akuaporin muncul dalam simulasi yang hanya menyediakan air yang dapat melintas, dengan molekul secara efektif mengantre dalam satu berkas. Dipandu oleh medan listrik lokal akuaporin, oksigen pada setiap molekul air menghandap ke depan ketika masuk, berputar saat setengah jalan, dan meninggalkan akuaporin dengan oksigen menghadap belakang.[31] Mengapa putaran ini terjadi hingga saat ini belum terlalu jelas. Beberapa peneliti mengidentifikasi medan elektrostatik yang dibangkitkan oleh dua setengah-heliks akuaporin HB dan HE sebagai alasannya. Peneliti lain menduga bahwa ikatan hidrogen antara asam amino asparagin dalam dua wilayah NPA dengan oksigen pada air sebagai penyebab putaran. Hal ini tetap belum jelas walaupun perputaran molekul air tidak memiliki signifikansi biologis. Penelitian awal berspekulasi bahwa orientasi "bipolar" molekul air menghalangi aliran proton melalui mekanisme Grotthuss.[32] Penelitian lebih terkini mempertanyakan interpretasi ini dan menekankan penghalang elektrostatik sebagai alasan penghalangan proton. Dalam pandangan terakhir, putaran molekul air hanya merupakan efek samping dari penghalang elektrostatik. Saat ini (2008), asal medan elektrostatik menjadi bahan perdebatan. Sementara beberapa penelitian terutama mempertimbangkan medan listrik dibangkitkan oleh setengah-heliks protein HB dan HE, penelitian lain menekankan efek desolvasi ketika proton memasuki pori akuaporin yang sempit.
Persebaran spesies
Pada mamalia
Terdapat tigabelas jenis akuaporin yang diketahui pada mamalia, dan enam di antaranya terletak di ginjal,[33] tetapi keberadaan lebih banyak dicurigai. Akuaporin yang paling dipelajari dibandingkan dalam tabel berikut.
| Jenis | Lokasi[34] | Fungsi[34] |
|---|---|---|
| Akuaporin 1 | Reabsorpsi air | |
| Akuaporin 2 | Reabsorpsi air dalam respons ADH[35] | |
| Akuaporin 3 | Reabsorpsi air dan permeabilitas gliserol | |
| Akuaporin 4 | Reabsorpsi air |
Pada tumbuhan
Pada tumbuhan, air diserap dari tanah melalui akar dengan melewati korteks menuju jaringan vaskular. Terdapat tiga rute untuk air mengalir di dalam jaringan tersebut, dikenal sebagai lintasan apoplastik, simplastik, dan transelular.[36] Secara khusus, akuaporin ditemukan pada membran vakuola, sebagai tambahan pada membran plasma tumbuhan; lintasan transelular melibatkan transpor air melintasi membran plasma dan vakuola.[37] Ketika akar tumbuhan terpapar dengan raksa klorida, yang diketahui menginhibisi akuaporin, aliran air sangat berkurang walaupun aliran ion tidak demikian, mendukung pandangan bahwa terdapat mekanisme transpor air tersendiri terpisah dari transpor ion: akuaporin.
Sebagai tambahan pemulihan osmolaritas sitosol normal, akuaporin dapat memainkan peran besar dalam pertumbuhan panjang dengan membebaskan pemasukan air ke dalam sel yang mengembang, proses penting untuk menunjang perkembangan tumbuhan.[37]
Akuaporin pada tumbuhan terbagi ke dalam lima subfamili homolog utama, atau kelompok:[38]
- Protein intrinsik membran plasma (PIP)[39]
- Protein intrinsik tonoplas (TIP)[40]
- protein intrinsik serupa nodulin-26 (NIP)[41]
- protein intrinsik basal kecil (SIP)[42]
- protein intrinsik X (XIP)
Kelima subfamili ini kemudian dibagi ke dalam subkelompok evolusioner lebih kecil berdasarkan sekuens DNA-nya. Kluster PIP dibagi ke dalam dua subkelompok, yaitu PIP1 dan PIP2, sementara kluster TIP dibagi ke dalam lima subkelompok, yaitu TIP1, TIP2, TIP3, TIP4, dan TIP5. Setiap subkelompok dibagi kembali ke dalam isomernya, seperti PIP1;1 dan PIP1;2. Di dalam pemilihan beragam isomer akuaporin pada tumbuhan, terdapat juga pola unik dari ekspresi spesifik sel dan jaringan.[37]
Pembisuan akuaporin tumbuhan telah dikaitkan dengan penurunan konduktansi hidraulis dan fotosintesis daun.[43]
Pemintuan akuaporin melakukan penghentian aliran air melalui pori protein. Tindakan ini mungkin dilakukan atas beberapa alasan, sebagai contoh ketika tumbuhan memiliki jumlah air seluler yang sedikit akibat kekeringan.[44] Pemintuan akuaporin dilakukan oleh interaksi antara mekanisme pemintuan dengan akuaporin, yang menyebabkan perubahan tiga dimensi pada protein sehingga menutup pori dan, kemudian, menolak aliran air melalui pori. Pada tumbuhan, telah dilihat bahwa terdapat setidaknya dua bentuk pemintuan akuaporin. Dua bentuk pemintuan tersebut adalah pemintuan oleh defosforilasi sejumlah residu serin, yang dapat dilihat sebagai respons kekeringan, dan protonasi residu histidin spesifik dalam respons banjir. Fosforilasi akuaporin juga telah dikaitkan dengan pembukaan dan penutupan mahkota bunga dalam respons terhadap temperatur.[45][46]
Pada arkea, bakteri, dan jamur
Sejumlah bakteri dan banyak organisme lainnya mengekspresikan akuaporin. Akuaporin telah ditemukan pula pada jamur Saccharomyces cerevisiae (ragi), Dictyostelium, Candida, dan Ustilago serta protozoa Trypanosoma dan Plasmodium.[27]
Signifikansi klinis
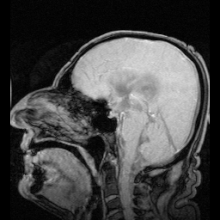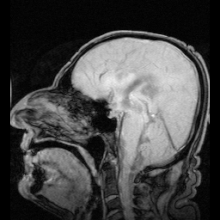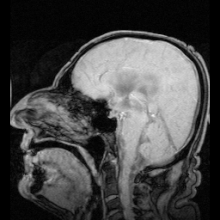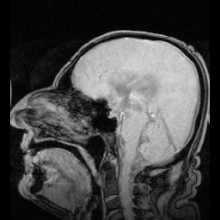
Terdapat dua contoh jelas penyakit teridentifikasi sebagai akibat dari mutasi pada akuaporin:
- Mutasi pada gen akuaporin-2 menyebabkan diabetes insipidus nefrogenik herediter pada manusia.[6]
- Tikus homozigot untuk mutasi inaktivasi pada gen aquaporin-0 berkembang menjadi katarak kongenital.[47]
Sejumlah kecil orang teridentifikasi dengan defisiensi akuaporin-1 parah atau total. Mereka, secara umum, sehat, tetapi menunjukkan kecacatan dalam kemampuan untuk mengonsentrasikan zat terlarut dalam urin dan untuk mengonservasi air ketika kurang meminum air.[48][49] Tikus dengan delesi bertarget akuaporin-1 juga menunjukkan defisiensi dalam konservasi air akibat ketidakmampuan untuk mengonsentrasi zat terlarut di dalam medula ginjal dengan multiplikasi lawan arus.[50]
Sebagai tambahan atas perannya dalam diabetes insipidus nefrogenik terdeterminasi genetik, akuaporin juga memainkan peran kunci dalam bentuk diabetes insipidus nefrogenik perolehan (gangguan menyebabkan peningkatan produksi urin).[51] Diabetes insipidus nefrogenik perolehan pada tikus dapat menyebabkan terganggunya regulasi akuaporin-2 akibat administrasi garam litium, rendahnya konsentrasi kalium di dalam darah (hipokalemia), dan tingginya konsentrasi kalsium di dalam darah (hiperkalsemia).[52][53][54]
Reaksi autoimun menyerang akuaporin 4 pada manusia menghasilkan penyakit Devic.[5] Jika akuaporin dapat dimanipulasi, hal tersebut dapat berpotensi menyelesaikan masalah medis seperti retensi cairan pada penyakit jantung dan edema otak setelah strok.[25]
Referensi
- ^ Agre P (2006). "The aquaporin water channels". Proc Am Thorac Soc. 3 (1): 5–13. doi:10.1513/pats.200510-109JH. PMC 2658677
 . PMID 16493146.
. PMID 16493146.
- ^ Cooper G (2009). The Cell: A Molecular Approach. Washington, DC: ASM PRESS. hlm. 544. ISBN 978-0-87893-300-6.
- ^ Knepper MA, Nielsen S (2004). "Peter Agre, 2003 Nobel Prize winner in chemistry". J. Am. Soc. Nephrol. 15 (4): 1093–5. doi:10.1097/01.ASN.0000118814.47663.7D. PMID 15034115.
- ^ a b "The Nobel Prize in Chemistry 2003". Nobel Foundation. Diakses tanggal 2008-01-23.
- ^ a b Lennon VA, Kryzer TJ, Pittock SJ, Verkman AS, Hinson SR (2005). "IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel". J. Exp. Med. 202 (4): 473–7. doi:10.1084/jem.20050304. PMC 2212860
 . PMID 16087714.
. PMID 16087714.
- ^ a b Bichet DG (2006). "Nephrogenic diabetes insipidus". Adv Chronic Kidney Dis. 13 (2): 96–104. doi:10.1053/j.ackd.2006.01.006. PMC 2124392
 . PMID 16580609.
. PMID 16580609.
- ^ Agre P, Kozono D (2003). "Aquaporin water channels: molecular mechanisms for human diseases". FEBS Lett. 555 (1): 72–8. doi:10.1016/S0014-5793(03)01083-4. PMID 14630322.
- ^ Schrier RW (2007). "Aquaporin-related disorders of water homeostasis". Drug News Perspect. 20 (7): 447–53. doi:10.1358/dnp.2007.20.7.1138161. PMID 17992267.
- ^ Parisi M, Dorr RA, Ozu M, Toriano R (December 2007). "From membrane pores to aquaporins: 50 years measuring water fluxes". J Biol Phys. 33 (5–6): 331–43. doi:10.1007/s10867-008-9064-5. PMC 2565768
 . PMID 19669522.
. PMID 19669522.
- ^ Paganelli CV, Solomon AK (November 1957). "The rate of exchange of tritiated water across the human red cell membrane". J. Gen. Physiol. 41 (2): 259–77. doi:10.1085/jgp.41.2.259. PMC 2194835
 . PMID 13475690.
. PMID 13475690.
- ^ Goldstein DA; Solomon AK (1960-09-01). "Determination of equivalent pore radius for human red cells by osmotic pressure measurement". The Journal of General Physiology. 44: 1–17. doi:10.1085/jgp.44.1.1. PMC 2195086
 . PMID 13706631.
. PMID 13706631.
- ^ Dainty, J.; House, C. R. (1966-07-01). "An examination of the evidence for membrane pores in frog skin". The Journal of Physiology. 185 (1): 172–184. doi:10.1113/jphysiol.1966.sp007979. PMC 1395865
 . PMID 5965891.
. PMID 5965891.
- ^ Hanai T, Haydon DA (1966-08-01). "The permeability to water of bimolecular lipid membranes". Journal of Theoretical Biology. 11 (3): 370–382. doi:10.1016/0022-5193(66)90099-3. PMID 5967438.
- ^ Parisi M, Bourguet J (1984-01-01). "Effects of cellular acidification on ADH-induced intramembrane particle aggregates". American Journal of Physiology. Cell Physiology. 246 (1): C157–C159. doi:10.1152/ajpcell.1984.246.1.c157. ISSN 0363-6143. PMID 6320654.
- ^ Edelman, Isidore S. (25 Mei 1965). "Hydrogen-ion dependence of the antidiuretic action of vasopressin, oxytocin and deaminooxytocin". Biochimica et Biophysica Acta (BBA) - Biophysics including Photosynthesis. 102: 185–197. doi:10.1016/0926-6585(65)90212-8 – via Elsevier Science Direct.
- ^ Carvounis CP, Levine SD, Hays RM (1979-05-01). "pH-Dependence of water and solute transport in toad urinary bladder". Kidney International. 15 (5): 513–519. doi:10.1038/ki.1979.66. ISSN 0085-2538. PMID 39188.
- ^ Zhang, RB; Logee, KA; Verkman, AS (15 September 1990). "Expression of mRNA coding for kidney and red cell water channels in Xenopus oocytes". The Journal of Biological Chemistry. 265 (26): 15375–15378. ISSN 0021-9258. PMID 2394728.
- ^ Zhang, R; Alper, S L; Thorens, B; Verkman, A S (1991-11-01). "Evidence from oocyte expression that the erythrocyte water channel is distinct from band 3 and the glucose transporter". Journal of Clinical Investigation. 88 (5): 1553–1558. doi:10.1172/JCI115466. PMC 295670
 . PMID 1939644.
. PMID 1939644.
- ^ Agre P, Preston GM, Smith BL, Jung JS, Raina S, Moon C, Guggino WB, Nielsen S (1 October 1993). "Aquaporin CHIP: the archetypal molecular water channel". Am. J. Physiol. 265 (4 Pt 2): F463–76. PMID 7694481.
- ^ a b Mitsuoka K, Murata K, Walz T, Hirai T, Agre P, Heymann JB, Engel A, Fujiyoshi Y (1999). "The structure of aquaporin-1 at 4.5-A resolution reveals short alpha-helices in the center of the monomer". J. Struct. Biol. 128 (1): 34–43. doi:10.1006/jsbi.1999.4177. PMID 10600556.
- ^ de Groot BL, Grubmüller H (2005). "The dynamics and energetics of water permeation and proton exclusion in aquaporins". Curr. Opin. Struct. Biol. 15 (2): 176–83. doi:10.1016/j.sbi.2005.02.003. PMID 15837176.
- ^ Benga G, Popescu O, Pop VI, Holmes RP (1986). "p-(Chloromercuri)benzenesulfonate binding by membrane proteins and the inhibition of water transport in human erythrocytes". Biochemistry. 25 (7): 1535–8. doi:10.1021/bi00355a011. PMID 3011064.
- ^ Kuchel PW (2006). "The story of the discovery of aquaporins: convergent evolution of ideas--but who got there first?". Cell. Mol. Biol. (Noisy-le-grand). 52 (7): 2–5. PMID 17543213.
- ^ Benga, G. "Gheorghe Benga". Ad Astra - Online project for the Romanian Scientific Community. Diarsipkan dari versi asli tanggal December 25, 2007. Diakses tanggal 5 April 2008.
- ^ a b c A Conversation With Peter Agre: Using a Leadership Role to Put a Human Face on Science, Oleh Claudia Dreifus, New York Times, 26 Januari 2009
- ^ a b c Gonen T, Walz T (2006). "The structure of aquaporins". Q. Rev. Biophys. 39 (4): 361–96. doi:10.1017/S0033583506004458. PMID 17156589.
- ^ a b Kruse E, Uehlein N, Kaldenhoff R (2006). "The aquaporins". Genome Biol. 7 (2): 206. doi:10.1186/gb-2006-7-2-206. PMC 1431727
 . PMID 16522221.
. PMID 16522221.
- ^ Xu Y, et al. (2014). "A banana aquaporin gene". BMC Plant Biology. 14 (1): 59. doi:10.1186/1471-2229-14-59. PMC 4015420
 . PMID 24606771.
. PMID 24606771.
- ^ Fu D, Lu M (2007). "The structural basis of water permeation and proton exclusion in aquaporins". Mol. Membr. Biol. 24 (5–6): 366–74. doi:10.1080/09687680701446965. PMID 17710641.
- ^ Gravelle S, Joly L, Detcheverry F, Ybert C, Cottin-Bizonne C, Bocquet L (2013). "Optimizing water permeability through the hourglass shape of aquaporins". PNAS. 110 (41): 16367–16372. arXiv:1310.4309
 . Bibcode:2013PNAS..11016367G. doi:10.1073/pnas.1306447110. PMC 3799357
. Bibcode:2013PNAS..11016367G. doi:10.1073/pnas.1306447110. PMC 3799357  . PMID 24067650.
. PMID 24067650.
- ^ de Groot BL, Grubmüller H (2001). "Water permeation across biological membranes: mechanism and dynamics of aquaporin-1 and GlpF". Science. 294 (5550): 2353–2357. Bibcode:2001Sci...294.2353D. doi:10.1126/science.1062459. PMID 11743202.
- ^ Tajkhorshid E, Nollert P, Jensen MØ, Miercke LJ, O'Connell J, Stroud RM, Schulten K (2002). "Control of the selectivity of the aquaporin water channel family by global orientational tuning". Science. 296 (5567): 525–30. Bibcode:2002Sci...296..525T. doi:10.1126/science.1067778. PMID 11964478.
- ^ Nielsen S, Frøkiaer J, Marples D, Kwon TH, Agre P, Knepper MA (2002). "Aquaporins in the kidney: from molecules to medicine". Physiol. Rev. 82 (1): 205–44. doi:10.1152/physrev.00024.2001. PMID 11773613.
- ^ a b Unless else specified in table boxes, then ref is: Walter F. Boron (2005). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. ISBN 1-4160-2328-3. Halaman 842
- ^ Sands JM (2012). "Aquaporin 2: Not Just for Moving Water". Journal of the American Society of Nephrology: JASN. 23 (9): 1443–1444. doi:10.1681/ASN.2012060613. PMC 3431422
 .
.
- ^ Chaumont, F; Tyerman, SD (2014-04-01). "Aquaporins: Highly Regulated Channels Controlling Plant Water Relations". Plant Physiology. 164 (4): 1600–1618. doi:10.1104/pp.113.233791. PMC 3982727
 . PMID 24449709.
. PMID 24449709.
- ^ a b c Johansson, I; Karlsson, M; Johanson, U; Larsson, C; Kjellbom, P (2000-05-01). "The role of aquaporins in cellular and whole plant water balance". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1465 (1–2): 324–342. doi:10.1016/S0005-2736(00)00147-4.
- ^ Kaldenhoff R, Bertl A, Otto B, Moshelion M, Uehlein N (2007). "Characterization of plant aquaporins". Meth. Enzymol. Methods in Enzymology. 428: 505–31. doi:10.1016/S0076-6879(07)28028-0. ISBN 978-0-12-373921-6. PMID 17875436.
- ^ Kammerloher W, Fischer U, Piechottka GP, Schäffner AR (1994). "Water channels in the plant plasma membrane cloned by immunoselection from a mammalian expression system". Plant J. 6 (2): 187–99. doi:10.1046/j.1365-313X.1994.6020187.x. PMID 7920711.
- ^ Maeshima M (2001). "TONOPLAST TRANSPORTERS: Organization and Function". Annu Rev Plant Physiol Plant Mol Biol. 52 (1): 469–497. doi:10.1146/annurev.arplant.52.1.469. PMID 11337406.
- ^ Wallace IS, Choi WG, Roberts DM (2006). "The structure, function and regulation of the nodulin 26-like intrinsic protein family of plant aquaglyceroporins". Biochim. Biophys. Acta. 1758 (8): 1165–75. doi:10.1016/j.bbamem.2006.03.024. PMID 16716251.
- ^ Johanson U, Gustavsson S (2002). "A new subfamily of major intrinsic proteins in plants". Mol. Biol. Evol. 19 (4): 456–61. doi:10.1093/oxfordjournals.molbev.a004101. PMID 11919287.
- ^ Sade, N; Shatil-Cohen, A; Attia, Z; Maurel, C; Boursiac, Y; Kelly, G; Granot, D; Yaaran, A; Lerner, S (2014-11-01). "The Role of Plasma Membrane Aquaporins in Regulating the Bundle Sheath-Mesophyll Continuum and Leaf Hydraulics". Plant Physiology (dalam bahasa Inggris). 166 (3): 1609–1620. doi:10.1104/pp.114.248633. PMC 4226360
 . PMID 25266632.
. PMID 25266632.
- ^ Kaldenhoff R, Fischer M (2006). "Aquaporins in plants". Acta Physiol (Oxf). 187 (1–2): 169–76. doi:10.1111/j.1748-1716.2006.01563.x. PMID 16734753.
- ^ Azad AK, Sawa Y, Ishikawa T, Shibata H (2004). "Phosphorylation of plasma membrane aquaporin regulates temperature-dependent opening of tulip petals". Plant Cell Physio. 45 (5): 608–17. doi:10.1093/pcp/pch069. PMID 15169943.
- ^ Azad AK, Katsuhara M, Sawa Y, Ishikawa T, Shibata H (2008). "Characterization of four plasma membrane aquaporins in tulip petals: a putative homolog is regulated by phosphorylation". Plant Cell Physiol. 49 (8): 1196–208. doi:10.1093/pcp/pcn095. PMID 18567892.
- ^ Okamura T, Miyoshi I, Takahashi K, Mototani Y, Ishigaki S, Kon Y, Kasai N (2003). "Bilateral congenital cataracts result from a gain-of-function mutation in the gene for aquaporin-0 in mice". Genomics. 81 (4): 361–8. doi:10.1016/S0888-7543(03)00029-6. PMID 12676560.
- ^ Radin, M. Judith; Yu, Ming-Jiun; Stoedkilde, Lene; Miller, R Lance; Hoffert, Jason D.; Frokiaer, Jorgen; Pisitkun, Trairak; Knepper, Mark A. (2017-03-06). "Aquaporin-2 Regulation in Health and Disease". Veterinary clinical pathology / American Society for Veterinary Clinical Pathology. 41 (4): 455–470. doi:10.1111/j.1939-165x.2012.00488.x. ISSN 0275-6382. PMC 3562700
 . PMID 23130944.
. PMID 23130944.
- ^ King, Landon S; Choi, Michael; Fernandez, Pedro C; Cartron, Jean-Pierre; Agre, Peter (2001-07-19). "Defective Urinary Concentrating Ability Due to a Complete Deficiency of Aquaporin-1". New England Journal of Medicine. 345 (3): 175–179. doi:10.1056/NEJM200107193450304. PMID 11463012.
- ^ Schnermann, Jurgen; Chou, Chung-Lin; Ma, Tonghui; Traynor, Timothy; Knepper, Mark A; Verkman, AS (1998-08-04). "Defective proximal tubular fluid reabsorption in transgenic aquaporin-1 null mice". Proceedings of the National Academy of Sciences of the United States of America. 95 (16): 9660–9664. Bibcode:1998PNAS...95.9660S. doi:10.1073/pnas.95.16.9660. ISSN 0027-8424. PMC 21395
 . PMID 9689137.
. PMID 9689137.
- ^ Khanna A (2006). "Acquired nephrogenic diabetes insipidus". Semin. Nephrol. 26 (3): 244–8. doi:10.1016/j.semnephrol.2006.03.004. PMID 16713497.
- ^ Christensen, S; Kusano, E; Yusufi, A N; Murayama, N; Dousa, TP (1985-06-01). "Pathogenesis of nephrogenic diabetes insipidus due to chronic administration of lithium in rats". Journal of Clinical Investigation. 75 (6): 1869–1879. doi:10.1172/JCI111901. PMC 425543
 . PMID 2989335.
. PMID 2989335.
- ^ Marples, D; Frøkiaer, J; Dørup, J; Knepper, M A; Nielsen, S (1996-04-15). "Hypokalemia-induced downregulation of aquaporin-2 water channel expression in rat kidney medulla and cortex". Journal of Clinical Investigation. 97 (8): 1960–1968. doi:10.1172/JCI118628. PMC 507266
 . PMID 8621781.
. PMID 8621781.
- ^ Marples, D; Christensen, S; Christensen, EI; Ottosen, P D; Nielsen, S (1995-04-01). "Lithium-induced downregulation of aquaporin-2 water channel expression in rat kidney medulla". Journal of Clinical Investigation. 95 (4): 1838–1845. doi:10.1172/JCI117863. PMC 295720
 . PMID 7535800.
. PMID 7535800.
Pranala luar
- MeSH Aquaporins
- Animasi[pranala nonaktif permanen] (berkas MPEG pada nobel.se)
- Computational Biomolecular Dynamics Group. "Aquaporin movies and pictures". Max Planck Institute. Diarsipkan dari versi asli tanggal April 25, 2006. Diakses tanggal 23 Januari 2008.
- Grup Biofisika Teoretis dan Komputasional. "Struktur, Dinamika, dan Fungsi Akuaporin". Universitas Illinois di Urbana-Champaign. Diakses tanggal 23 Januari 2008.
