Ikatan kovalen koordinasi
Ikatan kovalen koordinasi,[1] juga disebut sebagai ikatan datif,[2] ikatan dipolar,[3] atau ikatan koordinat[4] adalah suatu jenis ikatan kovalen dua pusat, dua elektron yang kedua elektron tersebut berasal dari atom yang sama. Pengikatan ion logam pada ligan melibatkan jenis interaksi ini.[5] Jenis pengikatan ini menjadi hal yang penting pada teori asam–basa Lewis.
Ikatan koordinasi umum ditemukan pada senyawa koordinasi.[6]
Contoh[sunting | sunting sumber]

Ikatan kovalen koordinasi terdapat di mana-mana.[7] Dalam seluruh kompleks logam-akuo [M(H2O)n]m+, ikatan antara air dan kation logam digambarkan sebagai ikatan kovalen koordinasi. Interaksi logam-ligan di sebagian besar senyawa organologam dan sebagian besar senyawa koordinasi dijelaskan dengan cara yang sama.
Istilah ikatan dipolar digunakan dalam kimia organik untuk senyawa seperti oksida amina yang struktur elektroniknya dapat dijelaskan dalam bentuk basa amina yang menyumbangkan dua elektron ke sebuah atom oksigen.
- R3N → O
Panah → menunjukkan bahwa kedua elektron dalam ikatan berasal dari moietas amina. Dalam ikatan kovalen standar, setiap atom menyumbangkan satu elektron. Oleh karena itu, deskripsi alternatif adalah bahwa amina memberikan satu elektron ke atom oksigen, yang kemudian digunakan, dengan elektron tidak berpasangan yang tersisa pada atom nitrogen, untuk membentuk ikatan kovalen standar. Proses transfer elektron dari nitrogen ke oksigen menghasilkan muatan formal, sehingga struktur elektroniknya juga dapat digambarkan sebagai
- R3N+O−
Struktur elektronik ini memiliki dipol listrik, oleh karena itu dinamakan ikatan polar. Pada kenyataannya, atom membawa muatan parsial; semakin banyak atom elektronegatif dari dua yang terlibat dalam ikatan biasanya akan membawa muatan negatif parsial. Satu pengecualian untuk ini adalah karbon monoksida. Dalam hal ini, atom karbon membawa muatan negatif parsial meskipun kurang elektronegatif daripada oksigen.
Contoh ikatan kovalen koordinasi adalah interaksi antara molekul amonia, suatu basa Lewis dengan pasangan elektron bebas pada atom nitrogen, dan boron trifluorida, suatu asam Lewis dengan atom boron yang memiliki elektron oktet yang tidak lengkap. Dalam membentuk aduk, atom boron mencapai konfigurasi oktet.
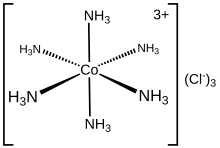
Struktur elektronik dari kompleks koordinasi dapat dijelaskan dalam bentuk kumpulan ligan yang masing-masing menyumbangkan sepasang elektron ke pusat logam. Misalnya, dalam heksaminakobalt(III) klorida, setiap ligan amonia menyumbangkan pasangan elektron bebasnya ke ion kobalt(III). Dalam hal ini, ikatan yang terbentuk digambarkan sebagai ikatan koordinasi.
Referensi[sunting | sunting sumber]
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "dipolar bond".
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "dative bond".
- ^ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "coordinate bond".
- ^ Ariyarathna, Isuru. First Principle Studies on Ground and Excited Electronic States: Chemical Bonding in Main-Group Molecules, Molecular Systems with Diffuse Electrons, and Water Activation using Transition Metal Monoxides (dalam bahasa Inggris).
- ^ Khare, E., Holten-Andersen, N. & Buehler, M.J. Transition-metal coordinate bonds for bioinspired macromolecules with tunable mechanical properties. Nat Rev Mater 6, 421–436 (2021). https://doi.org/10.1038/s41578-020-00270-z
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
