Metilasi

Dalam ilmu kimia, metilasi menunjukkan penambahan (adisi) suatu gugus metil pada suatu substrat, atau penggantian (substitusi) suatu atom (atau gugus) oleh gugus metil. Metilasi adalah bentuk dari alkilasi, dengan suatu gugus metil, dan bukan rantai karbon panjang, menggantikan sebuah atom hidrogen. Istilah-istilah ini biasanya digunakan dalam kimia, biokimia, ilmu tanah, dan ilmu biologi.
Dalam sistem biologis, metilasi dikatalisis oleh enzim; metilasi tersebut dapat terlibat dalam modifikasi logam berat, pengaturan ekspresi gen, pengaturan fungsi protein, dan pemrosesan RNA. Metilasi in vitro dari sampel jaringan juga merupakan salah satu metode untuk mengurangi pewarnaan artefak histologi. Kebalikan dari metilasi disebut demetilasi.
Biologi[sunting | sunting sumber]
Dalam sistem biologis, metilasi dicapai oleh enzim; metilasi dapat memodifikasi logam berat, mengatur ekspresi gen, pemrosesan RNA dan fungsi protein. Ini telah diakui sebagai proses kunci yang mendasari epigenetika.
Metanogenesis[sunting | sunting sumber]
Metanogenesis, proses yang menghasilkan metana, adalah hasil dari serangkaian reaksi metilasi. Reaksi-reaksi ini dipengaruhi oleh serangkaian enzim yang dipendam oleh keluarga mikrob anaerobik.[1]

O-Metiltransferase[sunting | sunting sumber]
Berbagai macam fenol mengalami O-metilasi untuk mengasilkan turunan anisola. Proses ini, dikatalisasi oleh enzim seperti kafeoil-CoA O-metiltransferase, adalah reaksi kunci dalam biosintesis lignol, prekursor bagi lignin, komponen struktural utama tumbuhan.
5-O-metilasi[sunting | sunting sumber]
Tanaman menghasilkan flavonoid dan isoflavon dengan metilasi pada gugus hidroksil, yaitu ikatan metoksi. 5-O-metilasi ini mempengaruhi kelarutan flavonoid dalam air. Contohnya adalah 5-O-metilgenistein, 5-O-metilmirisetin atau 5-O-metilkuersetin, juga dikenal sebagai azaleatin.
Metionin sintase[sunting | sunting sumber]

Metionin sintase meregenerasi metionin (Met) dari homosistein (Hcy). Reaksi keseluruhan mengubah 5-metiltetrahidrofolat (N5-MeTHF) menjadi tetrahidrofolat (THF) saat mentransfer gugus metil ke Hcy untuk membentuk Met. Metionin sintase dapat bergantung pada kobalamin dan tidak bergantung pada kobalamin: tumbuhan memiliki keduanya, hewan bergantung pada bentuk bergantung-pada-metilkobalamin.
Dalam bentuk enzim yang tergantung metilkobalamin, reaksi berlangsung dengan dua langkah dalam reaksi ping-pong. Enzim awalnya prima menjadi keadaan reaktif dengan transfer gugus metil dari N5-MeTHF to Co(I) dalam kobalamin (Cob) yang terikat enzim, membentuk metil-kobalamin (Me-Cob) yang sekarnag mengandung Me-Co(III) dan mengaktivasi enzim. Kemudian, Hcy yang telah terkoordinasi dengan seng yang terikat enzim untuk membentuk tiolat reaktif yang bereaksi dengan Me-Cob. Gugus metil yang teraktivasi dipindahkan dari Me-Cob ke Hcy tiolat, yang meregenerasi Co(I) dalam Cob, dan Met dilepaskan dari enzim.[2]
Logam berat: arsen, raksa, kadmium[sunting | sunting sumber]
Biometilasi adalah jalur untuk mengubah beberapa unsur berat menjadi turunan yang lebih mampu bergerak atau lebih mematikan yang dapat memasuki rantai makanan. Biometilasi senyawa arsen dimulai dengan pembentukan metanarsonat. Dengan demikian, senyawa arsen anorganik trivalensi dimetilasi untuk menghasilkan metanarsonat. S-adenosilmetionin adalah donor metil. Metanarsonat adalah prekursor untuk dimetilarsonat, lagi-lagi oleh siklus reduksi (menjadi asam metilarsonat) diikuti oleh metilasi kedua.[3] Jalur terkait berlaku untuk biosintesis metilmerkuri.
Kimia[sunting | sunting sumber]
Istilah metilasi dalam kimia organik mengacu pada proses alkilasi yang digunakan untuk menggambarkan pengiriman suatu gugus CH3.[4]
Metilasi elektrofilik[sunting | sunting sumber]
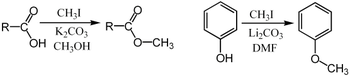
Metilasi umumnya dilakukan menggunakan sumber metil elektrofilik seperti iodometana,[5] dimetil sulfat,[6][7] dimetil karbonat,[8] atau tetrametilamonium klorida.[9] Pereaksi metilasi yang kurang umum tetapi lebih kuat (dan lebih berbahaya) termasuk metil triflat,[10] diazometana,[11] dan metil fluorosulfonat. Semua pereaksi ini bereaksi melalui substitusi nukleofilik SN2. Misalnya, suatu karboksilat dapat dimetilasi pada oksigen untuk memberikan metil ester; suatu garam alkoksida RO− mungkin juga termetilasi untuk memberikan eter, ROCH3; atau enolat keton dapat termetilasi pada karbon untuk menghasilkan keton baru.
Metilasi Purdie adalah spesifik untuk metilasi pada oksigen pada karbohidrat menggunakan iodometana dan perak oksida.[12]
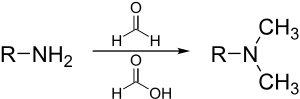
Metilasi Eschweiler–Clarke[sunting | sunting sumber]
Reaksi Eschweiler–Clarke adalah metode untuk metilasi amina.[13] Metode ini menghindari risiko kuaternisasi, yang terjadi ketika amina dimetilasi dengan metil halida.
Diazometana dan trimetilsilildiazometana[sunting | sunting sumber]
Diazometana dan analognya yang lebih aman trimetilsilildiazometana memetilasi asam karboksilat, fenol, dan bahkan alkohol:
- RCO2H + tmsCHN2 + CH3OH → RCO2CH3 + CH3Otms + N2
Metode ini menawarkan keuntungan bahwa produk samping mudah dikeluarkan dari campuran produk.[14]
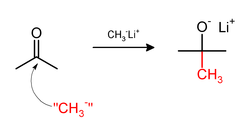
Metilasi nukleofilik[sunting | sunting sumber]
Metilasi terkadang melibatkan penggunaan pereaksi metil nukleofilik. Agen metilasi nukleofilik yang kuat termasuk metillitium (CH3Li)[15] atau pereaksi Grignard seperti metilmagnesium bromida (CH3MgX).[16] Misalnya, CH3Li akan menambahkan gugus metil pada karbonil (C=O) keton dan aldehida:
Agen metilasi yang lebih ringan termasuk tetrametiltimah, dimetilseng, dan trimetilaluminium.[17]
Lihat pula[sunting | sunting sumber]
Topik biologi[sunting | sunting sumber]
- Pengurutan bisulfit – metode biokimia yang digunakan untuk menentukan ada atau tidaknya gugus metil pada urutan DNA
- MethDB Basis Data Metilasi DNA
- Termoforesis skala mikro – metode biofisika untuk menentukan keadaan metilasi DNA[18]
Topik kimia organik[sunting | sunting sumber]
- Alkilasi
- Metoksi
- Metilenasi Titanium-Seng
- Pereaksi Petasis
- Pereaksi Nysted
- Reaksi Wittig
- Pereaksi Tebbe
Referensi[sunting | sunting sumber]
- ^ Thauer, R. K. (1998). "Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson". Microbiology (dalam bahasa Inggris). 144: 2377–2406.
- ^ Matthews, R. G.; Smith, A. E.; Zhou, Z. S.; Taurog, R. E.; Bandarian, V.; Evans, J. C.; Ludwig, M. (2003). "Cobalamin-Dependent and Cobalamin-Independent Methionine Synthases: Are There Two Solutions to the Same Chemical Problem?". Helvetica Chimica Acta (dalam bahasa Inggris). 86 (12): 3939–3954. doi:10.1002/hlca.200390329.
- ^ Styblo, M.; Del Razo, L. M.; Vega, L.; Germolec, D. R.; LeCluyse, E. L.; Hamilton, G. A.; Reed, W.; Wang, C.; Cullen, W. R.; Thomas, D. J. (2000). "Comparative toxicity of trivalent and pentavalent inorganic and methylated arsenicals in rat and human cells". Archives of Toxicology (dalam bahasa Inggris). 74 (6): 289–299. doi:10.1007/s002040000134.
- ^ March, Jerry; Smith, Michael W (2001). March's advanced organic chemistry: reactions, mechanisms, and structure (dalam bahasa Inggris). New York: Wiley. ISBN 0-471-58589-0.
- ^ Vyas, G. N.; Shah, N. M. (1951). "Quninacetophenone monomethyl ether". Organic Syntheses (dalam bahasa Inggris). 31: 90. doi:10.15227/orgsyn.031.0090.
- ^ Hiers, G. S. (1929). "Anisole". Organic Syntheses (dalam bahasa Inggris). 9: 12. doi:10.15227/orgsyn.009.0012.
- ^ Icke, Roland N.; Redemann, Ernst; Wisegarver, Burnett B.; Alles, Gordon A. (1949). "m-Methoxybenzaldehyde". Organic Syntheses (dalam bahasa Inggris). 29: 63. doi:10.15227/orgsyn.029.0063.
- ^ Tundo, Pietro; Selva, Maurizio; Bomben, Andrea (1999). "Mono-C-methylathion of arylacetonitriles and methyl arylacetates by dimethyl carbonate: a general method for the synthesis of pure 2-arylpropionic acids. 2-Phenylpropionic acid". Organic Syntheses (dalam bahasa Inggris). 76: 169. doi:10.15227/orgsyn.076.0169.
- ^ Nenad, Maraš; Polanc, Slovenko; Kočevar, Marijan (2008). "Microwave-assisted methylation of phenols with tetramethylammonium chloride in the presence of K2CO3 or Cs2CO3". Tetrahedron (dalam bahasa Inggris). 64 (51): 11618–11624. doi:10.1016/j.tet.2008.10.024.
- ^ Poon, Kevin W. C.; Albiniak, Philip A.; Dudley, Gregory B. (2007). "Protection of alcohols using 2-benzyloxy-1-methylpyridinium trifluoromethanesulfanonate: Methyl (R)-(-)-3-benzyloxy-2-methyl propanoate". Organic Syntheses (dalam bahasa Inggris). 84: 295. doi:10.15227/orgsyn.084.0295.
- ^ Neeman, M.; Johnson, William S. (1961). "Cholestanyl methyl ether". Organic Syntheses (dalam bahasa Inggris). 41: 9. doi:10.15227/orgsyn.041.0009.
- ^ Purdie, T.; Irvine, J. C. (1903). "C.?The alkylation of sugars". Journal of the Chemical Society, Transactions (dalam bahasa Inggris). 83: 1021. doi:10.1039/CT9038301021.
- ^ Icke, Roland N.; Wisegarver, Burnett B.; Alles, Gordon A. (1945). "β-Phenylethyldimethylamine". Organic Syntheses (dalam bahasa Inggris). 25: 89. doi:10.15227/orgsyn.025.0089.
- ^ Shioiri, Takayuki; Aoyama, Toyohiko; Snowden, Timothy (2001). "Trimethylsilyldiazomethane". e-EROS Encyclopedia of Reagents for Organic Synthesis (dalam bahasa Inggris). doi:10.1002/047084289X.rt298.pub2.
- ^ Lipsky, Sharon D.; Hall, Stan S. (1976). "Aromatic Hydrocarbons from aromatic ketones and aldehydes: 1,1-Diphenylethane". Organic Syntheses (dalam bahasa Inggris). 55: 7. doi:10.15227/orgsyn.055.0007.
- ^ Grummitt, Oliver; Becker, Ernest I. (1950). "trans-1-Phenyl-1,3-butadiene". Organic Syntheses (dalam bahasa Inggris). 30: 75. doi:10.15227/orgsyn.030.0075.
- ^ Negishi, Ei-ichi; Matsushita, Hajime (1984). "Palladium-Catalyzed Synthesis of 1,4-Dienes by Allylation of Alkenyalane: α-Farnesene". Organic Syntheses (dalam bahasa Inggris). 62: 31. doi:10.15227/orgsyn.062.0031.
- ^ Wienken CJ, Baaske P, Duhr S, Braun D (2011). "Thermophoretic melting curves quantify the conformation and stability of RNA and DNA". Nucleic Acids Research (dalam bahasa Inggris). 39 (8): e52–e52. doi:10.1093/nar/gkr035. PMC 3082908
 . PMID 21297115.
. PMID 21297115.
Pranala luar[sunting | sunting sumber]
- (Inggris) deltaMasses Diarsipkan 2016-04-18 di Wayback Machine. Deteksi Metilasi setelah Spektrometri Massa