Pelipatan protein

Pelipatan protein adalah proses fisik yang menyebabkan rantai protein mendapatkan struktur tiga dimensinya. Pada proses ini, kumparan acak polipetida melipat dengan karakteristik tertentu sehingga membentuk struktur protein yang unik untuk setiap jenis kombinasi rantai protein.[1]
Pada awalnya, setiap protein hanyalah berupa rantai polipeptida atau kumparan acak (lihat bagian kiri pada gambar pertama) yang merupakan hasil translasi dari sekuens RNA duta. Kumparan acak ini merupakan rantai linear dari asam amino. Rantai ini tidak memiliki struktur yang stabil. Seiring dengan pembentukan rantai polipeptida disistensis oleh ribosom, rantai linear protein mulai melipat membentuk struktur tiga dimensinya. Hal ini dikarenakan asam amino yang sudah terbentuk mulai saling berinteraksi membentuk ikatan sehingga terbentuk struktur protein yang baru, berbentuk tiga dimensi (lihat bagian kanan pada gambar kedua), yang disebut sebagai kondisi alami (native state). Bentuk tiga dimensinya tergantung pada susunan asam amino penyusunnya atau disebut juga struktur primer (Dogma Anfinsen).[2]

Pelipatan protein menjadi struktur tiga dimensinya dalam bentuk yang benar sangatlah penting bagi protein tersebut agar dapat berfungsi walaupun masih ada beberapa bagian protein tersebut yang tidak melipat. Kegagalan suatu protein untuk melipat kedalam kondisi alaminya biasanya menyebabkan protein tersebut menjadi inaktif. Namun, pada beberapa keadaan, kegagalan ini dapat menyebabkan penyakit neurodegeneratif seperti alzheimer atau penyakit lain yang dipercaya disebabkan oleh akumulasi fibril amiloid yang terbentuk akibat protein yang salah melipat.[3] Selain itu, banyak alergi juga disebabkan oleh salahnya beberapa protein dalam melipat dirinya sehingga sistem imun gagal memproduksi antibodi.[4]
Lamanya proses pelipatan tergantung dari proteinnya tersebut. Ketika diamati secara in vitro, pelipatan protein membutuhkan waktu dari beberapa menit hingga beberapa jam karena adanya isomerisasi prolina, sehingga membuat protein tersebut perlu melewati beberapa kondisi intermediat,[5] seperti layaknya checkpoint, sebelum akhirnya proses pelipatan tersebut selesai. Di lain hal, protein domain tunggal yang sangat kecil, dengan panjang maksimal seratus asam amino, dapat melipat hanya dalam satu langkah tanpa adanya kondisi intermediat. Secara umum, biasanya proses pelipatan protein membutuhkan waktu milidetik bahkan hingga beberapa mikrodetik.[6]
Proses Pelipatan Protein[sunting | sunting sumber]
Tahap I : Struktur primer[sunting | sunting sumber]
Struktur primer dari protein hanyalah merupakan susuan dari asam amino penyusun proten tersebut. Struktur primer ini tidak lebih merupakan hasil langsung dari translasi ribosom. Struktur ini nantinya akan menentukan konformasi dari seperti apa struktur tiga dimensinya nanti.[7] Residu spesifik dari asam amino dan posisinya pada rantai polipeptida akan menentukan bagian mana dari protein yang akan mendekat dan melipat sehingga membentuk struktur tiga dimensinya. Sehingga dapat dibilang bahwa susunan asam amino dari setiap protein mengandung informasi yang menentukan bagaimana protein tersebut melipat menuju struktur alaimnya dan cara melipatnya. Namun, protein dengan susunan asam amino yang mirip belum tentu akan melipat dengan cara yang sama.[7] Konformasi tergantung pula pada kondisi lingkungannya.
Tahap II : Struktur Sekunder[sunting | sunting sumber]

Pembentukan struktur sekunder protein merupakan langkah pertama dalam proses melipatnya protein. Struktur sekunder ini ada yang bebentuk heliks-alfa dan ada yang berbentuk lembaran beta. Struktur ini melipat sangat cepat karena mereka terbentuk dari ikatan hidrogen. Pembentukan ikatan hidrogen sangatlah penting untuk kestabilan protein.[8] Struktur dari heliks alfa terbentuk dengan ikatan hidrogen pada bagian belakang yang pada akhirnya membentuk struktur spiral (lihat gambar kanan). Struktur lembaran beta terbentuk karena asam amino penyusunnya membentuk ikatan hidrogen dengan cara melipat ke arah dirinya sendiri. Ikatan hidrogen terjadi antara hidrogen pada amida dan oksigen pada karbonil protein.
Struktur lembaran beta terbagi menjadi dua, yaitu lembaran beta anti-paralel dan lembaran beta paralel. Ikatan hidrogen pada lembaran beta anti paralel lebih kuat dibanding ikatan hidrogen yang terbentuk pada lembaran beta paralel karena ikatan tersebut terbentuk pada sudut 180 derajat yang ideal. Pada lembaran beta paralel, semua untai pada lembaran tersebut memiliki arah yang sama, sedangkan pada anti-paralel, untai tersebut memiliki arah yang berbeda-beda.[7]
Tahap III : Struktur tersier[sunting | sunting sumber]

Heliks-alfa dan lembaran beta merupakan struktur yang memiliki sifat amfipatik, yaitu memiliki bagian hidrofilik dan hidrofobik. Sifat ini memungkinkan protein untuk melipat karena bagian hidrofobiknya akan masuk ke dalam inti protein dan bagian hidrofiliknya-lah yang akan berinteraksi dengan lingkungan sekitar sehingga akan melipat keluar.[9] Struktur seperti inilah yang akan membentuk struktur tersier. Bentuk dari struktur sekunder-lah yang akan menentukan bagaimana struktur tersier ini terbentuk.

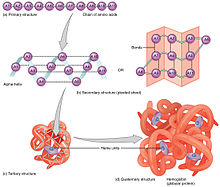
Setelah struktur tersier ini terbentuk dan interaksi hidrofobiknya sudah menstabilkan bentuk protein ini. Interaksi lain mungkin akan muncuk, seperti ikatan kovalen dalam bentuk jembatan disfulda di antara dua residu sistein. Struktur tersier dari protein masih hanya terdiri dari satu rantai polipeptida; Namun, interaksi antar-rantai polipeptida akan membentuk struktur kuartener
Tahap IV : Struktur Kuartener[sunting | sunting sumber]
Struktur tersier akan memungkinkan terbentuknya struktur kuartener pada beberapa protein. Pelipatan terakhir ini menggabungkan beberapa struktur tersier yang sudah terbentuk. Dengan kata lain, struktur kuartener merupakan interaksi antar rantai polipeptida untuk membentuk satu kesatuan protein dengan struktur kuarteener yang berfungsi.[7]
Faktor yang Terlibat dalam Proses Pelipatan Protein[sunting | sunting sumber]
Pelipatan protein merupakan reaksi spontan yang didorong oleh interaksi hidrofobik, ikatan hidrogen, gaya van der Waals, dan dihambat oleh entropi konformasi.[10] Pelipatan protein sering dimulai secara ko-translasi, dimana ujung-N akan melipat lebih dulu ketika ujung-C nya masih disintesis oleh ribosom. Namun, molekul protein mungkin melipat secara spontan ketika atau setelah proses biosintesis. Walaupun proses pelipatan ini bisa dibilang "melipat dengan sendirinya", proses ini tetap hanya dapat berlangsung jika faktor-faktor ini terdapat dengan tepat sesuai dengan protein yang akan dibentuknya, yaitu pelarut (air maupun lipid bilayer), konsentrasi garam, pH, temperatur, dan kaperon (masih memerlukan penelitian).[11] Pelipatan protein juga dibatasi oleh sudut lipatannya dan konformasi yang memungkinkan. Sudut lipatan yang mungkin dapat diprediksi oleh plot dua dimensi yang disebut sebagai Plot Ramachandran.[12]
Pelipatan protein harus memungkinkan secara termodinamika agar proses ini berlangsung secara spontan. Karena sudah diketahui proses ini berjalan secara spiontan, maka kita bisa mengasumsikan bahwa proses ini memiliki energi bebas Gibbs yang negatif. Energi bebas Gibbs dalam pelipatan protein berhubungan dengan entalpi dan entropi. Agar nilai ernergi bebas ini bisa negatif, maka entalpi atau entropi atau keduanya harus sesuai.
Efek Hidrofobik[sunting | sunting sumber]
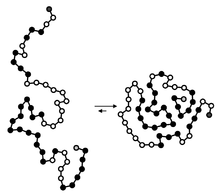
Meminimilasir rantai samping hidrofobik yang berinteraksi dengan air merupakan kunci dari efek hidrofobik.[13] Efek hidrofobik merupakan fenomena dimana rantai dari protein melipat kedalam bagian inti protein (menjauhi lingkungan berair). Pada lingkungan beriari, molekul air cenderung berkumpul disekitar area yang hidrofobik, sehingga menurunkan entropi. Ketika bagian hidrofobik protein mulai melipat kedalam, air yang sebelumnya berkumpul akan menyebar kemabli sehingga meningkatkan entropi. Banyaknya rantai samping hidrofobik yang masuk ke dalam intin akan berkontribusi secara signifikan terhadap kestabilan protein karena gaya van der Waals yang akan terbentuk
Efek hidrofobik ini hanya akan terbentuk dalam lingkungan yang berair dengan adanya molekul amfipatik yang memiliki gugus hidrofobik yang banyak. Pada protein dengan pola pelipatan globular, asam amino yang hidrofobik cenderung tersusun secara berselang-seling, alih-alih terdistribusi acak atau berkelompok. Namun, protein yang dibuat secara de novo cenderung terdistribusi acak.[14]
Kaperon[sunting | sunting sumber]
Kaperon merupakan enzim yang krusial dalam proses pelipatan protein. Kaperon ada dalam setiap kompartemen sel dan berinteraksi dengan rantai polipeptida untuk mengkatalisis proses pembentukan struktur konformasi tiga dimensi dari protein. Namun, kaperon tidak termasuk ke dalam penyusun struktur protein itu sendiri. Kaperon mungkin membantu pelipatan ketika protein masih disintesis oleh ribosom. Kaperon berfungsi dengan cara berikatan dengan protein untuk menstabilisasi struktur yang tidak stabil dalam protein ketika masih dalam proses melipat. Hal ini memungkinkan energi aktivasi yang dibutuhkan untuk pelipatan tersebut turun dan memungkinkan pula pelipatan tersebut melipat dengan benar.[6] Dengan cara ini, kaperon tidak meningkatkan laju proses pelipatan, melainkan dengan mereduksi agregasi yang tidak diinginkan dari proses pelipatan polipeptida yang mungkin akan menghambat proses pencarian struktur alami dari protein tersebut. Dengan kata lain, kaperon mengefisiensikan proses pelipatan protein.[15]
Pelipatan Protein yang Salah dan Penyakit yang Diakibatkannya[sunting | sunting sumber]
Protein dianggap salah melipat ketika protein tersebut gagal mencapai kondisi alaminya. Kondisi ini dapat disebabkan adanya mutasi pada sekuens asam amino ataupun gangguan ketika porses pelipatan karena adanya faktor ekstenal.[16] Protein yang salah melipat biasanya mengandung lembaran beta yang tersusun secara supramolekuler yang dikenal sebagai struktur lintas-beta. Lembaran beta seperti ini biasanya sangat stabil, tidak larut dalam air, dan biasanya resisten terhadap proses proteolisis. Stabilistas seperti ini biasanya disebabkan oleh interaksi yang ekstensif di antara monomer protein yang terbentuk oleh ikatan hidrogen di antara lembaran beta tersebut.
Salahnya pelipatan protein dapat meneybabkan protein lain pun ikut salah melipat sehingga menyebabkan adanya akumulasi protein menjadi agregat atau oligomer. Peningkatan agregat protein ini menyebabkan terbentuknya struktur seperti amiloid yang dapat menyebabkan kelainan degernatif dan kematian sel. Amiloid merupakan struktur fibrilin yang memiliki ikatan hidrogen yang sangat tidak laur dalam air dan terbuat dari agregat protein. Oleh karenanya, jalur enzimatik yang biasanya dapat mencerna protein mungkin tidak akan cukup kuat untuk dapat mengurai jenis protein speerti ini. Oleh karenanya, agregat protein ini sulit dihilangkan. Protein yang gagal mellipat juga dapat berinteraksi dengan struktur lain dan menyebabkan struktur tersebut menjadi toksik akibat adanya interaksi intramolekuler lainnya.
Protein yang teragregasi sering diasosiasikan dengan penyakit yang berhubungan dengan prion seperti kelainan Creutzfeldt-Jakob, penyakit sapi gila, alzheimer, kardiomiopati atau polyneuropathy,[17] bahkan juga menyebabkan penyakit Huntington dan Parkinson.[18] Penyakit-penyakit yang biasanya muncul diusia tua ini berkorelasi dengan peningkatan protein-protein yang gagal melipat hingga membentuk agregat protein yang tidak larut. Masih belum jelas apakah agregat seperti ini disebabkan oleh berkurangnya reabilitas homeostasis tubuh, yaitu kemampuan tubuh untuk menjaga keseimbangan antara sintesis, pelipatan, dan pencernaan protein. Baru akhir-akhir ini, Agensi Kesehatan Eropa mengizinkan penggunakan Tafamidis datau Vyndaqel sebagai obat untuk penyakit amyloid. Hal ini berarti bisa saja pembentukan amiloid menyebabkan degenerasi jaringan tubuh pada penyakit amiloid.[19]
Walau terapi penggantian protein sudah sering digunakan untuk memperbaiki kelainan ini, pendekatan yang sekarang sedang dikembangkan adalah penggunakan kaperon untuk memperbaiki protein yang bermutasi sehingga dapat membuat mereka kembali fungsional.
Teknik Untuk Mengamati Pelipatan Protein[sunting | sunting sumber]
Walaupun pelipatan protein dapat dipelajari lewat mutasi yang terjadi, secara umum, teknik eksperimental digunakan pula untuk mengamati protein. Teknik eksperimental ini biasanya mengamati proses pelipatan maupun proses pembukaan lipatan protein secara bertahap dengan mengamati perubahan konformasi dengan menggunakan teknik kristalografi.

Kristalografi X-Ray[sunting | sunting sumber]
Kristalografi X-Ray merupakan salah satu metode yang efisien dan penting dalam pendekatan untuk mengamati tahapan proses pelipatan protein.[20] Untuk dapat melakukan kristalografi X-Ray, protein yang akan diamati harus disimpan dalam lapisan kritsal Caranya adalah dengan melarutkan protein murni yang sangat pekat dalam suatu larutan yang dapat mengkrtisal. Setelah protein ini mengkristal, sinarx-ray dapat difokuskan ke dalam kritsal yang akan mendifraksi sinar tersebut. sinar yang menembus kristal ini akan diamati dan dikorelasi dengan konfigurasi tiga dimensi yang sudah diketahui sebelumnya. Hal inii dilakukan dengan mengamati pola kepadatan elektron dari sinar x-ray yang tembus dan peneliti kemudian akan mengasumsikan fase mauapun sudut faase yang terlibat. Korelasi ini dibuat dengan dasar matematis yang disebut transformasi Fourier
Membuat Model Pelipatan Protein[sunting | sunting sumber]
Ilmuwan mengandalkan model untuk memperkirakan struktur asli protein. Dinamika molekuler merupakan cabang ilmu yang mempelajari dinamika pelipatan protein. Simulasi komputer untuk menentukan kesetimbangan pertama dilakukan dengan menggunakan teknik ab initio. Namun, proses ini terhambat oleh biaya sehingga protein yang dibuat modelnya biasanya terbatas pada peptida atau protein yang sangat kecil[21]
Daftar Pustaka[sunting | sunting sumber]
- ^ Alberts, Bruce, (2002). Molecular biology of the cell. Johnson, Alexander,, Lewis, Julian,, Raff, Martin,, Roberts, Keith,, Walter, Peter, (edisi ke-4th ed). New York: Garland Science. ISBN 0-8153-3218-1. OCLC 48122761.
- ^ Anfinsen, C. B. (1972-07-01). "The formation and stabilization of protein structure". Biochemical Journal (dalam bahasa Inggris). 128 (4): 737–749. doi:10.1042/bj1280737. ISSN 0006-2936. PMC 1173893
 . PMID 4565129.
. PMID 4565129.
- ^ Selkoe, Dennis J. (2003-12). "Folding proteins in fatal ways". Nature (dalam bahasa Inggris). 426 (6968): 900–904. doi:10.1038/nature02264. ISSN 1476-4687.
- ^ Alberts, Bruce. Essential cell biology (edisi ke-Fourth edition). New York, NY. hlm. 509. ISBN 978-0-8153-4454-4. OCLC 852218989.
- ^ Kim, Peter S.; Baldwin, Robert L. (1990-06-01). "Intermediates in the folding reactions of small proteins". Annual Review of Biochemistry. 59 (1): 631–660. doi:10.1146/annurev.bi.59.070190.003215. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2020-05-28. Diakses tanggal 2020-11-15.
- ^ a b Kubelka, Jan; Hofrichter, James; Eaton, William A (2004-02-01). "The protein folding 'speed limit'". Current Opinion in Structural Biology (dalam bahasa Inggris). 14 (1): 76–88. doi:10.1016/j.sbi.2004.01.013. ISSN 0959-440X.
- ^ a b c d Anfinsen, C. B. (1973-07-20). "Principles that Govern the Folding of Protein Chains". Science (dalam bahasa Inggris). 181 (4096): 223–230. doi:10.1126/science.181.4096.223. ISSN 0036-8075.
- ^ Rose, George D.; Fleming, Patrick J.; Banavar, Jayanth R.; Maritan, Amos (2006-11-07). "A backbone-based theory of protein folding". Proceedings of the National Academy of Sciences (dalam bahasa Inggris). 103 (45): 23–33. doi:10.1073/pnas.0606843103. ISSN 0027-8424. PMC 1636505
 . PMID 17075053.
. PMID 17075053.
- ^ Buxbaum, Engelbert (2015-11-27). Fundamentals of Protein Structure and Function (dalam bahasa Inggris). Springer. hlm. 33. ISBN 978-3-319-19920-7.
- ^ Ronner, Peter (2016-11-14). Netter's Essential Biochemistry E-Book (dalam bahasa Inggris). Elsevier Health Sciences. hlm. 84. ISBN 978-0-323-38873-3.
- ^ Zhang, Gong; Ignatova, Zoya (2011-02-01). "Folding at the birth of the nascent chain: coordinating translation with co-translational folding". Current Opinion in Structural Biology (dalam bahasa Inggris). 21 (1): 25–31. doi:10.1016/j.sbi.2010.10.008. ISSN 0959-440X.
- ^ "Torsion Angles and the Ramachnadran Plot in Protein Structures". www.proteinstructures.com. Diakses tanggal 2020-11-15.
- ^ Pace, C. Nick; Shirley, Bret A.; McNutt, Marsha; Gajiwala, Ketan (1996). "Forces contributing to the conformational stability of proteins". The FASEB Journal (dalam bahasa Inggris). 10 (1): 75–83. doi:10.1096/fasebj.10.1.8566551. ISSN 1530-6860. Diarsipkan dari versi asli tanggal 2021-05-02. Diakses tanggal 2020-11-15.
- ^ Wilson, Benjamin A.; Foy, Scott G.; Neme, Rafik; Masel, Joanna (2017-04-24). "Young genes are highly disordered as predicted by the preadaptation hypothesis of de novo gene birth". Nature Ecology & Evolution (dalam bahasa Inggris). 1 (6): 1–6. doi:10.1038/s41559-017-0146. ISSN 2397-334X. PMC 5476217
 . PMID 28642936.
. PMID 28642936.
- ^ Chaudhuri, Tapan K.; Paul, Subhankar (2006-04). "Protein-misfolding diseases and chaperone-based therapeutic approaches". FEBS Journal (dalam bahasa Inggris). 273 (7): 31–49. doi:10.1111/j.1742-4658.2006.05181.x. ISSN 1742-464X.
- ^ Dobson, Christopher M. (2003-12). "Protein folding and misfolding". Nature (dalam bahasa Inggris). 426 (6968): 84–90. doi:10.1038/nature02261. ISSN 1476-4687.
- ^ Hammarström, Per; Wiseman, R. Luke; Powers, Evan T.; Kelly, Jeffery W. (2003-01-31). "Prevention of Transthyretin Amyloid Disease by Changing Protein Misfolding Energetics". Science (dalam bahasa Inggris). 299 (5607): 713–716. doi:10.1126/science.1079589. ISSN 0036-8075. PMID 12560553.
- ^ Chiti, Fabrizio; Dobson, Christopher M. (2006-06). "Protein Misfolding, Functional Amyloid, and Human Disease". Annual Review of Biochemistry (dalam bahasa Inggris). 75 (1): 333–366. doi:10.1146/annurev.biochem.75.101304.123901. ISSN 0066-4154. Diarsipkan dari versi asli tanggal 2021-03-08. Diakses tanggal 2020-11-15.
- ^ Johnson, Steven M.; Wiseman, R. Luke; Sekijima, Yoshiki; Green, Nora S.; Adamski-Werner, Sara L.; Kelly, Jeffery W. (2005-12-01). "Native State Kinetic Stabilization as a Strategy To Ameliorate Protein Misfolding Diseases: A Focus on the Transthyretin Amyloidoses". Accounts of Chemical Research. 38 (12): 911–921. doi:10.1021/ar020073i. ISSN 0001-4842.
- ^ Alberts, Bruce (2017-08-07). Molecular Biology of the Cell (dalam bahasa Inggris). Garland Science. hlm. 323. ISBN 978-1-317-56374-7.
- ^ Schaefer, Michael; Bartels, Christian; Karplus, Martin (1998-12-04). "Solution conformations and thermodynamics of structured peptides: molecular dynamics simulation with an implicit solvation model1 1Edited by A. F. Fersht". Journal of Molecular Biology (dalam bahasa Inggris). 284 (3): 35–48. doi:10.1006/jmbi.1998.2172. ISSN 0022-2836.
