Gerak Brown: Perbedaan antara revisi
k bot Menambah: ko:브라운 운동 |
Ariandi Lie (bicara | kontrib) k Membatalkan 1 suntingan oleh Hifza rumi (bicara) ke revisi terakhir oleh 36.79.19.37(Tw) Tag: Pembatalan |
||
| (22 revisi perantara oleh 19 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
[[Berkas:Wiener process 3d.png| |
[[Berkas:Wiener process 3d.png|jmpl|Gerak Brown dalam ruang 3-D]] |
||
'''Gerak Brown''' adalah gerakan terus menerus dari suatu partikel zat [[cair]] ataupun gas, artinya partikel-partikel ini tidak pernah dalam keadaan stasioner atau sepenuhnya diam. Hal ini, pertama kali dibuktikan dan dicetuskan oleh [[Robert Brown]] seorang [[ |
'''Gerak Brown''' adalah gerakan terus menerus dari suatu partikel zat [[cair]] ataupun [[gas]], artinya partikel-partikel ini tidak pernah dalam keadaan [[stasioner]] atau sepenuhnya diam. Hal ini, pertama kali dibuktikan dan dicetuskan oleh [[Robert Brown]] seorang [[botanis]] [[Skotlandia]] pada tahun 1827. Prinsip gerak ini mudah sekali, Brown mengamati beberapa partikel dengan [[mikroskop]] dan dia menemukan bahwa pergerakan terus menerus dari partikel-partikel kecil tersebut makin lama makin cepat bila [[temperatur]]nya makin tinggi. |
||
Gerak ini dapat diamati pada zat cair [[ |
Gerak ini dapat diamati pada zat cair [[koloid]] atau gas. Di dalam suatu ruang pergerakan [[partikel]] gas tersebut ([[analogi]] terhadap zat cair juga) bergerak bebas dan tidak teratur, dengan kata lain partikel gas itu bergerak dengan kecepatan yang berbeda-beda. Bila partikel gas tersebut menabrak partikel gas lain atau menabrak tembok dinding ruang, maka kecepatan serta arah [[vektor]]nya ikut berubah. Penyebaran kecepatan ini dapat dirumuskan dengan penyebaran [[kecepatan Maxwell]] yang memberikan gambaran bahwa kecepatan partikel tergantung dari temperatur ruang dan lingkungannya. |
||
Kecepatan rata-rata pergerakan molekul di udara adalah |
Kecepatan rata-rata pergerakan [[molekul]] di [[udara]] adalah 500 m/s atau 1800 km/h. Kecepatan ini melebihi kecepatan [[gelombang suara]] yang besarnya 330 m/s. [[Energi]] dari partikel gas ideal juga tergantung dari [[suhu]] udara. |
||
Teori gas kinetik memberikan hubungan proporsional antara energi rata2 kinetik dengan temperatur gas: |
Teori gas [[kinetik]] memberikan hubungan proporsional antara energi rata2 kinetik dengan temperatur gas: |
||
:<math>E_k = \frac{1}{2} \cdot m \cdot v_m^2= \frac{3}{2} \cdot k \cdot T</math> |
:<math>E_k = \frac{1}{2} \cdot m \cdot v_m^2= \frac{3}{2} \cdot k \cdot T</math> |
||
hh |
|||
| ⚫ | |||
[[Kategori:Fraktal]] |
[[Kategori:Fraktal]] |
||
[[Kategori:Mekanika |
[[Kategori:Mekanika statistik]] |
||
[[Kategori: |
[[Kategori:Kyontol]] |
||
[[ar:حركة براونية]] |
|||
| ⚫ | |||
[[bg:Брауново движение]] |
|||
[[ca:Moviment brownià]] |
|||
[[cs:Brownův pohyb]] |
|||
[[da:Brownske bevægelser]] |
|||
[[de:Brownsche Bewegung]] |
|||
[[el:Κίνηση Μπράουν]] |
|||
[[en:Brownian motion]] |
|||
[[es:Movimiento browniano]] |
|||
[[et:Browni liikumine]] |
|||
[[eu:Mugimendu Browndarra]] |
|||
[[fi:Brownin liike]] |
|||
[[fr:Mouvement brownien]] |
|||
[[he:תנועה בראונית]] |
|||
[[hr:Brownovo gibanje]] |
|||
[[hu:Brown-mozgás]] |
|||
[[it:Moto browniano]] |
|||
[[ja:ブラウン運動]] |
|||
[[ko:브라운 운동]] |
|||
[[lt:Brauno judėjimas]] |
|||
[[lv:Brauna kustība]] |
|||
[[ms:Pergerakan Brown]] |
|||
[[mt:Moviment Brownjan]] |
|||
[[nl:Brownse beweging]] |
|||
[[nn:Brownsk rørsle]] |
|||
[[no:Brownsk bevegelse]] |
|||
[[pl:Ruchy Browna]] |
|||
[[pt:Movimento browniano]] |
|||
[[ro:Agitaţie termică]] |
|||
[[ru:Броуновское движение]] |
|||
[[sh:Braunovo kretanje]] |
|||
[[sk:Brownov pohyb]] |
|||
[[sl:Brownovo gibanje]] |
|||
[[sr:Брауново кретање]] |
|||
[[su:Gerak Brown]] |
|||
[[sv:Brownsk rörelse]] |
|||
[[ta:பிரௌனியன் இயக்கம்]] |
|||
[[tr:Brown hareketi]] |
|||
[[uk:Броунівський рух]] |
|||
[[vi:Chuyển động Brown]] |
|||
[[zh:布朗运动]] |
|||
Revisi per 13 Desember 2023 11.36
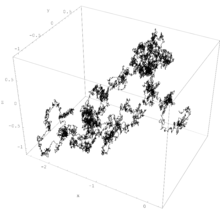
Gerak Brown adalah gerakan terus menerus dari suatu partikel zat cair ataupun gas, artinya partikel-partikel ini tidak pernah dalam keadaan stasioner atau sepenuhnya diam. Hal ini, pertama kali dibuktikan dan dicetuskan oleh Robert Brown seorang botanis Skotlandia pada tahun 1827. Prinsip gerak ini mudah sekali, Brown mengamati beberapa partikel dengan mikroskop dan dia menemukan bahwa pergerakan terus menerus dari partikel-partikel kecil tersebut makin lama makin cepat bila temperaturnya makin tinggi.
Gerak ini dapat diamati pada zat cair koloid atau gas. Di dalam suatu ruang pergerakan partikel gas tersebut (analogi terhadap zat cair juga) bergerak bebas dan tidak teratur, dengan kata lain partikel gas itu bergerak dengan kecepatan yang berbeda-beda. Bila partikel gas tersebut menabrak partikel gas lain atau menabrak tembok dinding ruang, maka kecepatan serta arah vektornya ikut berubah. Penyebaran kecepatan ini dapat dirumuskan dengan penyebaran kecepatan Maxwell yang memberikan gambaran bahwa kecepatan partikel tergantung dari temperatur ruang dan lingkungannya.
Kecepatan rata-rata pergerakan molekul di udara adalah 500 m/s atau 1800 km/h. Kecepatan ini melebihi kecepatan gelombang suara yang besarnya 330 m/s. Energi dari partikel gas ideal juga tergantung dari suhu udara.
Teori gas kinetik memberikan hubungan proporsional antara energi rata2 kinetik dengan temperatur gas:
hh

