Kadmium sulfat: Perbedaan antara revisi
←Membuat halaman berisi '{{chembox | Verifiedfields = changed | Watchedfields = changed | verifiedrevid = 476999882 | Name = Kadmium sulfat | ImageFile = CdSO4(H2O).jpg | ImageName = Kadmium s...' |
k Bot: Perubahan kosmetika |
||
| Baris 48: | Baris 48: | ||
| Odor = Tidak berbau |
| Odor = Tidak berbau |
||
| Density = 4.691 g/cm<sup>3</sup> (anhidrat) <br> 3.79 g/cm<sup>3</sup> (monohidrat) <br> 3.08 g/cm<sup>3</sup> (oktahidrat)<ref>{{RubberBible87th}}</ref> |
| Density = 4.691 g/cm<sup>3</sup> (anhidrat) <br> 3.79 g/cm<sup>3</sup> (monohidrat) <br> 3.08 g/cm<sup>3</sup> (oktahidrat)<ref>{{RubberBible87th}}</ref> |
||
| Solubility = ''anhidrat:'' <br> 75 g/100 mL (0 |
| Solubility = ''anhidrat:'' <br> 75 g/100 mL (0 °C) <br> 76.4 g/100 mL (25 °C) <br> 58.4 g/100 mL (99 °C) <hr> ''monohidrat:'' <br> 76.7 g/100 mL (25 °C) <hr> ''oktahidrat:'' <br> sangat mudah larut |
||
| SolubleOther = Agak dapat larut dalam [[metanol]], [[etil asetat]] <br> tidak dapat larut dalam [[etanol]] |
| SolubleOther = Agak dapat larut dalam [[metanol]], [[etil asetat]] <br> tidak dapat larut dalam [[etanol]] |
||
| MeltingPtC = 1000 |
| MeltingPtC = 1000 |
||
| MeltingPt_notes = (anhidrat) <br> 105 |
| MeltingPt_notes = (anhidrat) <br> 105 °C (monohidrat) <br> 40 °C (oktahidrat) |
||
| BoilingPt = (berdekomposisi menjadi sulfat basa dan kemudian menjadi oksida) |
| BoilingPt = (berdekomposisi menjadi sulfat basa dan kemudian menjadi oksida) |
||
| pKa = |
| pKa = |
||
| Baris 106: | Baris 106: | ||
{{kimia-stub}} |
{{kimia-stub}} |
||
[[Kategori:Senyawa kadmium]] |
[[Kategori:Senyawa kadmium]] |
||
[[Kategori:Sulfat]] |
[[Kategori:Sulfat]] |
||
Revisi per 5 November 2018 05.51
| |
| Nama | |
|---|---|
| Nama IUPAC
Kadmium(II) sulfat
| |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI |
|
| ChemSpider | |
| Nomor EC | |
| Referensi Gmelin | 8295 |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 2570 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| CdSO4 CdSO4·H2O (monohidrat) 3CdSO4·8H2O (oktahidrat) | |
| Massa molar | 208.47 g/mol (anhydrous) 226.490 g/mol (monohidrat) 769.546 g/mol (oktahidrat) |
| Penampilan | Padat higroskopik putih |
| Bau | Tidak berbau |
| Densitas | 4.691 g/cm3 (anhidrat) 3.79 g/cm3 (monohidrat) 3.08 g/cm3 (oktahidrat)[1] |
| Titik lebur | 1.000 °C (1.830 °F; 1.270 K) (anhidrat) 105 °C (monohidrat) 40 °C (oktahidrat) |
| Titik didih | (berdekomposisi menjadi sulfat basa dan kemudian menjadi oksida) |
| anhidrat: 75 g/100 mL (0 °C) 76.4 g/100 mL (25 °C) 58.4 g/100 mL (99 °C) monohidrat: 76.7 g/100 mL (25 °C) oktahidrat: sangat mudah larut | |
| Kelarutan | Agak dapat larut dalam metanol, etil asetat tidak dapat larut dalam etanol |
| -59.2·10−6 cm3/mol | |
| Indeks bias (nD) | 1.565 |
| Struktur | |
| ortorombik (anhidrat) monoklinik (hepta & oktahidrat) | |
| Termokimia | |
| Entropi molar standar (S |
123 J·mol−1·K−1[2] |
| Entalpi pembentukan standar (ΔfH |
−935 kJ·mol−1[2] |
| Bahaya | |
| Lembar data keselamatan | [1] |
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H301, H330, H340, H350, H360, H372, H400, H410 | |
| P201, P202, P260, P264, P270, P271, P273, P281, P284, P301+310, P304+340, P308+313, P310, P314, P320, P321, P330, P391, P403+233, P405, P501 | |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
280 mg/kg (lewat mulut, tikus) |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
[1910.1027] TWA 0.005 mg/m3 (sebagai Cd)[3] |
REL (yang direkomendasikan)
|
Ca[3] |
IDLH (langsung berbahaya)
|
Ca [9 mg/m3 (as Cd)][3] |
| Senyawa terkait | |
Anion lain
|
Kadmium asetat, Kadmium klorida, Kadmium nitrat |
Kation lainnya
|
Seng sulfat, Kalsium sulfat, Magnesium sulfat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kadmium sulfat adalah nama sejumlah senyawa anorganik yang saling terkait dengan rumus kimia CdSO4·xH2O. Bentuk yang paling umum ditemui adalah CdSO4·H2O, sementara dua jenis lai nyang telah ditemukan adalah CdSO4·8⁄3H2O and the dan garam anhidrat CdSO4. Semua garam kadmium sulfat tidak berwarna dan sangat mudah larut dalam air.
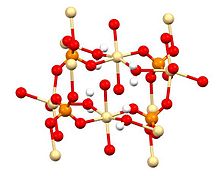
Struktur
Kristalografi sinar X menunjukkan bahwa CdSO4·H2O adalah polimer koordinasi.
Pembuatan
Kadmium sulfat dapat dibuat dari reaksi logam kadmium atau kadmium oksida dengan asam sulfat encer:
- CdO + H2SO4 → CdSO4 + H2O
- Cd + H2SO4 → CdSO4 + H2
Kadmium sulfat yang berbentuk anhidrat dapat dibuat dengan menggunakan natrium persulfat:
- Cd + Na2S2O8 → CdSO4 + Na2SO4
Kadmium sulfat murni dapat ditemui dalam bentuk mineral yang sangat langka, yaitu drobesit (CdSO4·4H2O), voudourisit (monohidrat), dan lazaridisit (8/3-hidrat).
Referensi
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (edisi ke-87). Boca Raton, Florida: CRC Press. ISBN 0-8493-0487-3.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. hlm. A21. ISBN 0-618-94690-X.
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0087". National Institute for Occupational Safety and Health (NIOSH).
