Fluorena: Perbedaan antara revisi
←Membuat halaman berisi '{{chembox | Watchedfields = changed | verifiedrevid = 443822810 | Reference = <ref>''Merck Index'', 11th Edition, '''4081'''</ref> | Name = Fluorena | ImageFile_Ref = {{chemboximage|correct|??}} | ImageFile = Fluorene.svg | ImageSize = | ImageName = | ImageFile1 = Fluorene-from-xtal-3D-balls.png | ImageFile2 = Fluorene-3D-vdW.png | PIN = 9''H''-Fluorene<ref>{{cite book |author=International Union of Pure and Applied Chemistry |date=2014 |title=Nomenclat...' Tag: Suntingan visualeditor-wikitext |
Tidak ada ringkasan suntingan Tag: Suntingan visualeditor-wikitext |
||
| Baris 66: | Baris 66: | ||
Fluorena dapat dijumpai setelah [[pembakaran tak sempurna]] dari [[plastik]] seperti [[polistirena|polistirena (PS)]], [[polietilena|polietilena (PE)]] dan [[polivinil klorida|polivinil klorida (PVC)]].<ref>{{Cite journal|last=Wang|first=Zhenlei|last2=Richter|first2=Henning|last3=Howard|first3=Jack B.|last4=Jordan|first4=Jude|last5=Carlson|first5=Joel|last6=Levendis|first6=Yiannis A.|date=2004-06-01|title=Laboratory Investigation of the Products of the Incomplete Combustion of Waste Plastics and Techniques for Their Minimization|url=https://doi.org/10.1021/ie030477u|journal=Industrial & Engineering Chemistry Research|volume=43|issue=12|pages=2873–2886|doi=10.1021/ie030477u|issn=0888-5885}}</ref> |
Fluorena dapat dijumpai setelah [[pembakaran tak sempurna]] dari [[plastik]] seperti [[polistirena|polistirena (PS)]], [[polietilena|polietilena (PE)]] dan [[polivinil klorida|polivinil klorida (PVC)]].<ref>{{Cite journal|last=Wang|first=Zhenlei|last2=Richter|first2=Henning|last3=Howard|first3=Jack B.|last4=Jordan|first4=Jude|last5=Carlson|first5=Joel|last6=Levendis|first6=Yiannis A.|date=2004-06-01|title=Laboratory Investigation of the Products of the Incomplete Combustion of Waste Plastics and Techniques for Their Minimization|url=https://doi.org/10.1021/ie030477u|journal=Industrial & Engineering Chemistry Research|volume=43|issue=12|pages=2873–2886|doi=10.1021/ie030477u|issn=0888-5885}}</ref> |
||
| ⚫ | |||
===Keasaman=== |
===Keasaman=== |
||
| ⚫ | Situs C9-H pada cincin fluorena bersifat asam lemah ([[pKa|pK<sub>a</sub>]] = 22,6 dalam [[Dimetil sulfoxida|DMSO]].<ref>{{cite journal | title = Equilibrium acidities in dimethyl sulfoxide solution | author = F. G. Bordwell | journal = Acc. Chem. Res. | volume = 21 | year = 1988 | pages = 456–463 | doi = 10.1021/ar00156a004 | issue = 12}}</ref>) Deprotonasi menghasilkan anion '''fluorenil''' (C<sub>13</sub>H<sub>9</sub><sup>−</sup>) yang stabil, bersifat [[aromatisitas|aromatik]], dan memiliki warna jingga yang kuat. Anion ini bersifat [[nukleofil]]. [[Elektrofil]] bereaksi dengan fluorenil melalui adisi pada posisi 9. Pemurnian fluorena dilakukan dengan memanfaatkan keasamannya dan/atau memanfaatkan rendahnya kelarutan derivat natriumnya dalam pelarut hidrokarbon. |
||
| ⚫ | Kedua protonnya dapat disingkirkan dari C9. Sebagai contoh, 9,9-fluorenildikalium dapat diperoleh dari fluorena yang diberi perlakuan dengan logam [[kalium]] dalam [[dioksan]] mendidih.<ref name=scherf>{{cite journal|author1=G. W. Scherf|author2=R. K. Brown|year=1960|title=Potassium Derivatives of Fluorene as Intermediates in the Preparation of C9-substituted Fluorenes. I. The Preparation of 9-fluorenyl Potassium and the Infrared Spectra of Fluorene and Some C9-substituted Fluorenes|journal=Canadian Journal of Chemistry|volume=38|page=697|doi=10.1139/v60-100}}.</ref> |
||
===Sifat-sifat ligan=== |
|||
| ⚫ | |||
Fluorena dan turunannya dapat mengalami deprotonasi menghasilkan [[ligan]] yang serupa dengan [[siklopentadienida]]. |
|||
| ⚫ | [[File:Syndiotactic-zirconocene-front-3D-balls.png|thumb|left|A fluorenyl-derived [[Kaminsky catalyst|Kaminsky precatalyst]] for producing [[syndiotactic]] [[polypropylene]].<ref>{{cite journal|author1=Ewen, J. A.|author2=Jones, R. L.|author3=Razavi, A.|author4=Ferrara, J. D.|title=Syndiospecific Propylene Polymerizations with Group IVB Metallocenes|journal=Journal of the American Chemical Society|year=1988|volume=110|issue=18|pages=6255–6256|doi=10.1021/ja00226a056|pmid=22148816}}</ref>]] |
||
==Penggunaan== |
|||
| ⚫ | |||
Fluorena adalah prekursor untuk senyawa-senyawa fluorena lainnya; spesies induk yang memiliki beberapa aplikasi. Fluorena-9-asam karboksilat adalah prekursor untuk obat-obatan. Oksidasi fluorena menghasilkan [[fluorenon]], yang jika dinitrasi menghasilkan turunan yang bermanfaat secara komersial. [[9-Fluorenilmetil kloroformat]] (Fmoc klorida) digunakan untuk memasukkan [[gugus pelindung]] 9-fluorenilmetil karbamat (Fmoc) ke dalam amina pada [[sintesis peptida]].<ref name=Ullmanns/> |
|||
| ⚫ | |||
===Ligand properties=== |
|||
Polimer [[polifluorena]] (di mana karbon 7 dari satu unit berikatan dengan karbon 2 pada unit sebelahnya, membebaskan dua hidrogen), |
|||
Fluorene and its derivatives can be deprotonated to give [[ligand]]s akin to [[cyclopentadienide]]. |
|||
| ⚫ | [[File:Syndiotactic-zirconocene-front-3D-balls.png|thumb|left|A fluorenyl-derived [[Kaminsky catalyst|Kaminsky precatalyst]] for producing [[syndiotactic]] [[polypropylene]].<ref>{{cite journal|author1=Ewen, J. A.|author2=Jones, R. L.|author3=Razavi, A.|author4=Ferrara, J. D.|title=Syndiospecific Propylene Polymerizations with Group IVB Metallocenes|journal=Journal of the American Chemical Society|year=1988|volume=110|issue=18|pages=6255–6256|doi=10.1021/ja00226a056|pmid=22148816}}</ref>]] |
||
==Uses== |
|||
Fluorene is a precursor to other fluorene compounds; the parent species has few applications. Fluorene-9-carboxylic acid is a precursor to pharmaceuticals. Oxidation of fluorene gives [[fluorenone]], which is nitrated to give commercially useful derivatives. [[9-Fluorenylmethyl chloroformate]] (Fmoc chloride) is used to introduce the 9-fluorenylmethyl carbamate (Fmoc) [[protecting group]] on amines in [[peptide synthesis]].<ref name=Ullmanns/> |
|||
[[Polyfluorene]] polymers (where carbon 7 of one unit is linked to carbon 2 of the next one, displacing two hydrogens) are [[electric conductivity|electrically conductive]] and [[electroluminescence|electroluminescent]], and have been much investigated as a [[luminophore]] in [[organic light-emitting diode]]s. |
[[Polyfluorene]] polymers (where carbon 7 of one unit is linked to carbon 2 of the next one, displacing two hydrogens) are [[electric conductivity|electrically conductive]] and [[electroluminescence|electroluminescent]], and have been much investigated as a [[luminophore]] in [[organic light-emitting diode]]s. |
||
Revisi per 8 Agustus 2022 13.55
| |

| |

| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
9H-Fluorene[2] | |
| Nama IUPAC (sistematis)
Trisiklo[7.4.0.02,7]trideka-2,4,6,9,11,13-heksaena | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
| KEGG | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C13H10 | |
| Massa molar | 166,22 g·mol−1 |
| Densitas | 1,202 g/mL |
| Titik lebur | 116 hingga 117 °C (241 hingga 243 °F; 389 hingga 390 K) |
| Titik didih | 295 °C (563 °F; 568 K) |
| 1,992 mg/L | |
| Kelarutan | pelarut organik |
| log P | 4,18 |
| Keasaman (pKa) | 22,6 |
| -110,5·10−6 cm3/mol | |
| Bahaya | |
| Lembar data keselamatan | Sigma-Aldrich |
| Titik nyala | 152 °C (306 °F; 425 K) |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
16000 mg/kg (oral, rat) |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
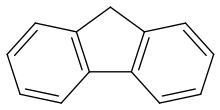
Fluorena /ˈflʊəriːn/, atau 9H-fluorena adalah senyawa organik dengan rumus kimia (C6H4)2CH2. Senyawa ini berbentuk kristal putih yang mengeluarkan bau aromatik khas, yang mirip dengan bau naftalena. Ia berfluoresensi ungu, sehingga dinamakan fluorena. Untuk keperluan komersial, fluorena diperoleh dari tar batu bara.[3] Fluorena tidak larut dalam air tetapi larut dalam pelarut organik. Meskipun terkadang digolongkan sebagai hidrokarbon aromatik polisiklik, anggota cincin-lima tidak memiliki sifat aromatik. Fluorena bersifat asam lemah.
Sintesis, struktur, dan reaktivitas
Meskipun fluorena diperoleh dari tar batu bara, ia dapat juga dibuat dari dehidrogenasi difenilmetana.[3] Selain itu, fluorena dapat dibuat dari reduksi fluorenon dengan seng[4] atau asam hipofosfit-iodin.[5] Molekul fluorena berbentuk hampir planar,[6] meskipun masing-masing dari kedua cincin benzena berbentuk koplanar dengan pusat karbon 9.[7]
Fluorena dapat dijumpai setelah pembakaran tak sempurna dari plastik seperti polistirena (PS), polietilena (PE) dan polivinil klorida (PVC).[8]
Keasaman
Situs C9-H pada cincin fluorena bersifat asam lemah (pKa = 22,6 dalam DMSO.[9]) Deprotonasi menghasilkan anion fluorenil (C13H9−) yang stabil, bersifat aromatik, dan memiliki warna jingga yang kuat. Anion ini bersifat nukleofil. Elektrofil bereaksi dengan fluorenil melalui adisi pada posisi 9. Pemurnian fluorena dilakukan dengan memanfaatkan keasamannya dan/atau memanfaatkan rendahnya kelarutan derivat natriumnya dalam pelarut hidrokarbon.
Kedua protonnya dapat disingkirkan dari C9. Sebagai contoh, 9,9-fluorenildikalium dapat diperoleh dari fluorena yang diberi perlakuan dengan logam kalium dalam dioksan mendidih.[10]
Sifat-sifat ligan
Fluorena dan turunannya dapat mengalami deprotonasi menghasilkan ligan yang serupa dengan siklopentadienida.

Penggunaan
Fluorena adalah prekursor untuk senyawa-senyawa fluorena lainnya; spesies induk yang memiliki beberapa aplikasi. Fluorena-9-asam karboksilat adalah prekursor untuk obat-obatan. Oksidasi fluorena menghasilkan fluorenon, yang jika dinitrasi menghasilkan turunan yang bermanfaat secara komersial. 9-Fluorenilmetil kloroformat (Fmoc klorida) digunakan untuk memasukkan gugus pelindung 9-fluorenilmetil karbamat (Fmoc) ke dalam amina pada sintesis peptida.[3]
Referensi
- ^ Merck Index, 11th Edition, 4081
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. hlm. 207. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ a b c Griesbaum, Karl; Behr, Arno; Biedenkapp, Dieter; Voges, Heinz-Werner; Garbe, Dorothea; Paetz, Christian; Collin, Gerd; Mayer, Dieter; Höke (2005), "Hydrocarbons", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a13_227
- ^ Fittig, Rud. (1873), "Ueber einen neuen Kohlenwasserstoff aus dem Diphenylenketon" Ber. Dtsch. Chem. Ges. volume 6, p. 187.DOI:10.1002/cber.18730060169
- ^ Hicks, Latorya D.; Han, Ja Kyung; Fry, Albert J. (2000). "Hypophosphorous acid–iodine: a novel reducing system". Tetrahedron Letters. Elsevier BV. 41 (41): 7817–7820. doi:10.1016/s0040-4039(00)01359-9. ISSN 0040-4039.
- ^ D. M. Burns, John Iball (1954), Molecular Structure of Fluorene Nature volume 173, p. 635. DOI:10.1038/173635a0
- ^ Gerkin, R. E.; Lundstedt, A. P.; Reppart, W. J. (1984). "Structure of fluorene, C13H10, at 159 K". Acta Crystallographica Section C Crystal Structure Communications. 40 (11): 1892–1894. doi:10.1107/S0108270184009963.
- ^ Wang, Zhenlei; Richter, Henning; Howard, Jack B.; Jordan, Jude; Carlson, Joel; Levendis, Yiannis A. (2004-06-01). "Laboratory Investigation of the Products of the Incomplete Combustion of Waste Plastics and Techniques for Their Minimization". Industrial & Engineering Chemistry Research. 43 (12): 2873–2886. doi:10.1021/ie030477u. ISSN 0888-5885.
- ^ F. G. Bordwell (1988). "Equilibrium acidities in dimethyl sulfoxide solution". Acc. Chem. Res. 21 (12): 456–463. doi:10.1021/ar00156a004.
- ^ G. W. Scherf; R. K. Brown (1960). "Potassium Derivatives of Fluorene as Intermediates in the Preparation of C9-substituted Fluorenes. I. The Preparation of 9-fluorenyl Potassium and the Infrared Spectra of Fluorene and Some C9-substituted Fluorenes". Canadian Journal of Chemistry. 38: 697. doi:10.1139/v60-100..
- ^ Ewen, J. A.; Jones, R. L.; Razavi, A.; Ferrara, J. D. (1988). "Syndiospecific Propylene Polymerizations with Group IVB Metallocenes". Journal of the American Chemical Society. 110 (18): 6255–6256. doi:10.1021/ja00226a056. PMID 22148816.
Pranala luar
- Fluorene in the National Institute of Standards and Technology database.
