Muatan parsial: Perbedaan antara revisi
k v2.04b - Fixed using Wikipedia:ProyekWiki Cek Wikipedia (Tanda baca setelah kode "<nowiki></ref></nowiki>") |
Vector version of diagram |
||
| Baris 7: | Baris 7: | ||
== Pendahuluan == |
== Pendahuluan == |
||
[[Berkas:Hydrogen-bonding-in-water-2D. |
[[Berkas:Hydrogen-bonding-in-water-2D.svg|jmpl|ka|[[Ikatan hidrogen]] pada [[air]].]] |
||
Muatan atom parsial dapat digunakan untuk mengukur tingkat [[ikatan ionik]] versus [[ikatan kovalen|kovalen]] senyawa mana pun pada [[tabel periodik]]. Kebutuhan akan kuantitas seperti itu muncul, misalnya, dalam simulasi molekul untuk menghitung sifat ruah dan permukaan yang sesuai dengan percobaan. Bukti untuk senyawa yang berbeda secara kimia menunjukkan bahwa data eksperimental dan pemahaman kimia yang tersedia menyebabkan muatan atom yang dibenarkan.<ref name=Heinz /> Muatan atom untuk senyawa tertentu dapat berasal dari berbagai cara, seperti: |
Muatan atom parsial dapat digunakan untuk mengukur tingkat [[ikatan ionik]] versus [[ikatan kovalen|kovalen]] senyawa mana pun pada [[tabel periodik]]. Kebutuhan akan kuantitas seperti itu muncul, misalnya, dalam simulasi molekul untuk menghitung sifat ruah dan permukaan yang sesuai dengan percobaan. Bukti untuk senyawa yang berbeda secara kimia menunjukkan bahwa data eksperimental dan pemahaman kimia yang tersedia menyebabkan muatan atom yang dibenarkan.<ref name=Heinz /> Muatan atom untuk senyawa tertentu dapat berasal dari berbagai cara, seperti: |
||
Revisi terkini sejak 17 Desember 2022 11.42
Muatan parsial adalah suatu nilai muatan tak-bulat ketika diukur dalam satuan muatan elementer. Muatan parsial umumnya disebut sebagai muatan atom bersih. Nilai ini diwakili oleh huruf Yunani kecil δ, yaitu δ− atau δ+.[1]

Muatan parsial dibuat karena distribusi elektron yang tidak simetris dalam ikatan kimia. Misalnya, dalam ikatan kovalen polar seperti HCl, elektron berosilasi bersama antara atom yang berikatan. Muatan parsial yang dihasilkan adalah sifat hanya dari zona dalam distribusi, dan bukan kumpulan secara keseluruhan. Sebagai contoh, kimiawan sering memilih untuk melihat ruang kecil di sekitar inti atom: ketika atom netral secara kelistrikan berikatan secara kimiawi dengan atom netral lain yang lebih elektronegatif, elektronnya sebagian ditarik menjauh. Hal ini meninggalkan daerah sekitar inti atom tersebut dengan muatan positif parsial, dan ini menciptakan muatan negatif parsial pada atom yang dilekatinya.[2]
Dalam situasi seperti ini, muatan terdistribusi yang diambil sebagai suatu gugus selalu membawa bilangan bulat keseluruhan dari satuan muatan elementer. Namun seseorang dapat menunjuk ke zona di dalam kumpulan di mana kurang dari muatan penuh berada, seperti area di sekitar inti atom. Hal ini dimungkinkan sebagian karena partikel tidak seperti titik matematis—yang harus berada di dalam zona atau di luarnya—tetapi dinaungi oleh prinsip ketidakpastian dari mekanika kuantum. Karena efek naungan ini, jika seseorang mendefinisikan zona yang cukup kecil, partikel fundamental mungkin sebagian berada di dalam dan sebagian di luarnya.
Pendahuluan
[sunting | sunting sumber]
Muatan atom parsial dapat digunakan untuk mengukur tingkat ikatan ionik versus kovalen senyawa mana pun pada tabel periodik. Kebutuhan akan kuantitas seperti itu muncul, misalnya, dalam simulasi molekul untuk menghitung sifat ruah dan permukaan yang sesuai dengan percobaan. Bukti untuk senyawa yang berbeda secara kimia menunjukkan bahwa data eksperimental dan pemahaman kimia yang tersedia menyebabkan muatan atom yang dibenarkan.[2] Muatan atom untuk senyawa tertentu dapat berasal dari berbagai cara, seperti:
- Pengukuran kerapatan elektron dengan menggunakan sinar-X resolusi tinggi, sinar gamma, atau percobaan difraksi sinar elektron
- Pengukuran momen dipol
- Siklus termodinamika Born yang termutakhir, termasuk analisis kontribusi ikatan kovalen dan ionik
- Pengukuran sifat spektroskopi, seperti pergeseran energi ikatan inti-elektron
- Hubungan muatan atom dengan titik lebur, kelarutan, dan energi pembelahan untuk satu set senyawa serupa dengan ikatan kovalen yang serupa.
- Hubungan muatan atom dengan reaktivitas kimia dan mekanisme reaksi untuk senyawa serupa yang dilaporkan dalam literatur.
Literatur penelitian yang dipublikasikan mengenai muatan atom parsial bervariasi dari kualitas dari yang sangat buruk sampai sangat baik. Meskipun sejumlah besar metode yang berbeda untuk menetapkan muatan atom parsial dari perhitungan kimia kuantum telah diajukan selama beberapa dekade, sebagian besar metode yang diusulkan tidak berjalan dengan baik melintasi beragam jenis material.[3][4] Baru pada tahun 2016, sebuah metode untuk menghitung secara teoretis muatan atom parsial dikembangkan yang berkinerja baik secara konsisten pada berbagai jenis material yang sangat beragam.[3][4] Semua metode sebelumnya memiliki kekurangan mendasar yang mencegah mereka untuk menetapkan muatan atom parsial yang akurat dalam banyak materi.[3][4] Muatan parsial Mulliken dan Löwdin secara fisik tidak masuk akal, karena tidak memiliki batas matematis karena basis set ditingkatkan menuju kelengkapan.[5] Muatan parsial Hirshfeld biasanya terlalu rendah.[6] Beberapa metode untuk menetapkan muatan atom parsial tidak menyatu dengan solusi yang unik.[3] Dalam beberapa bahan, analisis atom dalam molekul menghasilkan daya tarik non-inti yang menggambarkan partisi kerapatan elektron yang tidak dapat ditugaskan ke atom manapun dalam materi; Dalam kasus seperti itu, analisis atom dalam molekul tidak dapat menetapkan muatan atom parsial.[7]
Metode penentuan
[sunting | sunting sumber]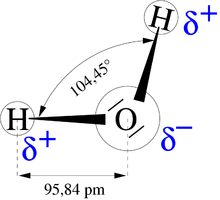
Terlepas dari kegunaannya, konsep muatan parsial sering kali kualitatif. Sebuah penentuan kuantitatif dari nilai ini mengharuskan sebuah teori yang membatasi ruang yang ditempati oleh masing-masing atom dalam sebuah molekul, seperti teori AIM (Atom in Molecule; Atom dalam Molekul).[8] Beberapa metode yang digunakan untuk mengukur muatan parsial pada atom. Metode ini dapat diklasifikasikan ke dalam empat kategori[9] karakteristik yaitu:
- Muatan kelas I. tidak didefinisikan menggunakan mekanika kuantum, tetapi dari pendekatan sewenang-wenang atau intuitif. Metode ini dapat didasarkan pada data eksperimen seperti momen dipol dan elektronegativitas; misalnya, hubungan yang diusulkan oleh Wilmshurst[10] memberikan muatan parsial untuk molekul diatomik AB sebagai rasio antara perbedaan elektronegativitas dari A dan B dan jumlah elektronegativitas keduanya:[11]
- Muatan kelas II. muatan berasal dari pemisahan fungsi gelombang molekul menggunakan pola sewenang-wenang berdasarkan pada orbital molekul;
- Muatan kelas III. muatan didasarkan pada pemisahan kuantitas berasal fungsi gelombang fisik diamati, sebagai kerapatan elektron;
- Muatan kelas IV. muatan berasal dari pemetaan semi-empiris muatan kelas II atau III untuk mereproduksi jumlah eksperimen diamati seperti momen dipol.
Kegunaan
[sunting | sunting sumber]Muatan atom parsial digunakan dalam mekanika molekul medan gaya untuk menghitung energi interaksi elektrostatik menggunakan hukum Coulomb.[12] Mereka juga sering digunakan untuk memahami struktur dan reaktivitas molekul secara kualitatif.[13]
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Notasi ini diperkenalkan pada tahun 1926 oleh Christopher Ingold dan istrinya: (Inggris) Jensen, William B. (2009). "The Origin of the "Delta" Symbol for Fractional Charges". J. Chem. Educ. 86: 545.
- ^ a b H. Heinz; U. W. Suter (2004). "Atomic Charges for Classical Simulations of Polar Systems". J. Phys. Chem. B. 108: 18341–18352. doi:10.1021/jp048142t.
- ^ a b c d T. A. Manz; N. Gabaldon-Limas (2016). "Introducing DDEC6 atomic population analysis: part 1. Charge partitioning theory and methodology". RSC Adv. 6: 47771–47801. doi:10.1039/c6ra04656h.
- ^ a b c N. Gabaldon-Limas; T. A. Manz (2016). "Introducing DDEC6 atomic population analysis: part 2. Computed results for a wide range of periodic and nonperiodic materials". RSC Adv. 6: 45727–45747. doi:10.1039/c6ra05507a.
- ^ A. E. Reed; R. B. Weinstock; F. Weinhold (1985). "Natural population analysis". J. Chem. Phys. 83: 735–746. doi:10.1063/1.449486.
- ^ E. R. Davidson; S. Chakravorty (1992). "A test of the Hirshfeld definition of atomic charges and moments". Theor. Chim. Acta. 83: 319–330. doi:10.1007/BF01113058.
- ^ C. Gatti; P. Fantucci; G. Pacchioni (1987). "Charge density topological study of bonding in lithium clusters". Theor. Chim. Acta. 72: 433–458. doi:10.1007/BF01192234.
- ^ Gillespie, R. & Popelier, P. (2001). Chemical Bonding and Molecular Geometry (Bab 6). Oxford: Oxford University Press.
- ^ C. J. Cramer (2002). Essentials of Computational Chemistry: Theories and Methods. Wiley. hlm. 278–289.
- ^ Wilmshurst, J. K. (1959). "Empirical Expression for Ionic Character and the Determination of s Hybridization from Nuclear Quadrupole Coupling Constants". J. Chem. Phys. 30: 561–565. doi:10.1063/1.1729987.
- ^ Meek T. & Garner L. (2005). "Electronegativity and the Bond Triangle". J. Chem. Educ. 82: 325.
- ^ H. Heinz; T. Z. Lin; R. K. Mishra; F. S. Emami (2013). "Thermodynamically Consistent Force Fields for the Assembly of Inorganic, Organic, and Biological Nanostructures: The INTERFACE Force Field". Langmuir. 29: 1754–1765. doi:10.1021/la3038846.
- ^ Torii, F. (2015). "Electronic Structural Basis for the Atomic Partial Charges of Planar Molecular Systems Derived from Out-of-Plane Dipole Derivatives". J. Phys. Chem. A. 119 (13): 3277–3284. doi:10.1021/jp512884g.
Bibliografi
[sunting | sunting sumber]- Meister, J. & Schwarz, W. H. E. (1994). "Principal Components of Ionicity". J. Phys. Chem. 98: 8245–8252. doi:10.1021/j100084a048.
- Frank Jensen. Introduction to Computational Chemistry (edisi ke-2nd). Wiley. ISBN 978-0-470-01187-4.




