Staphylococcus aureus resisten-metisilin: Perbedaan antara revisi
| Baris 68: | Baris 68: | ||
Saat ini, enam jenis SCCmec yang unik telah diidentifikasi, dengan ukuran mulai dari 21 hingga 67 kb. Mereka disebut tipe I-VI dan dibedakan berdasarkan variasi kompleks gen mec dan ccr. Karena ukuran elemen SCCmec dan keterbatasan transfer gen horizontal, setidaknya lima klon diyakini bertanggung jawab atas penyebaran infeksi MRSA, dengan kompleks klonal (CC) 8 menjadi yang paling umum.<ref>{{cite journal|date=May 2002|title=The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA)|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=99|issue=11|pages=7687–92|bibcode=2002PNAS...99.7687E|doi=10.1073/pnas.122108599|pmc=124322|pmid=12032344|vauthors=Enright MC, Robinson DA, Randle G, Feil EJ, Grundmann H, Spratt BG|doi-access=free}}</ref> SCCmec diperkirakan berasal dari spesies Staphylococcus sciuri yang berkerabat dekat dan dipindahkan secara horizontal ke S. aureus. |
Saat ini, enam jenis SCCmec yang unik telah diidentifikasi, dengan ukuran mulai dari 21 hingga 67 kb. Mereka disebut tipe I-VI dan dibedakan berdasarkan variasi kompleks gen mec dan ccr. Karena ukuran elemen SCCmec dan keterbatasan transfer gen horizontal, setidaknya lima klon diyakini bertanggung jawab atas penyebaran infeksi MRSA, dengan kompleks klonal (CC) 8 menjadi yang paling umum.<ref>{{cite journal|date=May 2002|title=The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA)|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=99|issue=11|pages=7687–92|bibcode=2002PNAS...99.7687E|doi=10.1073/pnas.122108599|pmc=124322|pmid=12032344|vauthors=Enright MC, Robinson DA, Randle G, Feil EJ, Grundmann H, Spratt BG|doi-access=free}}</ref> SCCmec diperkirakan berasal dari spesies Staphylococcus sciuri yang berkerabat dekat dan dipindahkan secara horizontal ke S. aureus. |
||
Genotipe SCCmec yang berbeda memberikan karakteristik mikrobiologis yang berbeda, termasuk tingkat resistensi antimikroba yang bervariasi. Selain itu, genotipe yang berbeda dikaitkan dengan jenis infeksi yang berbeda. SCCmec tipe I-III umumnya merupakan elemen besar yang sering kali mengandung gen resistensi tambahan dan biasanya ditemukan pada strain HA-MRSA. Sebaliknya, strain CA-MRSA dikaitkan dengan tipe IV dan V, yang lebih kecil dan tidak memiliki gen resistensi selain mecA.<ref name="kuo12">{{cite journal|display-authors=6|date=January 2012|title=Comparison of microbiological and clinical characteristics based on SCCmec typing in patients with community-onset meticillin-resistant Staphylococcus aureus (MRSA) bacteraemia|url=http://ir.nhri.org.tw/bitstream/3990099045/6059/1/SCP80053518786.pdf|journal=International Journal of Antimicrobial Agents|volume=39|issue=1|pages=22–6|doi=10.1016/j.ijantimicag.2011.08.014|pmid=21982834|vauthors=Kuo SC, Chiang MC, Lee WS, Chen LY, Wu HS, Yu KW, Fung CP, Wang FD}}</ref> |
|||
Collins dkk. menyelidiki perbedaan ini pada tahun 2001 dan menemukan bahwa perbedaan ini dapat dijelaskan oleh biaya kebugaran yang terkait dengan membawa plasmid SCCmec besar atau kecil. Membawa plasmid besar, seperti SCCmecI-III, mahal bagi bakteri, yang mengakibatkan penurunan kompensasi dalam ekspresi virulensi. Di lingkungan rumah sakit dengan peningkatan resistensi antibiotik tetapi penurunan virulensi, HA-MRSA dapat berkembang, karena menargetkan inang yang mengalami gangguan kekebalan dan dirawat di rumah sakit. Oleh karena itu, penurunan virulensi tidak bersifat maladaptif bagi HA-MRSA. Sebaliknya, CA-MRSA cenderung membawa elemen SCCmec dengan biaya kebugaran yang lebih rendah untuk mengimbangi peningkatan virulensi dan ekspresi toksisitas yang diperlukan untuk menginfeksi inang yang sehat.<ref name=":0">{{cite journal|date=April 2010|title=Offsetting virulence and antibiotic resistance costs by MRSA|journal=The ISME Journal|volume=4|issue=4|pages=577–84|doi=10.1038/ismej.2009.151|pmid=20072161|vauthors=Collins J, Rudkin J, Recker M, Pozzi C, O'Gara JP, Massey RC|s2cid=38231565|doi-access=free}}</ref> |
|||
=== ''mecA'' === |
=== ''mecA'' === |
||
mecA adalah gen biomarker yang bertanggung jawab atas resistensi terhadap metisilin dan antibiotik β-laktam lainnya. Setelah memperoleh mecA, gen tersebut harus diintegrasikan dan dilokalisasi di dalam kromosom S. aureus. mecA mengkode protein pengikat penisilin 2a (PBP2a), yang berbeda dengan protein pengikat penisilin lainnya karena situs aktifnya tidak mengikat penisilin atau antibiotik β-laktam lainnya. Akibatnya, PBP2a dapat terus mengkatalisis reaksi transpeptidasi yang diperlukan untuk ikatan silang peptidoglikan, yang memungkinkan sintesis dinding sel bahkan dengan adanya antibiotik. Karena ketidakmampuan PBP2a untuk berinteraksi dengan kelompok β-laktam, akuisisi mecA memberikan resistensi terhadap semua antibiotik β-laktam, bukan hanya metisilin.<ref>Sahebnasagh R, Saderi H, Owlia P. Detection of methicillin-resistant Staphylococcus aureus strains from clinical samples in Tehran by detection of the mecA and nuc genes. The First Iranian International Congress of Medical Bacteriology; 4–7 September; Tabriz, Iran. 2011. 195 pp.</ref> |
mecA adalah gen biomarker yang bertanggung jawab atas resistensi terhadap metisilin dan antibiotik β-laktam lainnya. Setelah memperoleh mecA, gen tersebut harus diintegrasikan dan dilokalisasi di dalam kromosom S. aureus. mecA mengkode protein pengikat penisilin 2a (PBP2a), yang berbeda dengan protein pengikat penisilin lainnya karena situs aktifnya tidak mengikat penisilin atau antibiotik β-laktam lainnya. Akibatnya, PBP2a dapat terus mengkatalisis reaksi transpeptidasi yang diperlukan untuk ikatan silang peptidoglikan, yang memungkinkan sintesis dinding sel bahkan dengan adanya antibiotik. Karena ketidakmampuan PBP2a untuk berinteraksi dengan kelompok β-laktam, akuisisi mecA memberikan resistensi terhadap semua antibiotik β-laktam, bukan hanya metisilin.<ref>Sahebnasagh R, Saderi H, Owlia P. Detection of methicillin-resistant Staphylococcus aureus strains from clinical samples in Tehran by detection of the mecA and nuc genes. The First Iranian International Congress of Medical Bacteriology; 4–7 September; Tabriz, Iran. 2011. 195 pp.</ref> |
||
Regulasi mecA melibatkan dua gen pengatur, mecI dan mecR1. mecI menekan promotor mecA, tetapi dengan adanya antibiotik β-laktam, mecR1 memulai jalur transduksi sinyal yang mengarah pada aktivasi transkripsi mecA. Hal ini dicapai melalui pembelahan MecI oleh MecR1, yang mengurangi represi. Regulasi mecA juga dikendalikan oleh dua co-repressor, blaI dan blaR1, yang masing-masing homolog dengan mecI dan mecR1, dan biasanya berfungsi sebagai pengatur blaZ, yang bertanggung jawab atas resistensi penisilin. Sekuens DNA yang diikat oleh mecI dan blaI identik, yang berarti bahwa blaI juga dapat mengikat operator mecA untuk menekan transkripsinya.<ref name="berger-bachi">{{cite journal|date=November 1999|title=Genetic basis of methicillin resistance in Staphylococcus aureus|url=http://link.springer.de/link/service/journals/00018/bibs/90569-10/90560764.htm|journal=Cellular and Molecular Life Sciences|volume=56|issue=9–10|pages=764–70|doi=10.1007/s000180050023|pmid=11212336|archive-url=https://archive.today/20130212050521/http://link.springer.de/link/service/journals/00018/bibs/90569-10/90560764.htm|archive-date=2013-02-12|vauthors=Berger-Bächi B|s2cid=40019841|url-status=dead}}</ref> |
|||
=== Elemen seluler katabolik arginin === |
=== Elemen seluler katabolik arginin === |
||
| Baris 77: | Baris 83: | ||
=== Galur === |
=== Galur === |
||
Akuisisi SCCmec pada S. aureus yang peka terhadap metisilin (MSSA) mengarah pada pengembangan berbagai garis keturunan MRSA yang berbeda secara genetik. Perbedaan genetik dalam strain MRSA ini dapat menjelaskan variabilitas dalam virulensi dan infeksi MRSA yang terkait. Strain MRSA pertama, ST250 MRSA-1, dihasilkan dari integrasi SCCmec dan ST250-MSSA. Secara historis, klon MRSA utama seperti ST2470-MRSA-I, ST239-MRSA-III, ST5-MRSA-II, dan ST5-MRSA-IV bertanggung jawab atas infeksi MRSA yang didapat di rumah sakit (HA-MRSA). ST239-MRSA-III, yang juga dikenal sebagai klon Brasil, lebih mudah menular dibandingkan klon lainnya dan menyebar ke seluruh Argentina, Republik Ceko, dan Portugal.<ref name="GordonLowy20082">{{cite journal|date=June 2008|title=Pathogenesis of methicillin-resistant Staphylococcus aureus infection|journal=Clinical Infectious Diseases|volume=46 Suppl 5|issue=Suppl 5|pages=S350–9|doi=10.1086/533591|pmc=2474459|pmid=18462090|vauthors=Gordon RJ, Lowy FD}}</ref> |
Akuisisi SCCmec pada S. aureus yang peka terhadap metisilin (MSSA) mengarah pada pengembangan berbagai garis keturunan MRSA yang berbeda secara genetik. Perbedaan genetik dalam strain MRSA ini dapat menjelaskan variabilitas dalam virulensi dan infeksi MRSA yang terkait. Strain MRSA pertama, ST250 MRSA-1, dihasilkan dari integrasi SCCmec dan ST250-MSSA. Secara historis, klon MRSA utama seperti ST2470-MRSA-I, ST239-MRSA-III, ST5-MRSA-II, dan ST5-MRSA-IV bertanggung jawab atas infeksi MRSA yang didapat di rumah sakit (HA-MRSA). ST239-MRSA-III, yang juga dikenal sebagai klon Brasil, lebih mudah menular dibandingkan klon lainnya dan menyebar ke seluruh Argentina, Republik Ceko, dan Portugal.<ref name="GordonLowy20082">{{cite journal|date=June 2008|title=Pathogenesis of methicillin-resistant Staphylococcus aureus infection|journal=Clinical Infectious Diseases|volume=46 Suppl 5|issue=Suppl 5|pages=S350–9|doi=10.1086/533591|pmc=2474459|pmid=18462090|vauthors=Gordon RJ, Lowy FD}}</ref> |
||
Strain MRSA yang paling sering muncul di Inggris adalah EMRSA15 dan EMRSA16,<ref name="JAntimicrobChemother2001-Johnson">{{cite journal|display-authors=6|date=July 2001|title=Dominance of EMRSA-15 and -16 among MRSA causing nosocomial bacteraemia in the UK: analysis of isolates from the European Antimicrobial Resistance Surveillance System (EARSS)|journal=The Journal of Antimicrobial Chemotherapy|volume=48|issue=1|pages=143–4|doi=10.1093/jac/48.1.143|pmid=11418528|vauthors=Johnson AP, Aucken HM, Cavendish S, Ganner M, Wale MC, Warner M, Livermore DM, Cookson BD|doi-access=free}}</ref> dengan EMRSA16 ditemukan identik dengan strain ST36: USA200 yang ditemukan di Amerika Serikat dan membawa gen SCCmec tipe II, enterotoksin A, dan toksin sindrom syok toksik 1.<ref name="diep2006">{{cite journal|date=June 2006|title=Roles of 34 virulence genes in the evolution of hospital- and community-associated strains of methicillin-resistant Staphylococcus aureus|journal=The Journal of Infectious Diseases|volume=193|issue=11|pages=1495–503|doi=10.1086/503777|pmid=16652276|vauthors=Diep BA, Carleton HA, Chang RF, Sensabaugh GF, Perdreau-Remington F|doi-access=free}}</ref> Strain ini telah berganti nama menjadi MRSA252 di bawah sistem pengetikan internasional yang baru. EMRSA15 juga merupakan jenis yang umum ditemukan di Asia, bersama dengan jenis lain seperti ST5: USA100 dan EMRSA1,<ref name="StefaniChung2012">{{cite journal|date=April 2012|title=Meticillin-resistant Staphylococcus aureus (MRSA): global epidemiology and harmonisation of typing methods|journal=International Journal of Antimicrobial Agents|volume=39|issue=4|pages=273–82|doi=10.1016/j.ijantimicag.2011.09.030|pmid=22230333|vauthors=Stefani S, Chung DR, Lindsay JA, Friedrich AW, Kearns AM, Westh H, Mackenzie FM}}</ref> yang kesemuanya merupakan penanda genetik HA-MRSA.<ref name="calfee2011">{{cite journal|year=2011|title=The epidemiology, treatment, and prevention of transmission of methicillin-resistant Staphylococcus aureus|journal=Journal of Infusion Nursing|volume=34|issue=6|pages=359–64|doi=10.1097/NAN.0b013e31823061d6|pmid=22101629|vauthors=Calfee DP|s2cid=11490852}}</ref> |
|||
Strain MRSA yang didapat dari komunitas (CA-MRSA) muncul pada akhir 1990-an dan awal 2000-an, menginfeksi individu sehat yang belum pernah melakukan kontak dengan fasilitas kesehatan. CA-MRSA diyakini telah berevolusi secara independen dari strain HA-MRSA. Pengetikan molekuler dan perbandingan genom CA-MRSA dan HA-MRSA telah mengkonfirmasi hal ini.<ref name="daum2007">{{cite journal|date=July 2007|title=Clinical practice. Skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus|journal=The New England Journal of Medicine|volume=357|issue=4|pages=380–90|doi=10.1056/NEJMcp070747|pmid=17652653|vauthors=Daum RS}}</ref> Pada pertengahan 2000-an, CA-MRSA telah menyebar ke dalam lingkungan perawatan kesehatan, sehingga lebih sulit dibedakan dari HA-MRSA. CA-MRSA umumnya lebih ganas daripada HA-MRSA, dan mekanisme genetik di baliknya masih terus dipelajari. Gen Panton-Valentine leukocidin (PVL) menjadi perhatian khusus karena unik untuk CA-MRSA. |
|||
MRSA yang didapat dari komunitas (CA-MRSA) di AS terutama disebabkan oleh dua jenis: ST8: USA300 dan ST1: USA400, yang terkait dengan berbagai jenis infeksi. ST8: USA300 menyebabkan infeksi kulit, fasciitis nekrotikans, dan sindrom syok toksik, sedangkan ST1: USA400 menyebabkan pneumonia nekrotikans dan sepsis paru.<ref>{{cite journal|display-authors=6|date=December 2007|title=Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA|journal=Nature Medicine|volume=13|issue=12|pages=1510–4|doi=10.1038/nm1656|pmid=17994102|vauthors=Wang R, Braughton KR, Kretschmer D, Bach TH, Queck SY, Li M, Kennedy AD, Dorward DW, Klebanoff SJ, Peschel A, DeLeo FR, Otto M|s2cid=8465052}}</ref> Strain CA-MRSA lainnya termasuk ST8: USA500 dan ST59: USA1000. Namun, di belahan dunia lain, strain yang berbeda telah mendominasi di antara strain CA-MRSA, seperti ST93 di Australia dan ST80 di benua Eropa.<ref name="GouldDavid2012">{{cite journal|date=February 2012|title=New insights into meticillin-resistant Staphylococcus aureus (MRSA) pathogenesis, treatment and resistance|url=https://zenodo.org/record/3443333|journal=International Journal of Antimicrobial Agents|volume=39|issue=2|pages=96–104|doi=10.1016/j.ijantimicag.2011.09.028|pmid=22196394|vauthors=Gould IM, David MZ, Esposito S, Garau J, Lina G, Mazzei T, Peters G}}</ref> Di Taiwan, strain ST59 telah menjadi penyebab umum infeksi kulit dan jaringan lunak di masyarakat, dan beberapa strain ini resisten terhadap banyak antibiotik non-beta-laktam. Di Alaska, USA300 jarang ditemukan dalam studi tentang strain MRSA dari wabah dan pengawasan, tidak seperti sebagian besar benua AS.<ref name="pmid18976551">{{cite journal|date=November 2008|title=Molecular epidemiology of methicillin-resistant Staphylococcus aureus, rural southwestern Alaska|journal=Emerging Infectious Diseases|volume=14|issue=11|pages=1693–9|doi=10.3201/eid1411.080381|pmc=2630737|pmid=18976551|vauthors=David MZ, Rudolph KM, Hennessy TW, Boyle-Vavra S, Daum RS}}</ref> |
|||
MRSA yang terkait dengan ternak (LA-MRSA) terutama ditemukan pada hewan produksi yang dipelihara secara intensif seperti babi, sapi, dan unggas. Strain MRSA tertentu yang disebut CC398 umumnya dikaitkan dengan hewan-hewan ini dan dapat ditularkan ke manusia.<ref>{{cite journal|last1=Panel on Biological Hazards|date=16 June 2009|title=Joint scientific report of ECDC, EFSA and EMEA on meticillin resistant Staphylococcus aureus (MRSA) in livestock, companion animals and food.|journal=EFSA Journal|volume=7|issue=6|doi=10.2903/j.efsa.2009.301r|doi-access=free}}</ref><ref name="GravelandDuim2011">{{cite journal|date=December 2011|title=Livestock-associated methicillin-resistant Staphylococcus aureus in animals and humans|journal=International Journal of Medical Microbiology|volume=301|issue=8|pages=630–4|doi=10.1016/j.ijmm.2011.09.004|pmid=21983338|vauthors=Graveland H, Duim B, van Duijkeren E, Heederik D, Wagenaar JA|hdl=1874/407042}}</ref> |
|||
== Diagnosis == |
== Diagnosis == |
||
| Baris 168: | Baris 182: | ||
=== HA-MRSA === |
=== HA-MRSA === |
||
Dalam sebuah penelitian yang dilakukan terhadap 1.300 anak sehat di AS, 2,4% di antaranya ditemukan membawa MRSA dalam lubang hidung mereka.<ref name="auto">{{cite journal|date=June 2008|title=Prevalence of and risk factors for community-acquired methicillin-resistant and methicillin-sensitive staphylococcus aureus colonization in children seen in a practice-based research network|journal=Pediatrics|volume=121|issue=6|pages=1090–8|doi=10.1542/peds.2007-2104|pmid=18519477|vauthors=Fritz SA, Garbutt J, Elward A, Shannon W, Storch GA|s2cid=23112235}}</ref> Sepsis bakteri adalah komplikasi yang paling umum (75%) yang terkait dengan infeksi MRSA invasif.<ref name="IDSA2011" /> Rawat inap akibat MRSA diperkirakan mencapai 463.017 pada tahun 2009, dengan angka 11,74 per 1.000 rawat inap.<ref name="klein2013">{{cite journal|date=April 2013|title=The changing epidemiology of methicillin-resistant Staphylococcus aureus in the United States: a national observational study|journal=American Journal of Epidemiology|volume=177|issue=7|pages=666–74|doi=10.1093/aje/kws273|pmid=23449778|vauthors=Klein EY, Sun L, Smith DL, Laxminarayan R|doi-access=free}}</ref> Meskipun banyak infeksi MRSA yang tidak serius, CDC melaporkan bahwa masih ada 80.461 infeksi MRSA invasif dan 11.285 kematian akibat MRSA setiap tahunnya.<ref>{{cite web|date=2019-05-07|title=Antibiotic Resistance Threats in the United States, 2013 – Antibiotic/Antimicrobial Resistance – CDC|url=https://www.cdc.gov/drugresistance/threat-report-2013/}}{{CDC}}</ref> Pada 2003, biaya rawat inap akibat infeksi MRSA adalah Rp 829.099.482; biaya rawat inap akibat MSSA adalah Rp 468.754.423.<ref name="YueDong2016" /> |
Dalam sebuah penelitian yang dilakukan terhadap 1.300 anak sehat di AS, 2,4% di antaranya ditemukan membawa MRSA dalam lubang hidung mereka.<ref name="auto">{{cite journal|date=June 2008|title=Prevalence of and risk factors for community-acquired methicillin-resistant and methicillin-sensitive staphylococcus aureus colonization in children seen in a practice-based research network|journal=Pediatrics|volume=121|issue=6|pages=1090–8|doi=10.1542/peds.2007-2104|pmid=18519477|vauthors=Fritz SA, Garbutt J, Elward A, Shannon W, Storch GA|s2cid=23112235}}</ref> Sepsis bakteri adalah komplikasi yang paling umum (75%) yang terkait dengan infeksi MRSA invasif.<ref name="IDSA2011" /> Rawat inap akibat MRSA diperkirakan mencapai 463.017 pada tahun 2009, dengan angka 11,74 per 1.000 rawat inap.<ref name="klein2013">{{cite journal|date=April 2013|title=The changing epidemiology of methicillin-resistant Staphylococcus aureus in the United States: a national observational study|journal=American Journal of Epidemiology|volume=177|issue=7|pages=666–74|doi=10.1093/aje/kws273|pmid=23449778|vauthors=Klein EY, Sun L, Smith DL, Laxminarayan R|doi-access=free}}</ref> Meskipun banyak infeksi MRSA yang tidak serius, CDC melaporkan bahwa masih ada 80.461 infeksi MRSA invasif dan 11.285 kematian akibat MRSA setiap tahunnya.<ref>{{cite web|date=2019-05-07|title=Antibiotic Resistance Threats in the United States, 2013 – Antibiotic/Antimicrobial Resistance – CDC|url=https://www.cdc.gov/drugresistance/threat-report-2013/}}{{CDC}}</ref> Pada 2003, biaya rawat inap akibat infeksi MRSA adalah Rp 829.099.482; biaya rawat inap akibat MSSA adalah Rp 468.754.423.<ref name="YueDong2016" /> |
||
Infeksi setelah prosedur pembedahan relatif jarang terjadi, tetapi dapat terjadi hingga 33% dari jenis pembedahan tertentu. Insiden infeksi di tempat pembedahan bervariasi dari 1% hingga 33%. Sepsis MRSA yang terjadi dalam waktu 30 hari setelah pembedahan memiliki angka kematian 15-38%, sedangkan sepsis MRSA yang terjadi dalam waktu satu tahun memiliki angka kematian sekitar 55%. Mungkin terdapat angka kematian yang lebih tinggi terkait dengan pembedahan jantung, dengan angka 12,9% pada mereka yang terinfeksi MRSA dibandingkan dengan 3% yang terinfeksi organisme lain. Pasien dengan infeksi MRSA juga cenderung lebih lama dirawat di rumah sakit dibandingkan dengan mereka yang tidak terinfeksi. |
|||
Secara global, tingkat infeksi MRSA bersifat dinamis dan bervariasi dari tahun ke tahun.<ref>{{cite web|date=2017|title=ResistanceMap – Antibiotic Resistance|url=https://resistancemap.cddep.org/AntibioticResistance.php|website=resistancemap.cddep.org|publisher=Center for Disease Dynamics, Economics & Policy|access-date=27 May 2017}} note: a search must be performed on the website; it is interactive and the statistics are based upon the most current information,</ref> Menurut laporan Program Pengawasan Antimikroba SENTRY tahun 2006, kejadian infeksi aliran darah MRSA adalah 35,9 per 100.000 hari pasien di Amerika Utara. Infeksi darah MRSA di Amerika Latin adalah 29%. Insiden di Eropa adalah 22,8%. Tingkat semua infeksi MRSA di Eropa berkisar antara 50 per 100.000 hari pasien di Portugal hingga 0,8 per 100.000 hari pasien di Swedia. Tingkat infeksi MRSA secara keseluruhan bervariasi di Amerika Latin: Kolombia dan Venezuela digabungkan memiliki 3%, Meksiko memiliki 50%, Chili 38%, Brasil 29%, dan Argentina 28%. |
|||
Pada tahun 2002, Pusat Pengendalian dan Pencegahan Penyakit (CDC) memperkirakan sekitar 1,7 juta kasus infeksi nosokomial terjadi di Amerika Serikat, yang menyebabkan 99.000 kematian. Perkiraan tingkat kejadian adalah 4,5 infeksi per 100 pasien rawat inap, dan biaya langsung bervariasi dari $10,500 (IDR 150,675,000) hingga $111,000 (IDR 1,585,250,000) per kasus, tergantung pada jenis infeksinya. Total biaya langsung infeksi nosokomial diperkirakan mencapai lebih dari 17 miliar (IDR 242,6 triliun). Sangatlah penting untuk mengurangi infeksi ini sebagai bagian dari upaya untuk meningkatkan keamanan perawatan kesehatan. MRSA ditemukan terkait dengan 8% infeksi nosokomial yang dilaporkan ke CDC National Healthcare Safety Network dari Januari 2006 hingga Oktober 2007.<ref name="pmid18947320">{{cite journal|date=November 2008|title=NHSN annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006–2007|journal=Infection Control and Hospital Epidemiology|volume=29|issue=11|pages=996–1011|doi=10.1086/591861|pmid=18947320|vauthors=Hidron AI, Edwards JR, Patel J, Horan TC, Sievert DM, Pollock DA, Fridkin SK|s2cid=205988392}}</ref> |
|||
Menurut Kantor Audit Nasional Inggris, prevalensi infeksi yang didapat di rumah sakit di Eropa diperkirakan antara 4% dan 10% dari semua pasien yang masuk rumah sakit. Di Inggris, berbagai sumber memperkirakan sekitar 3.000 kematian per tahun disebabkan oleh MRSA sejak awal 2005.<ref>{{cite journal|date=September 2005|title=Surveillance and epidemiology of MRSA bacteraemia in the UK|journal=The Journal of Antimicrobial Chemotherapy|volume=56|issue=3|pages=455–62|doi=10.1093/jac/dki266|pmid=16046464|vauthors=Johnson AP, Pearson A, Duckworth G|doi-access=free}}</ref> |
|||
Di Amerika Serikat, sekitar 95 juta orang diyakini membawa ''S. aureus'' dalam hidung mereka. Di antara mereka, 2,5 juta orang (2,6% pembawa) membawa MRSA, strain yang resisten terhadap banyak antibiotik.<ref>{{cite journal|date=March 2006|title=A U.S. population-based survey of Staphylococcus aureus colonization|journal=Annals of Internal Medicine|volume=144|issue=5|pages=318–25|doi=10.7326/0003-4819-144-5-200603070-00006|pmid=16520472|vauthors=Graham PL, Lin SX, Larson EL|s2cid=38816447}}</ref> Sebuah tinjauan populasi yang dilakukan di tiga komunitas di Amerika Serikat menunjukkan bahwa insiden tahunan MRSA yang didapat dari komunitas (CA-MRSA) selama tahun 2001-2002 adalah antara 18 hingga 25,7 kasus per 100.000 orang. Sebagian besar kasus CA-MRSA terkait dengan infeksi yang relevan secara klinis, dan sekitar 23% pasien memerlukan rawat inap.<ref>{{cite conference|vauthors=Jernigan JA, Arnold K, Heilpern K, Kainer M, Woods C, Hughes JM|title=Methicillin-resistant ''Staphylococcus aureus'' as community pathogen|book-title=Symposium on Community-Associated Methicillin-resistant ''Staphylococcus aureus'' (Atlanta, Georgia, U.S.). Cited in Emerg Infect Dis|publisher=Centers for Disease Control and Prevention|date=2006-05-12|url=https://www.cdc.gov/ncidod/EID/vol12no11/06-0911.htm|access-date=2007-01-27}}</ref> |
|||
=== CA-MRSA === |
=== CA-MRSA === |
||
Revisi per 7 Mei 2023 01.43
Staphylococcus aureus resisten-metisilin atau Methicillin-resistant Staphylococcus aureus (MRSA) adalah sekelompok bakteri gram positif yang berbeda secara genetis dari jenis Staphylococcus aureus lainnya. MRSA bertanggung jawab atas sejumlah infeksi pada manusia yang sulit disembuhkan. Pada 2019, MRSA menyebabkan lebih dari 100.000 kematian yang terkait dengan resistensi antimikroba.
Dengan kata lain, MRSA adalah jenis S. aureus yang telah berevolusi atau memperoleh resistensi obat ganda terhadap antibiotik beta-laktam melalui seleksi alam atau transfer gen secara horizontal. Antibiotik beta-laktam, yang meliputi turunan penisilin seperti metisilin dan oksasilin, serta sepem seperti sefalosporin,[1] adalah kelompok antibiotik yang beragam. Strain yang tidak tahan terhadap antibiotik ini dikenal sebagai S. aureus yang rentan terhadap metisilin (methicillin-susceptible S. aureus, MSSA).
MRSA lazim ditemukan di fasilitas perawatan kesehatan, lembaga pemasyarakatan, dan panti jompo, di mana individu dengan sistem kekebalan tubuh yang lemah, luka terbuka, dan perangkat invasif seperti kateter berisiko lebih tinggi terkena infeksi yang berhubungan dengan perawatan kesehatan. Awalnya, MRSA merupakan infeksi yang didapat di rumah sakit, tetapi sekarang telah menjadi infeksi yang didapat di masyarakat dan bahkan didapat melalui hewan ternak. Hal ini tercermin dalam terminologi yang digunakan untuk menggambarkan MRSA: HA-MRSA (MRSA yang terkait dengan perawatan kesehatan atau yang didapat dari rumah sakit), CA-MRSA (MRSA yang terkait dengan komunitas), dan LA-MRSA (MRSA yang terkait dengan hewan ternak).[2]
Tanda dan gejala

Staphylococcus aureus adalah komponen khas dari mikrobioma manusia, yang ditemukan di sistem pernapasan bagian atas,[3] di kulit, dan di dalam lapisan usus.[4] Meskipun dapat hidup berdampingan secara harmonis dengan bakteri lain, bakteri ini dapat menyebabkan penyakit jika mulai mendominasi atau menyebar ke area lain di dalam tubuh. Infeksi semacam itu disebut sebagai "patobion," di mana mikroorganisme yang biasanya komensal menjadi patogen oportunistik.[3]
Dalam jaringan manusia, MRSA dapat berkembang biak dan mengembangkan resistensi terhadap pengobatan dalam waktu 72 jam. Tanda-tanda awal infeksi MRSA adalah benjolan kecil berwarna merah seperti jerawat, yang mungkin menyerupai gigitan laba-laba atau bisul, dan dapat disertai demam dan terkadang ruam. Dalam beberapa hari, benjolan ini membesar dan menjadi lebih menyakitkan, yang akhirnya berkembang menjadi luka yang dalam dan berisi nanah. Sekitar 75% infeksi CA-MRSA terbatas pada kulit dan jaringan lunak, dan biasanya dapat diobati dengan efektif.[5]
Faktor risiko
Beberapa populasi khusus yang berisiko meliputi:
- Individu dengan perangkat implan, prostetik, saluran air, atau kateter[1][6]
- Mereka yang sering berada di lingkungan yang ramai dengan peralatan bersama dan kontak fisik yang dekat[7]
- Orang dengan sistem kekebalan tubuh yang terganggu, seperti penderita HIV/AIDS, lupus, atau kanker, penerima transplantasi, penderita asma berat, dll.
- Penderita diabetes[1][8]
- Pengguna obat intravena[9][10][11]
- Mereka yang melakukan kontak rutin dengan seseorang yang telah menggunakan obat intravena dalam satu tahun terakhir[12]
- Pengguna antibiotik kuinolon[6][13]
- Orang tua[6][14]
- Anak-anak sekolah yang berbagi peralatan olahraga dan peralatan lainnya
- Mahasiswa yang tinggal di asrama[7]
- Individu yang tinggal atau bekerja di fasilitas kesehatan untuk waktu yang lama[6][7]
- Orang yang sering mengunjungi perairan pesisir di mana MRSA ada, seperti pantai Florida dan Pantai Barat tertentu di AS[15][16]
- Mereka yang berada di ruang terbatas dengan orang lain, termasuk penghuni penampungan tunawisma, narapidana di penjara, dan anggota militer yang sedang menjalani pelatihan dasar[17][18]
- Dokter hewan, penangan ternak, dan pemilik hewan peliharaan[19]
- Konsumen susu mentah[20]
- Individu dengan gangguan sistem kekebalan[21]
- Orang dengan penyakit paru obstruktif kronik[6]
- Individu yang telah menjalani operasi toraks[6]
Sebanyak 22% orang yang terinfeksi MRSA tidak memiliki faktor risiko yang jelas.[22]
Orang yang dirawat di rumah sakit
Pasien yang dirawat di rumah sakit, terutama lansia, sering kali memiliki sistem kekebalan tubuh yang lemah, sehingga lebih rentan terhadap berbagai infeksi, termasuk MRSA. Infeksi oleh MRSA dalam kondisi seperti ini disebut sebagai S. aureus resisten metisilin yang terkait dengan perawatan kesehatan atau yang didapat di rumah sakit (HA-MRSA).[1][6][23][24] Umumnya, orang yang dirawat oleh dokter karena MRSA tetap terinfeksi selama sekitar 10 hari, meskipun hasilnya dapat bervariasi.[25]
HA-MRSA dapat menginfeksi luka bedah dan non-bedah. Infeksi di lokasi pembedahan dimulai dari permukaan kulit, tetapi dapat menyebar ke organ dalam dan darah, yang menyebabkan sepsis. Penularan dapat terjadi antara penyedia layanan kesehatan dan pasien, terutama ketika penyedia layanan kesehatan gagal mempraktikkan kebersihan tangan yang tepat di antara pemeriksaan.[26]
Penghuni panti jompo berisiko karena alasan yang disebutkan di atas, yang diperburuk oleh sistem kekebalan tubuh mereka yang biasanya lebih lemah.[27]
Narapidana dan personel militer
Penjara dan barak militer bisa jadi penuh sesak dan terbatas, yang berpotensi menyebabkan praktik kebersihan yang buruk dan peningkatan risiko infeksi MRSA bagi para penghuninya. Kasus MRSA pada populasi seperti itu awalnya dilaporkan di Amerika Serikat, diikuti oleh Kanada. Pusat Pengendalian dan Pencegahan Penyakit membuat laporan paling awal di penjara negara bagian AS. Antara tahun 2000 dan 2008, banyak wabah MRSA di penjara yang dilaporkan di media. Misalnya, pada Februari 2008, penjara Tulsa County di Oklahoma mulai merawat rata-rata 12 kasus S. aureus per bulan.[28]
Hewan
Penggunaan antibiotik pada hewan ternak meningkatkan kemungkinan berkembangnya MRSA di antara hewan-hewan tersebut; strain MRSA ST 398 dan CC398 dapat ditularkan ke manusia.[29] Pada kebanyakan kasus, hewan tidak menunjukkan gejala.
Hewan peliharaan dapat tertular MRSA dari pemiliknya, dan demikian pula, hewan peliharaan yang terinfeksi MRSA dapat menularkan infeksi kepada manusia.[30]
Atlet
Ruang ganti, pusat kebugaran, dan fasilitas atletik lainnya dapat menjadi lokasi potensial untuk kontaminasi dan infeksi MRSA.[31] Atlet dianggap sebagai kelompok berisiko tinggi. Sebuah penelitian menghubungkan MRSA dengan lecet yang disebabkan oleh rumput sintetis.[32] Departemen Kesehatan Negara Bagian Texas menemukan bahwa pemain sepak bola memiliki tingkat infeksi 16 kali lebih tinggi daripada rata-rata nasional dalam tiga penelitian terpisah. Pada Oktober 2006, seorang pemain sepak bola sekolah menengah lumpuh sementara karena luka bakar rumput yang terinfeksi MRSA; infeksinya kambuh pada Januari 2007, mengharuskan tiga operasi dan tiga minggu rawat inap di rumah sakit.[33]
Pada 2013, pemain Tampa Bay Buccaneers, Lawrence Tynes, Carl Nicks, dan Johnthan Banks didiagnosis menderita MRSA, dengan Tynes dan Nicks tidak tertular satu sama lain, tetapi sumber infeksi Banks masih belum diketahui.[34] Pada 2015, pemain gelandang Los Angeles Dodgers Justin Turner tertular MRSA saat mengunjungi New York Mets,[35] dan pada bulan Oktober tahun itu, pemain gelandang New York Giants Daniel Fells dirawat di rumah sakit karena infeksi MRSA yang parah.[36]
Anak-anak
MRSA semakin menjadi masalah yang signifikan pada anak-anak.[37] Penelitian telah menunjukkan bahwa 4,6% pasien di fasilitas perawatan kesehatan AS, mungkin termasuk ruang perawatan di rumah sakit,[38] terinfeksi atau terkontaminasi MRSA.[39] Baik anak-anak maupun orang dewasa yang sering mengunjungi tempat penitipan anak, taman bermain, ruang ganti, kamp, asrama, ruang kelas, dan pusat kebugaran atau fasilitas olahraga memiliki risiko lebih tinggi untuk tertular MRSA. Orang tua harus sangat waspada dengan anak-anak yang terlibat dalam kegiatan di mana peralatan olahraga digunakan bersama, seperti helm sepak bola dan seragam.[40]
Pengguna obat intravena
Penggunaan obat-obatan yang membutuhkan jarum suntik telah berkontribusi terhadap peningkatan MRSA,[41] dengan penggunaan narkoba suntik mencapai 24,1% (1.839 orang) dari Sistem Pemulangan Rumah Sakit Tennessee. Praktik penyuntikan yang tidak bersih menjadi pintu masuk bagi MRSA untuk masuk ke dalam aliran darah dan mulai menginfeksi inang. Selain itu, karena tingkat penularan MRSA yang tinggi, faktor risiko yang umum adalah melakukan kontak dekat dengan seseorang yang telah menggunakan narkoba suntik dalam satu tahun terakhir.
Mekanisme
Resistensi antimikroba memiliki dasar genetik dan difasilitasi oleh akuisisi elemen genetik ekstrakromosom yang mengandung gen yang memberikan resistensi terhadap antibiotik tertentu. Contoh elemen-elemen ini termasuk plasmid, elemen genetik yang dapat dipindahtangankan, dan pulau genom, yang dapat ditransfer di antara bakteri melalui transfer gen horizontal.[42] Ciri khas MRSA adalah kemampuannya untuk bertahan hidup dengan adanya antibiotik mirip penisilin, yang biasanya menghambat pertumbuhan bakteri dengan mencegah sintesis dinding sel. Resistensi ini disebabkan oleh gen mecA, yang mencegah antibiotik β-laktam menonaktifkan enzim (transpeptidase) yang penting untuk sintesis dinding sel.[43]
SCCmec
Staphylococcal cassette chromosome mec (SCCmec) adalah sebuah pulau genom yang tidak diketahui asalnya yang mengandung gen resistensi antibiotik mecA.[44][45] SCCmec mencakup gen tambahan di luar mecA, seperti gen sitolisin psm-mec, yang dapat mengurangi virulensi pada strain MRSA yang diakibatkan oleh HA.[46] Selain itu, lokus ini mengkodekan RNA pengatur gen yang bergantung pada strain yang dikenal sebagai psm-mecRNA.[47] SCCmec juga mengandung ccrA dan ccrB, yang keduanya mengkode rekombinanase yang memfasilitasi integrasi spesifik lokasi dan eksisi elemen SCCmec dari kromosom S. aureus.[48]
Saat ini, enam jenis SCCmec yang unik telah diidentifikasi, dengan ukuran mulai dari 21 hingga 67 kb. Mereka disebut tipe I-VI dan dibedakan berdasarkan variasi kompleks gen mec dan ccr. Karena ukuran elemen SCCmec dan keterbatasan transfer gen horizontal, setidaknya lima klon diyakini bertanggung jawab atas penyebaran infeksi MRSA, dengan kompleks klonal (CC) 8 menjadi yang paling umum.[49] SCCmec diperkirakan berasal dari spesies Staphylococcus sciuri yang berkerabat dekat dan dipindahkan secara horizontal ke S. aureus.
Genotipe SCCmec yang berbeda memberikan karakteristik mikrobiologis yang berbeda, termasuk tingkat resistensi antimikroba yang bervariasi. Selain itu, genotipe yang berbeda dikaitkan dengan jenis infeksi yang berbeda. SCCmec tipe I-III umumnya merupakan elemen besar yang sering kali mengandung gen resistensi tambahan dan biasanya ditemukan pada strain HA-MRSA. Sebaliknya, strain CA-MRSA dikaitkan dengan tipe IV dan V, yang lebih kecil dan tidak memiliki gen resistensi selain mecA.[50]
Collins dkk. menyelidiki perbedaan ini pada tahun 2001 dan menemukan bahwa perbedaan ini dapat dijelaskan oleh biaya kebugaran yang terkait dengan membawa plasmid SCCmec besar atau kecil. Membawa plasmid besar, seperti SCCmecI-III, mahal bagi bakteri, yang mengakibatkan penurunan kompensasi dalam ekspresi virulensi. Di lingkungan rumah sakit dengan peningkatan resistensi antibiotik tetapi penurunan virulensi, HA-MRSA dapat berkembang, karena menargetkan inang yang mengalami gangguan kekebalan dan dirawat di rumah sakit. Oleh karena itu, penurunan virulensi tidak bersifat maladaptif bagi HA-MRSA. Sebaliknya, CA-MRSA cenderung membawa elemen SCCmec dengan biaya kebugaran yang lebih rendah untuk mengimbangi peningkatan virulensi dan ekspresi toksisitas yang diperlukan untuk menginfeksi inang yang sehat.[51]
mecA
mecA adalah gen biomarker yang bertanggung jawab atas resistensi terhadap metisilin dan antibiotik β-laktam lainnya. Setelah memperoleh mecA, gen tersebut harus diintegrasikan dan dilokalisasi di dalam kromosom S. aureus. mecA mengkode protein pengikat penisilin 2a (PBP2a), yang berbeda dengan protein pengikat penisilin lainnya karena situs aktifnya tidak mengikat penisilin atau antibiotik β-laktam lainnya. Akibatnya, PBP2a dapat terus mengkatalisis reaksi transpeptidasi yang diperlukan untuk ikatan silang peptidoglikan, yang memungkinkan sintesis dinding sel bahkan dengan adanya antibiotik. Karena ketidakmampuan PBP2a untuk berinteraksi dengan kelompok β-laktam, akuisisi mecA memberikan resistensi terhadap semua antibiotik β-laktam, bukan hanya metisilin.[52]
Regulasi mecA melibatkan dua gen pengatur, mecI dan mecR1. mecI menekan promotor mecA, tetapi dengan adanya antibiotik β-laktam, mecR1 memulai jalur transduksi sinyal yang mengarah pada aktivasi transkripsi mecA. Hal ini dicapai melalui pembelahan MecI oleh MecR1, yang mengurangi represi. Regulasi mecA juga dikendalikan oleh dua co-repressor, blaI dan blaR1, yang masing-masing homolog dengan mecI dan mecR1, dan biasanya berfungsi sebagai pengatur blaZ, yang bertanggung jawab atas resistensi penisilin. Sekuens DNA yang diikat oleh mecI dan blaI identik, yang berarti bahwa blaI juga dapat mengikat operator mecA untuk menekan transkripsinya.[53]
Elemen seluler katabolik arginin
Elemen bergerak katabolik arginin (ACME) adalah fitur yang dapat ditemukan pada banyak strain MRSA tetapi tidak umum ditemukan pada MSSA.[54] ACME yang mengandung SpeG (enzim) dapat menangkal hipersensitivitas poliamina dari S. aureus dan membantu kolonisasi kulit yang konsisten, infeksi luka, dan penularan dari orang ke orang.[55]
Galur
Akuisisi SCCmec pada S. aureus yang peka terhadap metisilin (MSSA) mengarah pada pengembangan berbagai garis keturunan MRSA yang berbeda secara genetik. Perbedaan genetik dalam strain MRSA ini dapat menjelaskan variabilitas dalam virulensi dan infeksi MRSA yang terkait. Strain MRSA pertama, ST250 MRSA-1, dihasilkan dari integrasi SCCmec dan ST250-MSSA. Secara historis, klon MRSA utama seperti ST2470-MRSA-I, ST239-MRSA-III, ST5-MRSA-II, dan ST5-MRSA-IV bertanggung jawab atas infeksi MRSA yang didapat di rumah sakit (HA-MRSA). ST239-MRSA-III, yang juga dikenal sebagai klon Brasil, lebih mudah menular dibandingkan klon lainnya dan menyebar ke seluruh Argentina, Republik Ceko, dan Portugal.[56]
Strain MRSA yang paling sering muncul di Inggris adalah EMRSA15 dan EMRSA16,[57] dengan EMRSA16 ditemukan identik dengan strain ST36: USA200 yang ditemukan di Amerika Serikat dan membawa gen SCCmec tipe II, enterotoksin A, dan toksin sindrom syok toksik 1.[58] Strain ini telah berganti nama menjadi MRSA252 di bawah sistem pengetikan internasional yang baru. EMRSA15 juga merupakan jenis yang umum ditemukan di Asia, bersama dengan jenis lain seperti ST5: USA100 dan EMRSA1,[59] yang kesemuanya merupakan penanda genetik HA-MRSA.[60]
Strain MRSA yang didapat dari komunitas (CA-MRSA) muncul pada akhir 1990-an dan awal 2000-an, menginfeksi individu sehat yang belum pernah melakukan kontak dengan fasilitas kesehatan. CA-MRSA diyakini telah berevolusi secara independen dari strain HA-MRSA. Pengetikan molekuler dan perbandingan genom CA-MRSA dan HA-MRSA telah mengkonfirmasi hal ini.[61] Pada pertengahan 2000-an, CA-MRSA telah menyebar ke dalam lingkungan perawatan kesehatan, sehingga lebih sulit dibedakan dari HA-MRSA. CA-MRSA umumnya lebih ganas daripada HA-MRSA, dan mekanisme genetik di baliknya masih terus dipelajari. Gen Panton-Valentine leukocidin (PVL) menjadi perhatian khusus karena unik untuk CA-MRSA.
MRSA yang didapat dari komunitas (CA-MRSA) di AS terutama disebabkan oleh dua jenis: ST8: USA300 dan ST1: USA400, yang terkait dengan berbagai jenis infeksi. ST8: USA300 menyebabkan infeksi kulit, fasciitis nekrotikans, dan sindrom syok toksik, sedangkan ST1: USA400 menyebabkan pneumonia nekrotikans dan sepsis paru.[62] Strain CA-MRSA lainnya termasuk ST8: USA500 dan ST59: USA1000. Namun, di belahan dunia lain, strain yang berbeda telah mendominasi di antara strain CA-MRSA, seperti ST93 di Australia dan ST80 di benua Eropa.[63] Di Taiwan, strain ST59 telah menjadi penyebab umum infeksi kulit dan jaringan lunak di masyarakat, dan beberapa strain ini resisten terhadap banyak antibiotik non-beta-laktam. Di Alaska, USA300 jarang ditemukan dalam studi tentang strain MRSA dari wabah dan pengawasan, tidak seperti sebagian besar benua AS.[64]
MRSA yang terkait dengan ternak (LA-MRSA) terutama ditemukan pada hewan produksi yang dipelihara secara intensif seperti babi, sapi, dan unggas. Strain MRSA tertentu yang disebut CC398 umumnya dikaitkan dengan hewan-hewan ini dan dapat ditularkan ke manusia.[65][66]
Diagnosis
Laboratorium mikrobiologi diagnostik dan laboratorium rujukan memainkan peran penting dalam mengidentifikasi wabah MRSA. Biasanya, bakteri harus dibiakkan dari darah, urin, dahak, atau sampel cairan tubuh lainnya dalam jumlah yang cukup untuk melakukan tes konfirmasi sejak dini. Namun, karena tidak ada metode yang cepat dan mudah untuk mendiagnosis MRSA, pengobatan awal infeksi sering kali bergantung pada "kecurigaan yang kuat" dan teknik yang digunakan oleh dokter yang merawat. Teknik-teknik ini termasuk prosedur PCR kuantitatif, yang digunakan di laboratorium klinis untuk mendeteksi dan mengidentifikasi strain MRSA dengan cepat.[67][68]
Tes laboratorium umum lainnya adalah tes aglutinasi lateks cepat yang mendeteksi protein PBP2a. PBP2a adalah protein pengikat penisilin varian yang memungkinkan S. aureus resisten terhadap oksasilin.[69]

Mikrobiologi
Mirip dengan semua S. aureus, MRSA adalah bakteri gram positif berbentuk bola (kokus) dengan diameter sekitar 1 mikron. Bakteri ini tidak membentuk spora dan tidak bergerak. Bakteri ini sering ditemukan dalam kelompok atau rantai seperti anggur. Tidak seperti S. aureus yang rentan terhadap metisilin (MSSA), MRSA tumbuh lambat di berbagai media dan telah ditemukan dalam koloni campuran dengan MSSA. Gen mecA, yang memberikan resistensi terhadap beberapa antibiotik, selalu ada pada MRSA dan biasanya tidak ada pada MSSA. Namun, ada beberapa kasus di mana gen mecA ada di MSSA tetapi tidak diekspresikan. Uji PCR merupakan metode yang paling akurat untuk mengidentifikasi strain MRSA. Media kultur khusus telah dikembangkan untuk membedakan MSSA dan MRSA dengan lebih baik, dan dalam beberapa kasus, media ini dapat digunakan untuk mengidentifikasi strain spesifik yang resisten terhadap antibiotik yang berbeda.[70]
Terdapat beberapa strain S. aureus yang telah muncul dengan berbagai tingkat resistensi terhadap antibiotik seperti oksasilin, klindamisin, teicoplanin, dan eritromisin. Beberapa dari strain ini mungkin memiliki gen mecA, sementara yang lain tidak. Selain itu, S. aureus telah mengembangkan resistensi terhadap vankomisin, yang mengakibatkan munculnya VRSA. Satu strain, yang dikenal sebagai vancomycin-intermediate S. aureus (VISA), hanya sebagian rentan terhadap vankomisin. Strain lain, yang disebut glikopeptida-antara S. aureus (GISA), kurang rentan terhadap vankomisin dan teicoplanin. Tingkat resistensi antibiotik pada S. aureus dapat ditentukan dengan mengukur konsentrasi antibiotik yang diperlukan untuk menghambat pertumbuhan. Jika konsentrasi vankomisin yang diperlukan untuk menghambat pertumbuhan kurang dari atau sama dengan 4 μg/ml, maka strain tersebut dianggap rentan. Sebaliknya, jika konsentrasi yang lebih besar dari 32 μg/ml diperlukan untuk menghambat pertumbuhan, strain dianggap resisten.[71]
Pengobatan
Antibiotik
Penanganan infeksi MRSA yang cepat sangat penting karena penundaan dapat berakibat fatal.[72] Lokasi spesifik dan riwayat infeksi menentukan pengobatan yang tepat. Rute pemberian antibiotik dapat bervariasi, dan dapat diberikan melalui intravena, oral, atau kombinasi keduanya, tergantung pada keadaan individu dan faktor pasien.[5] Pengobatan bersamaan dengan vankomisin atau agen beta-laktam lainnya mungkin memiliki efek sinergis dan dapat dipertimbangkan.[73]
Baik MRSA yang terkait dengan komunitas (CA-MRSA) maupun MRSA yang terkait dengan layanan kesehatan (HA-MRSA) resisten terhadap antibiotik beta-laktam tradisional seperti sefaleksin. Namun, CA-MRSA memiliki kerentanan yang lebih luas terhadap agen antimikroba lain seperti obat sulfa (termasuk kotrimoksazol), tetrasiklin (seperti doksisiklin dan minosiklin), dan klindamisin (untuk osteomielitis).[5] Linezolid adalah pengobatan yang efektif untuk MRSA dan memiliki tingkat keberhasilan 87%,[74] dengan rejimen pengobatan yang bervariasi berdasarkan tingkat individu dan serum antibiotik.[75] Dibandingkan dengan vankomisin, linezolid lebih efektif dalam mengobati infeksi jaringan lunak.[76] Masyarakat Penyakit Menular Amerika merekomendasikan vankomisin, linezolid, atau klindamisin (jika rentan) untuk mengobati mereka yang menderita pneumonia MRSA.[5] Ceftaroline, sefalosporin generasi kelima, adalah antibiotik beta-laktam pertama yang disetujui di AS untuk mengobati infeksi MRSA pada kulit dan jaringan lunak atau pneumonia yang didapat dari komunitas.[77]
Antibiotik glikopeptida, seperti vankomisin dan teicoplanin, umumnya digunakan untuk mengobati infeksi MRSA.[78] Teicoplanin secara struktural mirip dengan vankomisin dan memiliki waktu paruh yang lebih lama tetapi memiliki spektrum aktivitas yang sama.[79] Karena penyerapan antibiotik ini secara oral terbatas, antibiotik ini sering kali diberikan secara intravena untuk infeksi sistemik.[80] Namun, penggunaan vankomisin dapat menjadi tantangan karena rute pemberiannya yang tidak nyaman, dan kemanjurannya terhadap MRSA umumnya lebih rendah dibandingkan dengan antibiotik beta-laktam tradisional terhadap S. aureus yang rentan terhadap metisilin (MSSA).[81][82]
Strain MRSA yang baru ditemukan telah menunjukkan resistensi bahkan terhadap vankomisin dan teicoplanin. Beberapa strain memiliki tingkat resistensi menengah, yang disebut sebagai glikopeptida-antara S. aureus (GISA) atau vankomisin-antara S. aureus (VISA),[83][84] dengan tingkat resistensi berkisar antara 4-8 μg/ml. Kasus pertama diidentifikasi di Jepang pada tahun 1996, dan sejak saat itu, strain telah ditemukan di rumah sakit di beberapa negara termasuk Inggris, Prancis, dan Amerika Serikat. Pada tahun 2002, kasus resistensi lengkap terhadap vankomisin yang terdokumentasi pertama kali, yang disebut sebagai S. aureus yang resisten terhadap vankomisin (VRSA), diidentifikasi di Amerika Serikat.[85] Namun, varian vankomisin yang berikatan dengan variasi laktat telah diuji dan menunjukkan aktivitas antimikroba yang kuat.[86]
Pada kasus yang lebih parah di mana glikopeptida tidak efektif, antibiotik lain seperti linezolid, quinupristin/dalfopristin, daptomisin, ceftaroline, dan tigecycline dapat digunakan.[87] Daptomisin direkomendasikan untuk infeksi aliran darah VISA dan endokarditis menurut pedoman saat ini.[5]
Oxazolidinon, termasuk linezolid, diperkenalkan pada tahun 1990-an dan telah menunjukkan efektivitas yang serupa dengan vankomisin terhadap MRSA. Meskipun resistensi linezolid pada S. aureus dilaporkan pada tahun 2001,[88] tingkat infeksi tetap rendah. Studi yang dilakukan di Inggris dan Irlandia antara tahun 2001 dan 2006 tidak menemukan resistensi linezolid pada stafilokokus yang dikumpulkan dari kasus bakteremia.[89]
Infeksi kulit dan jaringan lunak
Untuk abses kulit, perawatan utama yang direkomendasikan adalah pengangkatan jaringan mati, sayatan, dan drainase. Penelitian lebih lanjut diperlukan untuk menentukan efektivitas terapi antibiotik spesifik pada infeksi di lokasi pembedahan (SSI).[5] MRSA dapat menyebabkan infeksi jaringan lunak seperti bisul, impetigo, abses, dan SSI.[76] Pada luka bedah, terdapat bukti yang lemah (dengan risiko bias yang tinggi) yang menunjukkan bahwa linezolid mungkin lebih efektif daripada vankomisin dalam memberantas MRSA SSI.[1]
Kolonisasi MRSA juga dapat ditemukan pada luka non-bedah seperti luka traumatis, luka bakar, dan ulkus kronis (misalnya, ulkus diabetes, ulkus tekanan, ulkus insufisiensi arteri, dan ulkus vena). Tidak ada bukti pasti yang ditemukan mengenai rejimen antibiotik terbaik untuk mengobati kolonisasi MRSA.[74]
Anak-anak
Mupirocin topikal merupakan pengobatan yang efektif untuk infeksi kulit dan tempat infeksi sekunder. Vankomisin atau daptomisin biasanya diresepkan untuk kasus bakteremia dan endokarditis terkait MRSA. Anak-anak dengan tulang atau sendi yang terinfeksi MRSA memerlukan pengobatan jangka panjang yang disesuaikan sesuai keadaan individu. Neonatus berisiko mengalami pustulosis neonatal akibat infeksi MRSA topikal. Meskipun klindamisin bukan pengobatan yang disetujui untuk infeksi MRSA, klindamisin masih digunakan pada anak-anak untuk infeksi jaringan lunak.[5]
Endokarditis dan bakteremia
Pada kasus infeksi katup prostetik, penggantian dapat dipertimbangkan. Terapi antibiotik mungkin diperlukan hingga enam minggu, dan durasi pengobatan yang direkomendasikan biasanya empat hingga enam minggu, tergantung pada tingkat keparahan infeksi MRSA.[5]
Infeksi pernapasan
Pada pasien rawat inap dengan pneumonia CA-MRSA, pengobatan dimulai sebelum hasil kultur tersedia. Setelah kerentanan antibiotik ditentukan, infeksi dapat diobati dengan vankomisin atau linezolid hingga 21 hari. Jika pneumonia dipersulit oleh akumulasi nanah di rongga pleura yang mengelilingi paru-paru, drainase dapat dilakukan bersamaan dengan terapi antibiotik.[5] Individu dengan fibrosis sistik dapat mengalami komplikasi pernapasan akibat infeksi MRSA. Insiden MRSA pada orang dengan fibrosis kistik meningkat lima kali lipat dari tahun 2000 hingga 2015, dengan sebagian besar infeksi adalah HA-MRSA. MRSA menyumbang 26% dari infeksi paru-paru pada penderita fibrosis sistik.[90]
Tidak ada cukup bukti untuk mendukung penggunaan antibiotik topikal atau sistemik untuk infeksi MRSA hidung atau ekstra-hidung.[91]
Infeksi tulang dan sendi
Langkah awal dalam mengobati infeksi MRSA adalah membersihkan luka dan mengeringkan abses atau jaringan mati. Perawatan antibiotik tidak terstandardisasi dan disesuaikan dengan kasus masing-masing. Tergantung pada tingkat keparahan infeksi, terapi antibiotik dapat berlangsung hingga tiga bulan atau bahkan lebih lama.[5]
Implan yang terinfeksi
Infeksi MRSA dapat dikaitkan dengan implan dan penggantian sendi. Rekomendasi pengobatan didasarkan pada berapa lama implan telah terpasang. Jika implan baru saja dipasang, pengangkatan melalui pembedahan mungkin tidak diperlukan, dan terapi antibiotik dapat dilanjutkan dengan tetap menggunakan alat tersebut. Namun, jika implan telah dipasang selama lebih dari tiga minggu, pengangkatan melalui pembedahan mungkin diperlukan. Terapi antibiotik masih digunakan dalam kedua kasus tersebut, dan mungkin diperlukan untuk jangka waktu yang lama.[5]
Sistem saraf pusat
MRSA memiliki kemampuan untuk menginfeksi sistem saraf pusat, yang mengarah pada pembentukan abses otak, empiema subdural, dan abses epidural tulang belakang. Pengobatan biasanya melibatkan eksisi dan drainase, bersama dengan antibiotik. Dalam beberapa kasus, trombosis septik pada sinus vena kavernosus atau dural juga dapat terjadi sebagai komplikasi.[5]
Infeksi lainnya
Tidak ada pengobatan standar untuk infeksi MRSA di berbagai jaringan. Pendekatan untuk mengobati infeksi MRSA dapat berbeda, tergantung pada lokasi dan tingkat keparahan infeksi. Beberapa contoh infeksi terkait MRSA termasuk abses subperiosteal, pneumonia nekrosis, selulitis, piomiositis, fasciitis nekrosis, mediastinitis, abses miokard, perinefrik, hepar, dan limpa, tromboflebitis septik, serta infeksi okular yang parah seperti endoftalmitis.[5]
Hewan peliharaan dapat bertindak sebagai reservoir untuk MRSA dan dapat menularkan infeksi kepada manusia. Dalam beberapa kasus, hewan peliharaan juga dapat menunjukkan gejala dan mengembangkan infeksi MRSA. Departemen kesehatan menyarankan untuk membawa hewan peliharaan ke dokter hewan jika infeksi MRSA terus terjadi pada individu yang melakukan kontak dengan hewan peliharaan[92]
Pencegahan
Skrining
Untuk mencegah penularan MRSA di lingkungan perawatan kesehatan, disarankan untuk mengisolasi individu dengan MRSA dari mereka yang tidak terinfeksi. Kultur cepat dan pengujian sensitivitas, serta pengujian molekuler, dapat membantu mengidentifikasi pembawa dan mengurangi tingkat infeksi.[93] Pengujian ini sangat penting dalam lingkungan perawatan kesehatan karena sekitar 2% orang adalah pembawa MRSA, meskipun mereka tidak menunjukkan gejala apa pun karena bakteri tersebut mungkin berada di lubang hidung mereka.[94]
Untuk mengidentifikasi MRSA, usapan pada lubang hidung dapat dilakukan untuk mengisolasi bakteri. Selain itu, menerapkan tindakan sanitasi ekstra untuk individu yang melakukan kontak dengan orang yang terinfeksi telah terbukti efektif dalam meminimalkan penyebaran MRSA di rumah sakit di beberapa negara, termasuk Amerika Serikat, Denmark, Finlandia, dan Belanda.[95]
Cuci tangan
Pusat Pengendalian dan Pencegahan Penyakit (CDC) telah memberikan panduan tentang cara mencegah penyebaran infeksi MRSA di lingkungan masyarakat, termasuk penjara, pusat penitipan anak, dan fasilitas olahraga. Rekomendasi tersebut meliputi mencuci tangan secara rutin dan menyeluruh menggunakan sabun dan air atau pembersih berbasis alkohol, menjaga luka tetap bersih dan tertutup, menghindari kontak dengan luka orang lain, menahan diri untuk tidak berbagi barang pribadi seperti handuk atau pisau cukur, mandi setelah berolahraga di fasilitas olahraga, dan mandi sebelum menggunakan kolam renang atau kolam air panas.[96]
Isolasi
Di Amerika Serikat, pekerja dengan infeksi MRSA tidak perlu dikecualikan dari tempat kerja secara umum, kecuali mereka yang memiliki drainase luka yang tidak dapat ditutupi dan dibendung atau tidak dapat mempertahankan praktik kebersihan yang baik.[97] Individu seperti itu direkomendasikan untuk dipindahkan, dan pasien dengan drainase luka harus dimasukkan ke dalam "Kewaspadaan Kontak."[98] Pekerja dengan infeksi aktif harus dikecualikan dari kegiatan yang memungkinkan terjadinya kontak kulit ke kulit.[99] Pengusaha dianjurkan untuk menyediakan fasilitas yang memadai yang mendukung kebersihan yang baik untuk mencegah penyebaran MRSA di tempat kerja. Sanitasi permukaan dan peralatan harus sesuai dengan disinfektan yang terdaftar di Badan Perlindungan Lingkungan.[97] Di rumah sakit, isolasi kontak dapat dihentikan setelah satu hingga tiga kultur kembali negatif.[100] Sebelum pasien keluar dari isolasi, peralatan khusus perawatan pasien atau peralatan sekali pakai harus digunakan untuk pasien tersebut, atau peralatan harus didesinfeksi dengan benar sebelum digunakan pada pasien lain.[101]
Departemen kesehatan menyarankan untuk melakukan tindakan pencegahan untuk mencegah penyebaran MRSA di rumah, termasuk mencuci barang-barang yang telah bersentuhan dengan orang yang terinfeksi secara terpisah dengan larutan pemutih yang diencerkan, membersihkan dan mendisinfeksi permukaan yang sering disentuh seperti wastafel, bak mandi, meja dapur, sakelar lampu, dan gagang pintu, serta barang-barang pribadi seperti telepon genggam dan keyboard komputer.[102]
Membatasi penggunaan antibiotik
Pedoman saat ini merekomendasikan untuk mengurangi penggunaan kelas antibiotik yang mendorong kolonisasi MRSA, dengan penekanan khusus pada glikopeptida, sefalosporin, dan kuinolon. Penggunaan fluoroquinolones terutama dikaitkan dengan peningkatan risiko kolonisasi MRSA.[13][26]
Pertimbangan kesehatan masyarakat
Model matematis menunjukkan bahwa setelah keberhasilan awal dengan langkah-langkah seperti skrining dan isolasi, hilangnya pengendalian infeksi dapat terjadi seiring berjalannya waktu. Hal ini terjadi di Inggris setelah strategi "cari dan hancurkan" diterapkan di rumah sakit hingga pertengahan 1990-an. Strategi ini melibatkan isolasi semua pasien rawat inap dengan MRSA dan skrining semua staf, yang tidak diperbolehkan bekerja sampai mereka menyelesaikan terapi pemberantasan yang terbukti berhasil. Hilangnya kontrol terjadi karena pasien yang telah diisolasi dipulangkan kembali ke masyarakat dan kemudian dirawat kembali, yang menyebabkan ambang batas tercapai di mana strategi "cari dan hancurkan" menjadi kewalahan.[103] Belanda, yang telah berhasil mengendalikan MRSA, berupaya memberantas pembawa setelah pasien keluar dari rumah sakit sebagai bagian dari strategi mereka.[104]
Dekolonisasi
Pada 2013, tidak ada uji klinis acak yang dilakukan untuk menentukan cara merawat luka non-bedah yang terkolonisasi MRSA tetapi tidak terinfeksi.[74] Demikian pula, tidak ada penelitian yang memadai yang dilakukan untuk memahami cara merawat luka bedah yang terkolonisasi MRSA.[1] Efektivitas strategi yang ditujukan untuk memberantas kolonisasi MRSA di panti jompo dalam mengurangi tingkat infeksi masih belum diketahui pada 2013.[27]
Penting untuk berhati-hati saat mengeringkan bisul karena dapat menyebabkan kerusakan pada jaringan di sekitarnya yang menyebabkan komplikasi lebih lanjut.[105] Untuk mengurangi ukuran lesi, salep mupirocin 2% dapat dioleskan, dan disarankan untuk menggunakan pakaian penutup sekunder.[92] Sebuah penelitian pada hewan yang dilakukan pada tikus diabetes menunjukkan bahwa aplikasi topikal campuran pasta gula dan povidone-iodine dapat menjadi pengobatan yang efektif untuk bisul diabetes dengan infeksi MRSA.[106]
Pertanian
Organisasi Kesehatan Dunia (WHO) merekomendasikan penerapan peraturan untuk mengontrol penggunaan antibiotik dalam pakan ternak guna mencegah perkembangan strain MRSA yang kebal antibiotik.[107] MRSA telah ditemukan pada hewan dan burung.[20]
Epidemiologi
Diperkirakan sekitar 2 miliar orang di seluruh dunia membawa bakteri S. aureus, dengan hingga 53 juta di antaranya membawa MRSA (yang mewakili 2,7% pembawa).[108] Pada 2019, S. aureus diidentifikasi sebagai salah satu dari enam patogen paling signifikan yang menyebabkan kematian yang terkait dengan resistensi, dan diperkirakan 100.000 kematian yang disebabkan oleh MRSA disebabkan oleh resistensi antimikroba.[109]
HA-MRSA
Dalam sebuah penelitian yang dilakukan terhadap 1.300 anak sehat di AS, 2,4% di antaranya ditemukan membawa MRSA dalam lubang hidung mereka.[110] Sepsis bakteri adalah komplikasi yang paling umum (75%) yang terkait dengan infeksi MRSA invasif.[5] Rawat inap akibat MRSA diperkirakan mencapai 463.017 pada tahun 2009, dengan angka 11,74 per 1.000 rawat inap.[111] Meskipun banyak infeksi MRSA yang tidak serius, CDC melaporkan bahwa masih ada 80.461 infeksi MRSA invasif dan 11.285 kematian akibat MRSA setiap tahunnya.[112] Pada 2003, biaya rawat inap akibat infeksi MRSA adalah Rp 829.099.482; biaya rawat inap akibat MSSA adalah Rp 468.754.423.[76]
Infeksi setelah prosedur pembedahan relatif jarang terjadi, tetapi dapat terjadi hingga 33% dari jenis pembedahan tertentu. Insiden infeksi di tempat pembedahan bervariasi dari 1% hingga 33%. Sepsis MRSA yang terjadi dalam waktu 30 hari setelah pembedahan memiliki angka kematian 15-38%, sedangkan sepsis MRSA yang terjadi dalam waktu satu tahun memiliki angka kematian sekitar 55%. Mungkin terdapat angka kematian yang lebih tinggi terkait dengan pembedahan jantung, dengan angka 12,9% pada mereka yang terinfeksi MRSA dibandingkan dengan 3% yang terinfeksi organisme lain. Pasien dengan infeksi MRSA juga cenderung lebih lama dirawat di rumah sakit dibandingkan dengan mereka yang tidak terinfeksi.
Secara global, tingkat infeksi MRSA bersifat dinamis dan bervariasi dari tahun ke tahun.[113] Menurut laporan Program Pengawasan Antimikroba SENTRY tahun 2006, kejadian infeksi aliran darah MRSA adalah 35,9 per 100.000 hari pasien di Amerika Utara. Infeksi darah MRSA di Amerika Latin adalah 29%. Insiden di Eropa adalah 22,8%. Tingkat semua infeksi MRSA di Eropa berkisar antara 50 per 100.000 hari pasien di Portugal hingga 0,8 per 100.000 hari pasien di Swedia. Tingkat infeksi MRSA secara keseluruhan bervariasi di Amerika Latin: Kolombia dan Venezuela digabungkan memiliki 3%, Meksiko memiliki 50%, Chili 38%, Brasil 29%, dan Argentina 28%.
Pada tahun 2002, Pusat Pengendalian dan Pencegahan Penyakit (CDC) memperkirakan sekitar 1,7 juta kasus infeksi nosokomial terjadi di Amerika Serikat, yang menyebabkan 99.000 kematian. Perkiraan tingkat kejadian adalah 4,5 infeksi per 100 pasien rawat inap, dan biaya langsung bervariasi dari $10,500 (IDR 150,675,000) hingga $111,000 (IDR 1,585,250,000) per kasus, tergantung pada jenis infeksinya. Total biaya langsung infeksi nosokomial diperkirakan mencapai lebih dari 17 miliar (IDR 242,6 triliun). Sangatlah penting untuk mengurangi infeksi ini sebagai bagian dari upaya untuk meningkatkan keamanan perawatan kesehatan. MRSA ditemukan terkait dengan 8% infeksi nosokomial yang dilaporkan ke CDC National Healthcare Safety Network dari Januari 2006 hingga Oktober 2007.[114]
Menurut Kantor Audit Nasional Inggris, prevalensi infeksi yang didapat di rumah sakit di Eropa diperkirakan antara 4% dan 10% dari semua pasien yang masuk rumah sakit. Di Inggris, berbagai sumber memperkirakan sekitar 3.000 kematian per tahun disebabkan oleh MRSA sejak awal 2005.[115]
Di Amerika Serikat, sekitar 95 juta orang diyakini membawa S. aureus dalam hidung mereka. Di antara mereka, 2,5 juta orang (2,6% pembawa) membawa MRSA, strain yang resisten terhadap banyak antibiotik.[116] Sebuah tinjauan populasi yang dilakukan di tiga komunitas di Amerika Serikat menunjukkan bahwa insiden tahunan MRSA yang didapat dari komunitas (CA-MRSA) selama tahun 2001-2002 adalah antara 18 hingga 25,7 kasus per 100.000 orang. Sebagian besar kasus CA-MRSA terkait dengan infeksi yang relevan secara klinis, dan sekitar 23% pasien memerlukan rawat inap.[117]
CA-MRSA
Sebuah penelitian yang dilakukan di Amerika Serikat yang melibatkan 1.300 anak sehat menunjukkan bahwa 2,4% dari mereka membawa MRSA dalam saluran hidung mereka.[110] Ada kekhawatiran bahwa MRSA di lingkungan dapat memfasilitasi transfer resistensi ke bakteri lain melalui fag (yang merupakan virus yang menginfeksi bakteri). Asal mula MRSA dapat berasal dari berbagai sumber seperti limbah rumah sakit, limbah pertanian, atau air limbah lainnya.[5]
LA-MRSA
Kasus pertama MRSA yang diisolasi di peternakan babi Belanda dilaporkan pada tahun 2004, yang mendorong dilakukannya investigasi terhadap MRSA yang terkait dengan ternak (LA-MRSA).[118] Sejak saat itu, LA-MRSA telah ditemukan di beberapa negara di seluruh dunia, termasuk Korea, Brasil, Swiss, Malaysia, India, Inggris, Denmark, dan Tiongkok.[20]
Sejarah
Kasus MRSA yang pertama kali didokumentasikan dilaporkan dalam sebuah penelitian yang dilakukan di Inggris pada 1961, dan dari 1961 hingga 1967, wabah sesekali dilaporkan terjadi di Eropa Barat dan Australia. Metisilin kemudian dilisensikan di Inggris untuk pengobatan infeksi yang resisten. Pada 1970-an, laporan tentang MRSA mulai bermunculan dan beberapa jenis S. aureus mengembangkan resistensi terhadap antibiotik lain. Pada 1996, Jepang melaporkan resistensi vankomisin. Wabah MRSA dilaporkan ditularkan antar rumah sakit di banyak negara. Pada 1995, tingkat infeksi MRSA telah meningkat menjadi 22%, dan pada 1997, infeksi MRSA telah bertanggung jawab atas setengah dari semua infeksi S. aureus di rumah sakit.
Laporan pertama MRSA yang terkait dengan komunitas (CA-MRSA) muncul pada 1981, dengan wabah di antara pengguna narkoba suntik di Detroit, Michigan pada tahun 1982. Wabah CA-MRSA lainnya didokumentasikan pada 1980-an dan 1990-an, termasuk di antara populasi Aborigin Australia yang tidak terpapar di rumah sakit. Pada pertengahan 1990-an, kasus sporadis wabah CA-MRSA pada anak-anak di Amerika Serikat juga dilaporkan. Sementara tingkat MRSA yang terkait dengan rumah sakit stabil antara 1998 dan 2008, tingkat CA-MRSA terus meningkat. Sebuah studi yang dilakukan oleh Rumah Sakit Anak Universitas Chicago mengungkapkan peningkatan 25 kali lipat dalam rawat inap karena MRSA di antara anak-anak di AS antara periode 1993-1995 dan 1995-1997. Pada 1999, kematian pertama akibat MRSA invasif dilaporkan di antara anak-anak yang sehat di AS oleh University of Chicago. Genom dari berbagai jenis MRSA telah dideskripsikan pada 2004.
Beberapa penelitian menunjukkan bahwa angka kematian yang lebih tinggi yang diamati di antara individu yang terinfeksi MRSA mungkin tidak semata-mata disebabkan oleh kondisi kesehatan yang mendasarinya. Bahkan setelah disesuaikan dengan penyakit yang mendasari, penelitian seperti yang dilakukan oleh Blot dan rekan-rekannya telah menemukan bahwa bakteremia MRSA masih memiliki tingkat kematian yang lebih tinggi dibandingkan dengan bakteremia S. aureus yang rentan terhadap metisilin (MSSA).
Sebuah studi yang dilakukan di San Francisco selama 2004-05 menemukan bahwa hampir satu dari 300 penduduk mengalami infeksi MRSA dalam satu tahun, dengan lebih dari 85% dari infeksi ini terjadi di luar lingkungan perawatan kesehatan. Sebuah studi tahun 2004 menunjukkan bahwa infeksi S. aureus di Amerika Serikat mengakibatkan rawat inap di rumah sakit tiga kali lebih lama, tiga kali lipat total biaya, dan lima kali lipat risiko kematian di rumah sakit dibandingkan dengan orang yang tidak terinfeksi. Sebuah meta-analisis dari 31 penelitian menyimpulkan bahwa bakteremia MRSA dikaitkan dengan peningkatan angka kematian dibandingkan dengan bakteremia MSSA. Studi lain melaporkan tingkat kematian sebesar 34% dalam waktu 30 hari di antara orang yang terinfeksi MRSA, yang serupa dengan tingkat kematian 27% yang terlihat di antara orang yang terinfeksi MSSA. Meskipun beberapa penelitian menunjukkan bahwa peningkatan angka kematian mungkin disebabkan oleh morbiditas yang mendasari, beberapa penelitian, termasuk satu penelitian oleh Blot dan rekannya, yang telah disesuaikan dengan penyakit yang mendasari masih menemukan bahwa bakteremia MRSA memiliki angka kematian yang dapat diatribusikan lebih tinggi dibandingkan dengan bakteremia MSSA.
Menurut CDC, masih diperlukan lebih banyak penelitian mengenai skrining MRSA, sehingga mereka menolak untuk merekomendasikannya di AS. Namun, CDC melaporkan penurunan infeksi MRSA di lingkungan perawatan kesehatan di AS, dengan mengutip penurunan 50-70% infeksi aliran darah terkait MRSA yang dilaporkan oleh unit perawatan intensif dari tahun 2001 hingga 2007. Ada juga penurunan 34% secara keseluruhan pada infeksi aliran darah MRSA di rumah sakit dari tahun 2005 hingga 2008. Pada tahun 2010, vankomisin adalah obat yang lebih disukai untuk pengobatan MRSA.
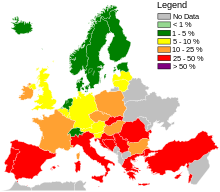
Di Eropa, tujuh negara (Islandia, Norwegia, Swedia, Belanda, Denmark, Finlandia, dan Estonia) memiliki tingkat infeksi MRSA yang didapat di rumah sakit yang lebih rendah dibandingkan negara lainnya, pada tahun 2013. Di antara negara-negara dengan tingkat yang lebih tinggi, peningkatan signifikan hanya terjadi di Bulgaria, Polandia, dan Kepulauan Britania Raya, menurut data pada tahun tersebut.
Dalam sebuah penemuan yang menarik, sebuah resep untuk salep mata dari Buku Lintah Botak abad pertengahan ditemukan memiliki aktivitas melawan MRSA dalam tes laboratorium dan pada luka kulit pada tikus. Resep tersebut berusia lebih dari 1.000 tahun dan ditemukan di salah satu buku teks medis paling awal yang diketahui, yang disimpan di British Library.
Di media
MRSA sering menjadi topik di media, terutama ketika selebriti mengumumkan bahwa mereka telah terinfeksi. Laporan wabah MRSA juga sering muncul di surat kabar dan program berita televisi. Sebagai contoh, sebuah laporan mengenai infeksi kulit dan jaringan lunak di penjara Cook County di Chicago pada tahun 2004-2005 mengungkapkan bahwa MRSA merupakan penyebab paling umum dari infeksi ini di antara para narapidana. Tuntutan hukum yang diajukan terhadap mereka yang dituduh menulari orang lain dengan MRSA juga menjadi berita populer di media.
MRSA juga telah menjadi subjek program radio, acara televisi, buku, dan film.
Riset
Penelitian telah dilakukan terhadap sifat antibakteri dari berbagai ekstrak kimia yang diperoleh dari pohon sweetgum (genus Liquidambar) untuk menyelidiki kemampuannya dalam menghambat MRSA. Ekstrak ini termasuk asam sinamat, sinamat sinamat, etil sinamat, benzil sinamat, stirena, vanilin, sinamat alkohol, 2-fenilpropil alkohol, dan 3-fenilpropil sinamat.
Berbagai upaya sedang dilakukan untuk mengembangkan kombinasi antibiotik hirup dan pemberian sistematis untuk pengobatan MRSA. Pendekatan ini diharapkan dapat meningkatkan hasil pengobatan bagi penderita fibrosis kistik dan infeksi saluran pernapasan lainnya. Terapi fag, yang telah digunakan selama bertahun-tahun di negara-negara timur untuk mengobati MRSA, juga sedang dipelajari di negara-negara barat.
Sebuah tinjauan sistematis yang dilakukan oleh Cochrane pada tahun 2015 bertujuan untuk mengevaluasi efektivitas penggunaan sarung tangan, gaun pelindung, dan masker untuk mencegah penyebaran MRSA di rumah sakit. Namun, tidak ada penelitian yang memenuhi syarat yang ditemukan untuk dimasukkan ke dalam tinjauan tersebut. Para penulis tinjauan menyimpulkan bahwa uji coba terkontrol secara acak lebih lanjut diperlukan untuk menentukan apakah penggunaan sarung tangan, gaun, dan masker dapat mengurangi penularan MRSA di rumah sakit.
Referensi
- ^ a b c d e f Gurusamy KS, Koti R, Toon CD, Wilson P, Davidson BR (August 2013). "Antibiotic therapy for the treatment of methicillin-resistant Staphylococcus aureus (MRSA) infections in surgical wounds". The Cochrane Database of Systematic Reviews (8): CD009726. doi:10.1002/14651858.CD009726.pub2. PMID 23963687.
- ^ Kourtis, Athena P.; Hatfield, Kelly; Baggs, James; Mu, Yi; See, Isaac; Epson, Erin; Nadle, Joelle; Kainer, Marion A.; Dumyati, Ghinwa (2019-03-08). "Vital Signs: Epidemiology and Recent Trends in Methicillin-Resistant and in Methicillin-Susceptible Staphylococcus aureus Bloodstream Infections — United States". MMWR. Morbidity and Mortality Weekly Report. 68 (9): 214–219. doi:10.15585/mmwr.mm6809e1. ISSN 0149-2195. PMC 6421967
 . PMID 30845118.
. PMID 30845118.
- ^ a b Schenck LP, Surette MG, Bowdish DM (November 2016). "Composition and immunological significance of the upper respiratory tract microbiota". FEBS Letters. 590 (21): 3705–3720. doi:10.1002/1873-3468.12455. PMC 7164007
 . PMID 27730630.
. PMID 27730630.
- ^ Wollina U (2017). "Microbiome in atopic dermatitis". Clinical, Cosmetic and Investigational Dermatology. 10: 51–56. doi:10.2147/CCID.S130013. PMC 5327846
 . PMID 28260936.
. PMID 28260936.
- ^ a b c d e f g h i j k l m n o Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz RJ, et al. (February 2011). "Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children". Clinical Infectious Diseases. 52 (3): e18–55. doi:10.1093/cid/ciq146
 . PMID 21208910.
. PMID 21208910.
- ^ a b c d e f g Sganga G, Tascini C, Sozio E, Carlini M, Chirletti P, Cortese F, et al. (2016). "Focus on the prophylaxis, epidemiology and therapy of methicillin-resistant Staphylococcus aureus surgical site infections and a position paper on associated risk factors: the perspective of an Italian group of surgeons". World Journal of Emergency Surgery. 11 (1): 26. doi:10.1186/s13017-016-0086-1. PMC 4908758
 . PMID 27307786.
. PMID 27307786.
- ^ a b c "General Information About MRSA in the Community". Centers for Disease Control and Prevention. 10 September 2013. Diakses tanggal 9 October 2014.
- ^ Lipsky BA, Tabak YP, Johannes RS, Vo L, Hyde L, Weigelt JA (May 2010). "Skin and soft tissue infections in hospitalised patients with diabetes: culture isolates and risk factors associated with mortality, length of stay and cost". Diabetologia. 53 (5): 914–23. doi:10.1007/s00125-010-1672-5
 . PMID 20146051.
. PMID 20146051.
- ^ Otter JA, French GL (November 2011). "Community-associated meticillin-resistant Staphylococcus aureus strains as a cause of healthcare-associated infection". The Journal of Hospital Infection. 79 (3): 189–93. doi:10.1016/j.jhin.2011.04.028. PMID 21741111.
- ^ Kluytmans‐VandenBergh, M. F. Q.; Kluytmans, J. A. J. W. (2006). "Community‐acquired methicillin‐resistant Staphylococcus aureus: current perspectives". Clinical Microbiology and Infection. 12: 9–15. doi:10.1111/j.1469-0691.2006.01341.x
 . PMID 16445719.
. PMID 16445719.
- ^ Golding GR, Quinn B, Bergstrom K, Stockdale D, Woods S, Nsungu M, et al. (January 2012). "Community-based educational intervention to limit the dissemination of community-associated methicillin-resistant Staphylococcus aureus in Northern Saskatchewan, Canada". BMC Public Health. 12 (1): 15. doi:10.1186/1471-2458-12-15. PMC 3287965
 . PMID 22225643.
. PMID 22225643.
- ^ Loewen, Kassandra; Schreiber, Yoko; Kirlew, Mike; Bocking, Natalie; Kelly, Len (July 2017). "Community-associated methicillin-resistant Staphylococcus aureus infection". Canadian Family Physician. 63 (7): 512–520. ISSN 0008-350X. PMC 5507223
 . PMID 28701438.
. PMID 28701438.
- ^ a b Tacconelli E, De Angelis G, Cataldo MA, Pozzi E, Cauda R (January 2008). "Does antibiotic exposure increase the risk of methicillin-resistant Staphylococcus aureus (MRSA) isolation? A systematic review and meta-analysis". The Journal of Antimicrobial Chemotherapy. 61 (1): 26–38. doi:10.1093/jac/dkm416
 . PMID 17986491.
. PMID 17986491.
- ^ Dumyati G, Stone ND, Nace DA, Crnich CJ, Jump RL (April 2017). "Challenges and Strategies for Prevention of Multidrug-Resistant Organism Transmission in Nursing Homes". Current Infectious Disease Reports. 19 (4): 18. doi:10.1007/s11908-017-0576-7. PMC 5382184
 . PMID 28382547.
. PMID 28382547.
- ^ "Study: Beachgoers More Likely to Catch MRSA". FoxNews.com. Reuters. 2009-02-16.
- ^ Marilynn Marchione (2009-09-12). "Dangerous staph germs found at West Coast beaches". Associated Press.
- ^ Zinderman CE, Conner B, Malakooti MA, LaMar JE, Armstrong A, Bohnker BK (May 2004). "Community-acquired methicillin-resistant Staphylococcus aureus among military recruits". Emerging Infectious Diseases. 10 (5): 941–4. doi:10.3201/eid1005.030604. PMC 3323224
 . PMID 15200838.
. PMID 15200838.
- ^ "MRSA History Timeline: The First Half-Century, 1959–2009". The University of Chicago Medical Center. 2010.
- ^ David MZ, Daum RS (July 2010). "Community-associated methicillin-resistant Staphylococcus aureus: epidemiology and clinical consequences of an emerging epidemic". Clinical Microbiology Reviews. 23 (3): 616–87. doi:10.1128/CMR.00081-09. PMC 2901661
 . PMID 20610826.
. PMID 20610826.
- ^ a b c Gopal S, Divya KC (March 2017). "Staphylococcus aureus prevalence from dairy cows in India act as potential risk for community-associated infections?: A review". Veterinary World. 10 (3): 311–318. doi:10.14202/vetworld.2017.311-318. PMC 5387658
 . PMID 28435193.
. PMID 28435193.
- ^ Ficalora, Robert (2013). Mayo Clinic internal medicine board review. Oxford: Oxford University Press. ISBN 978-0-19-994894-9.
- ^ Winn, Washington (2006). Koneman's color atlas and textbook of diagnostic microbiology. Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-3014-3.
- ^ Gurusamy KS, Koti R, Toon CD, Wilson P, Davidson BR (November 2013). Gurusamy KS, ed. "Antibiotic therapy for the treatment of methicillin-resistant Staphylococcus aureus (MRSA) in non surgical wounds". The Cochrane Database of Systematic Reviews (11): CD010427. doi:10.1002/14651858.CD010427.pub2. PMID 24242704.
- ^ Jacobs A (2014). "Hospital-acquired methicillin-resistant Staphylococcus aureus: status and trends". Radiologic Technology. 85 (6): 623–48; quiz 649–52. PMID 25002642.
- ^ Davis, Charles. "Is MRSA Contagious?". Medicinenet.com. Diakses tanggal 24 October 2017.
- ^ a b Muto CA, Jernigan JA, Ostrowsky BE, Richet HM, Jarvis WR, Boyce JM, Farr BM (May 2003). "SHEA guideline for preventing nosocomial transmission of multidrug-resistant strains of Staphylococcus aureus and enterococcus". Infection Control and Hospital Epidemiology. 24 (5): 362–86. CiteSeerX 10.1.1.575.8929
 . doi:10.1086/502213. PMID 12785411.
. doi:10.1086/502213. PMID 12785411.
- ^ a b Hughes C, Tunney M, Bradley MC (November 2013). "Infection control strategies for preventing the transmission of meticillin-resistant Staphylococcus aureus (MRSA) in nursing homes for older people". The Cochrane Database of Systematic Reviews. 2013 (11): CD006354. doi:10.1002/14651858.CD006354.pub4. PMC 7000924
 . PMID 24254890.
. PMID 24254890.
- ^ "PURE Bioscience". purebio.com. Diarsipkan dari versi asli tanggal 2009-02-24.
- ^ Mehndiratta PL, Bhalla P (September 2014). "Use of antibiotics in animal agriculture & emergence of methicillin-resistant Staphylococcus aureus (MRSA) clones: need to assess the impact on public health". The Indian Journal of Medical Research. 140 (3): 339–44. PMC 4248379
 . PMID 25366200.
. PMID 25366200.
- ^ Vitale CB, Gross TL, Weese JS (December 2006). "Methicillin-resistant Staphylococcus aureus in cat and owner". Emerging Infectious Diseases. 12 (12): 1998–2000. doi:10.3201/eid1212.060725. PMC 3291366
 . PMID 17354344. Templat:CDC
. PMID 17354344. Templat:CDC
- ^ Salgado CD, Farr BM, Calfee DP (January 2003). "Community-acquired methicillin-resistant Staphylococcus aureus: a meta-analysis of prevalence and risk factors". Clinical Infectious Diseases. 36 (2): 131–9. doi:10.1086/345436
 . PMID 12522744.
. PMID 12522744.
- ^ Kazakova SV, Hageman JC, Matava M, Srinivasan A, Phelan L, Garfinkel B, et al. (February 2005). "A clone of methicillin-resistant Staphylococcus aureus among professional football players". The New England Journal of Medicine. 352 (5): 468–75. doi:10.1056/NEJMoa042859. PMID 15689585.
- ^ Epstein, Victor (21 December 2007). "Texas Football Succumbs to Virulent Staph Infection From Turf". Bloomberg. Diakses tanggal 10 June 2010.
- ^ Yasinskas, Pat (11 October 2013). "Third Tampa Bay Buccaneers player tests positive for MRSA staph infection". ESPN. ESPN Internet Ventures. Diakses tanggal 11 October 2013.
- ^ Hernandez, Dylan (August 12, 2015). "Dodgers' Justin Turner nears return from MRSA infection". Los Angeles Times. Diakses tanggal August 13, 2015.
- ^ Rappoport, Ian (October 11, 2015). "MRSA infection leaves Giants' Daniel Fells in dire situation". NFL.com. Diakses tanggal October 12, 2015.
- ^ Gray JW (April 2004). "MRSA: the problem reaches paediatrics". Archives of Disease in Childhood. 89 (4): 297–8. doi:10.1136/adc.2003.045534. PMC 1719885
 . PMID 15033832.
. PMID 15033832.
- ^ Bratu S, Eramo A, Kopec R, Coughlin E, Ghitan M, Yost R, et al. (June 2005). "Community-associated methicillin-resistant Staphylococcus aureus in hospital nursery and maternity units". Emerging Infectious Diseases. 11 (6): 808–13. doi:10.3201/eid1106.040885. PMC 3367583
 . PMID 15963273.
. PMID 15963273.
- ^ "National Prevalence Study of Methicillin-Resistant Staphylococcus aureus (MRSA) in U.S. Healthcare Facilities". Association for Professionals in Infection Control & Epidemiology. June 25, 2007. Diarsipkan dari versi asli tanggal September 7, 2007. Diakses tanggal 2007-07-14.
- ^ "Staph Infections and MRSA in Children: Prevention, Symptoms, and Treatment". webmd.com.
- ^ Parikh, Meghana P.; Octaria, Rany; Kainer, Marion A. (2020). "Methicillin-Resistant Staphylococcus aureus Bloodstream Infections and Injection Drug Use, Tennessee, USA, 2015–2017 – Volume 26, Number 3—March 2020 – Emerging Infectious Diseases journal – CDC". Emerging Infectious Diseases (dalam bahasa Inggris). 26 (3): 446–453. doi:10.3201/eid2603.191408. PMC 7045815
 . PMID 32091385.
. PMID 32091385.
- ^ Jensen SO, Lyon BR (June 2009). "Genetics of antimicrobial resistance in Staphylococcus aureus". Future Microbiology. 4 (5): 565–82. doi:10.2217/fmb.09.30. PMID 19492967.
- ^ Chambers HF (February 2001). "Methicillin-resistant Staphylococcus aureus. Mechanisms of resistance and implications for treatment". Postgraduate Medicine. 109 (2 Suppl): 43–50. doi:10.3810/pgm.02.2001.suppl12.65 (tidak aktif 2023-04-04). PMID 19667557.
- ^ Lowy FD (May 2003). "Antimicrobial resistance: the example of Staphylococcus aureus". The Journal of Clinical Investigation. 111 (9): 1265–73. doi:10.1172/JCI18535. PMC 154455
 . PMID 12727914.
. PMID 12727914.
- ^ Pantosti A, Sanchini A, Monaco M (June 2007). "Mechanisms of antibiotic resistance in Staphylococcus aureus". Future Microbiology. 2 (3): 323–34. doi:10.2217/17460913.2.3.323. PMID 17661706.
- ^ Kaito C, Saito Y, Nagano G, Ikuo M, Omae Y, Hanada Y, et al. (February 2011). Cheung A, ed. "Transcription and translation products of the cytolysin gene psm-mec on the mobile genetic element SCCmec regulate Staphylococcus aureus virulence". PLOS Pathogens. 7 (2): e1001267. doi:10.1371/journal.ppat.1001267. PMC 3033363
 . PMID 21304931.
. PMID 21304931.
- ^ Cheung GY, Villaruz AE, Joo HS, Duong AC, Yeh AJ, Nguyen TH, et al. (July 2014). "Genome-wide analysis of the regulatory function mediated by the small regulatory psm-mec RNA of methicillin-resistant Staphylococcus aureus". International Journal of Medical Microbiology. 304 (5–6): 637–44. doi:10.1016/j.ijmm.2014.04.008. PMC 4087065
 . PMID 24877726.
. PMID 24877726.
- ^ Wu SW, de Lencastre H, Tomasz A (April 2001). "Recruitment of the mecA gene homologue of Staphylococcus sciuri into a resistance determinant and expression of the resistant phenotype in Staphylococcus aureus". Journal of Bacteriology. 183 (8): 2417–24. doi:10.1128/JB.183.8.2417-2424.2001. PMC 95156
 . PMID 11274099.
. PMID 11274099.
- ^ Enright MC, Robinson DA, Randle G, Feil EJ, Grundmann H, Spratt BG (May 2002). "The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA)". Proceedings of the National Academy of Sciences of the United States of America. 99 (11): 7687–92. Bibcode:2002PNAS...99.7687E. doi:10.1073/pnas.122108599
 . PMC 124322
. PMC 124322  . PMID 12032344.
. PMID 12032344.
- ^ Kuo SC, Chiang MC, Lee WS, Chen LY, Wu HS, Yu KW, et al. (January 2012). "Comparison of microbiological and clinical characteristics based on SCCmec typing in patients with community-onset meticillin-resistant Staphylococcus aureus (MRSA) bacteraemia" (PDF). International Journal of Antimicrobial Agents. 39 (1): 22–6. doi:10.1016/j.ijantimicag.2011.08.014. PMID 21982834.
- ^ Collins J, Rudkin J, Recker M, Pozzi C, O'Gara JP, Massey RC (April 2010). "Offsetting virulence and antibiotic resistance costs by MRSA". The ISME Journal. 4 (4): 577–84. doi:10.1038/ismej.2009.151
 . PMID 20072161.
. PMID 20072161.
- ^ Sahebnasagh R, Saderi H, Owlia P. Detection of methicillin-resistant Staphylococcus aureus strains from clinical samples in Tehran by detection of the mecA and nuc genes. The First Iranian International Congress of Medical Bacteriology; 4–7 September; Tabriz, Iran. 2011. 195 pp.
- ^ Berger-Bächi B (November 1999). "Genetic basis of methicillin resistance in Staphylococcus aureus". Cellular and Molecular Life Sciences. 56 (9–10): 764–70. doi:10.1007/s000180050023. PMID 11212336. Diarsipkan dari versi asli tanggal 2013-02-12.
- ^ Goering RV, McDougal LK, Fosheim GE, Bonnstetter KK, Wolter DJ, Tenover FC (June 2007). "Epidemiologic distribution of the arginine catabolic mobile element among selected methicillin-resistant and methicillin-susceptible Staphylococcus aureus isolates". Journal of Clinical Microbiology. 45 (6): 1981–4. doi:10.1128/JCM.00273-07. PMC 1933090
 . PMID 17409207.
. PMID 17409207.
- ^ Joshi, Gauri S.; Spontak, Jeffrey S.; Klapper, David G.; Richardson, Anthony R. (2011-09-08). "Arginine catabolic mobile element encoded speG abrogates the unique hypersensitivity of Staphylococcus aureus to exogenous polyamines". Molecular Microbiology. Wiley. 82 (1): 9–20. doi:10.1111/j.1365-2958.2011.07809.x. ISSN 0950-382X. PMC 3183340
 . PMID 21902734.
. PMID 21902734.
- ^ Gordon RJ, Lowy FD (June 2008). "Pathogenesis of methicillin-resistant Staphylococcus aureus infection". Clinical Infectious Diseases. 46 Suppl 5 (Suppl 5): S350–9. doi:10.1086/533591. PMC 2474459
 . PMID 18462090.
. PMID 18462090.
- ^ Johnson AP, Aucken HM, Cavendish S, Ganner M, Wale MC, Warner M, et al. (July 2001). "Dominance of EMRSA-15 and -16 among MRSA causing nosocomial bacteraemia in the UK: analysis of isolates from the European Antimicrobial Resistance Surveillance System (EARSS)". The Journal of Antimicrobial Chemotherapy. 48 (1): 143–4. doi:10.1093/jac/48.1.143
 . PMID 11418528.
. PMID 11418528.
- ^ Diep BA, Carleton HA, Chang RF, Sensabaugh GF, Perdreau-Remington F (June 2006). "Roles of 34 virulence genes in the evolution of hospital- and community-associated strains of methicillin-resistant Staphylococcus aureus". The Journal of Infectious Diseases. 193 (11): 1495–503. doi:10.1086/503777
 . PMID 16652276.
. PMID 16652276.
- ^ Stefani S, Chung DR, Lindsay JA, Friedrich AW, Kearns AM, Westh H, Mackenzie FM (April 2012). "Meticillin-resistant Staphylococcus aureus (MRSA): global epidemiology and harmonisation of typing methods". International Journal of Antimicrobial Agents. 39 (4): 273–82. doi:10.1016/j.ijantimicag.2011.09.030. PMID 22230333.
- ^ Calfee DP (2011). "The epidemiology, treatment, and prevention of transmission of methicillin-resistant Staphylococcus aureus". Journal of Infusion Nursing. 34 (6): 359–64. doi:10.1097/NAN.0b013e31823061d6. PMID 22101629.
- ^ Daum RS (July 2007). "Clinical practice. Skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus". The New England Journal of Medicine. 357 (4): 380–90. doi:10.1056/NEJMcp070747. PMID 17652653.
- ^ Wang R, Braughton KR, Kretschmer D, Bach TH, Queck SY, Li M, et al. (December 2007). "Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA". Nature Medicine. 13 (12): 1510–4. doi:10.1038/nm1656. PMID 17994102.
- ^ Gould IM, David MZ, Esposito S, Garau J, Lina G, Mazzei T, Peters G (February 2012). "New insights into meticillin-resistant Staphylococcus aureus (MRSA) pathogenesis, treatment and resistance". International Journal of Antimicrobial Agents. 39 (2): 96–104. doi:10.1016/j.ijantimicag.2011.09.028. PMID 22196394.
- ^ David MZ, Rudolph KM, Hennessy TW, Boyle-Vavra S, Daum RS (November 2008). "Molecular epidemiology of methicillin-resistant Staphylococcus aureus, rural southwestern Alaska". Emerging Infectious Diseases. 14 (11): 1693–9. doi:10.3201/eid1411.080381. PMC 2630737
 . PMID 18976551.
. PMID 18976551.
- ^ Panel on Biological Hazards (16 June 2009). "Joint scientific report of ECDC, EFSA and EMEA on meticillin resistant Staphylococcus aureus (MRSA) in livestock, companion animals and food". EFSA Journal. 7 (6). doi:10.2903/j.efsa.2009.301r
 .
.
- ^ Graveland H, Duim B, van Duijkeren E, Heederik D, Wagenaar JA (December 2011). "Livestock-associated methicillin-resistant Staphylococcus aureus in animals and humans". International Journal of Medical Microbiology. 301 (8): 630–4. doi:10.1016/j.ijmm.2011.09.004. hdl:1874/407042. PMID 21983338.
- ^ Francois P, Schrenzel J (2008). "Rapid Diagnosis and Typing of Staphylococcus aureus". Staphylococcus: Molecular Genetics. Caister Academic Press. ISBN 978-1-904455-29-5.
- ^ Mackay IM, ed. (2007). Real-Time PCR in Microbiology: From Diagnosis to Characterization. Caister Academic Press. ISBN 978-1-904455-18-9.
- ^ Seiken, Denka. "MRSA latex test for PBP2".
- ^ Murray, Patrick (2007). Manual of clinical microbiology. Washington, D.C: ASM Press. ISBN 978-1-55581-371-0.
- ^ Winn, Washington (2006). Koneman's color atlas and textbook of diagnostic microbiology. Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-3014-3.
- ^ Ficalora, Robert (2013). Mayo Clinic internal medicine board review. Oxford: Oxford University Press. ISBN 978-0-19-994894-9.
- ^ Winn, Washington (2006). Koneman's color atlas and textbook of diagnostic microbiology. Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-3014-3.
- ^ a b c Gurusamy KS, Koti R, Toon CD, Wilson P, Davidson BR (November 2013). Gurusamy KS, ed. "Antibiotic therapy for the treatment of methicillin-resistant Staphylococcus aureus (MRSA) in non surgical wounds". The Cochrane Database of Systematic Reviews (11): CD010427. doi:10.1002/14651858.CD010427. PMID 24242704.
- ^ Choo EJ, Chambers HF (December 2016). "Treatment of Methicillin-Resistant Staphylococcus aureus Bacteremia". Infection & Chemotherapy. 48 (4): 267–273. doi:10.3947/ic.2016.48.4.267. PMC 5204005
 . PMID 28032484.
. PMID 28032484.
- ^ a b c Yue J, Dong BR, Yang M, Chen X, Wu T, Liu GJ (January 2016). "Linezolid versus vancomycin for skin and soft tissue infections". The Cochrane Database of Systematic Reviews (1): CD008056. doi:10.1002/14651858.CD008056.pub3. PMID 26758498.
- ^ "FDA Approves Teflaro for Bacterial Infections". Food and Drug Administration.
- ^ Schentag JJ, Hyatt JM, Carr JR, Paladino JA, Birmingham MC, Zimmer GS, Cumbo TJ (May 1998). "Genesis of methicillin-resistant Staphylococcus aureus (MRSA), how treatment of MRSA infections has selected for vancomycin-resistant Enterococcus faecium, and the importance of antibiotic management and infection control". Clinical Infectious Diseases. 26 (5): 1204–14. doi:10.1086/520287
 . PMID 9597254.
. PMID 9597254.
- ^ Rybak MJ, Lerner SA, Levine DP, Albrecht LM, McNeil PL, Thompson GA, et al. (April 1991). "Teicoplanin pharmacokinetics in intravenous drug abusers being treated for bacterial endocarditis". Antimicrobial Agents and Chemotherapy. 35 (4): 696–700. doi:10.1128/AAC.35.4.696. PMC 245081
 . PMID 1829880.
. PMID 1829880.
- ^ Janknegt R (June 1997). "The treatment of staphylococcal infections with special reference to pharmacokinetic, pharmacodynamic and pharmacoeconomic considerations". Pharmacy World & Science. 19 (3): 133–41. doi:10.1023/A:1008609718457. PMID 9259029.
- ^ Chang FY, Peacock JE, Musher DM, Triplett P, MacDonald BB, Mylotte JM, et al. (September 2003). "Staphylococcus aureus bacteremia: recurrence and the impact of antibiotic treatment in a prospective multicenter study". Medicine. 82 (5): 333–9. doi:10.1097/01.md.0000091184.93122.09. PMID 14530782.
- ^ Siegman-Igra Y, Reich P, Orni-Wasserlauf R, Schwartz D, Giladi M (2005). "The role of vancomycin in the persistence or recurrence of Staphylococcus aureus bacteraemia". Scandinavian Journal of Infectious Diseases. 37 (8): 572–578. doi:10.1080/00365540510038488. PMID 16138425.
- ^ Sieradzki K, Tomasz A (April 1997). "Inhibition of cell wall turnover and autolysis by vancomycin in a highly vancomycin-resistant mutant of Staphylococcus aureus". Journal of Bacteriology. 179 (8): 2557–66. doi:10.1128/jb.179.8.2557-2566.1997. PMC 179004
 . PMID 9098053.
. PMID 9098053.
- ^ Schito GC (March 2006). "The importance of the development of antibiotic resistance in Staphylococcus aureus". Clinical Microbiology and Infection. 12 Suppl 1 (Suppl 1): 3–8. doi:10.1111/j.1469-0691.2006.01343.x
 . PMID 16445718.
. PMID 16445718.
- ^ Bozdogan B, Esel D, Whitener C, Browne FA, Appelbaum PC (November 2003). "Antibacterial susceptibility of a vancomycin-resistant Staphylococcus aureus strain isolated at the Hershey Medical Center". The Journal of Antimicrobial Chemotherapy. 52 (5): 864–8. doi:10.1093/jac/dkg457
 . PMID 14563898.
. PMID 14563898.
- ^ Xie J, Pierce JG, James RC, Okano A, Boger DL (September 2011). "A redesigned vancomycin engineered for dual D-Ala-D-ala And D-Ala-D-Lac binding exhibits potent antimicrobial activity against vancomycin-resistant bacteria". Journal of the American Chemical Society. 133 (35): 13946–9. doi:10.1021/ja207142h. PMC 3164945
 . PMID 21823662.
. PMID 21823662.
- ^ Mongkolrattanothai K, Boyle S, Kahana MD, Daum RS (October 2003). "Severe Staphylococcus aureus infections caused by clonally related community-acquired methicillin-susceptible and methicillin-resistant isolates". Clinical Infectious Diseases. 37 (8): 1050–8. doi:10.1086/378277
 . PMID 14523769.
. PMID 14523769.
- ^ Tsiodras S, Gold HS, Sakoulas G, Eliopoulos GM, Wennersten C, Venkataraman L, et al. (July 2001). "Linezolid resistance in a clinical isolate of Staphylococcus aureus". Lancet. 358 (9277): 207–8. doi:10.1016/S0140-6736(01)05410-1. PMID 11476839.
- ^ Hope R, Livermore DM, Brick G, Lillie M, Reynolds R (November 2008). "Non-susceptibility trends among staphylococci from bacteraemias in the UK and Ireland, 2001-06" (PDF). The Journal of Antimicrobial Chemotherapy. 62 Suppl 2: ii65–74. doi:10.1093/jac/dkn353. PMID 18819981.
- ^ Maselli DJ, Keyt H, Restrepo MI (May 2017). "Inhaled Antibiotic Therapy in Chronic Respiratory Diseases". International Journal of Molecular Sciences. 18 (5): 1062. doi:10.3390/ijms18051062
 . PMC 5454974
. PMC 5454974  . PMID 28509852.
. PMID 28509852.
- ^ Loeb MB, Main C, Eady A, Walker-Dilks C, et al. (Cochrane Wounds Group) (2003-10-20). "Antimicrobial drugs for treating methicillin-resistant Staphylococcus aureus colonization". The Cochrane Database of Systematic Reviews (4): CD003340. doi:10.1002/14651858.CD003340. PMID 14583969.
- ^ a b "Living With MRSA" (PDF). Group Health Cooperative/Tacoma-Pierce County Health Dept./Washington State Dept. of Health. Diakses tanggal 20 November 2011.
- ^ Tacconelli E, De Angelis G, de Waure C, Cataldo MA, La Torre G, Cauda R (September 2009). "Rapid screening tests for meticillin-resistant Staphylococcus aureus at hospital admission: systematic review and meta-analysis". The Lancet. Infectious Diseases. 9 (9): 546–54. doi:10.1016/S1473-3099(09)70150-1. PMID 19695491.
- ^ Healthcare Settings. (2019, February 28). Retrieved March 19, 2021, from https://www.cdc.gov/mrsa/healthcare/index.html
- ^ McCaughey B. "Unnecessary Deaths: The Human and Financial Costs of Hospital Infections" (PDF) (edisi ke-2nd). Diarsipkan dari versi asli (PDF) tanggal July 11, 2007. Diakses tanggal 2007-08-05.
- ^ "Personal Prevention of MRSA Skin Infections". CDC. 9 August 2010. Diakses tanggal 25 May 2017.Templat:CDC
- ^ a b "NIOSH MRSA and the Workplace". United States National Institute for Occupational Safety and Health. Diakses tanggal 2017-05-25.
- ^ Strategies to Prevent Hospital-onset Staphylococcus aureus Bloodstream Infections in Acute Care Facilities. (2019, December 16). Retrieved March 19, 2021, from https://www.cdc.gov/hai/prevent/staph-prevention-strategies.html#anchor_1565005744
- ^ CDC (1998). "Guidelines for Infection Control in Health Care Personnel, 1998". Centers for Disease Control and Prevention. Diakses tanggal December 18, 2007.
- ^ Banach DB, Bearman G, Barnden M, Hanrahan JA, Leekha S, Morgan DJ, et al. (February 2018). "Duration of Contact Precautions for Acute-Care Settings". Infection Control and Hospital Epidemiology. 39 (2): 127–144. doi:10.1017/ice.2017.245
 . PMID 29321078.
. PMID 29321078.
- ^ Strategies to Prevent Hospital-onset Staphylococcus aureus Bloodstream Infections in Acute Care Facilities. (2019, December 16). Retrieved March 19, 2021, from https://www.cdc.gov/hai/prevent/staph-prevention-strategies.html#anchor_1565005744
- ^ "Living With MRSA" (PDF). Group Health Cooperative/Tacoma-Pierce County Health Dept./Washington State Dept. of Health. Diakses tanggal 20 November 2011.
- ^ Cooper BS, Medley GF, Stone SP, Kibbler CC, Cookson BD, Roberts JA, et al. (July 2004). "Methicillin-resistant Staphylococcus aureus in hospitals and the community: stealth dynamics and control catastrophes". Proceedings of the National Academy of Sciences of the United States of America. 101 (27): 10223–8. Bibcode:2004PNAS..10110223C. doi:10.1073/pnas.0401324101
 . PMC 454191
. PMC 454191  . PMID 15220470.
. PMID 15220470.
- ^ Bootsma MC, Diekmann O, Bonten MJ (April 2006). "Controlling methicillin-resistant Staphylococcus aureus: quantifying the effects of interventions and rapid diagnostic testing". Proceedings of the National Academy of Sciences of the United States of America. 103 (14): 5620–5. Bibcode:2006PNAS..103.5620B. doi:10.1073/pnas.0510077103
 . PMC 1459403
. PMC 1459403  . PMID 16565219.
. PMID 16565219.
- ^ "MRSA (Methicillin-Resistant Staphylococcus aureus)". National Library of Medicine – PubMed Health. US National Institutes of Health. Diakses tanggal 20 November 2011.
- ^ Shi CM, Nakao H, Yamazaki M, Tsuboi R, Ogawa H (November 2007). "Mixture of sugar and povidone-iodine stimulates healing of MRSA-infected skin ulcers on db/db mice". Archives of Dermatological Research. 299 (9): 449–56. doi:10.1007/s00403-007-0776-3. PMID 17680256.
- ^ Mehndiratta PL, Bhalla P (September 2014). "Use of antibiotics in animal agriculture & emergence of methicillin-resistant Staphylococcus aureus (MRSA) clones: need to assess the impact on public health". The Indian Journal of Medical Research. 140 (3): 339–44. PMC 4248379
 . PMID 25366200.
. PMID 25366200.
- ^ "MRSA Infections". Keep Kids Healthy. Diarsipkan dari versi asli tanggal December 9, 2007.
- ^ Murray, Christopher JL; Ikuta, Kevin Shunji; Sharara, Fablina; Swetschinski, Lucien; Aguilar, Gisela Robles; Gray, Authia; Han, Chieh; Bisignano, Catherine; Rao, Puja; Wool, Eve; Johnson, Sarah C. (2022-01-19). "Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis". The Lancet (dalam bahasa English). 399 (10325): 629–655. doi:10.1016/S0140-6736(21)02724-0. ISSN 0140-6736. PMC 8841637
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 35065702 Periksa nilai|pmid=(bantuan). - ^ a b Fritz SA, Garbutt J, Elward A, Shannon W, Storch GA (June 2008). "Prevalence of and risk factors for community-acquired methicillin-resistant and methicillin-sensitive staphylococcus aureus colonization in children seen in a practice-based research network". Pediatrics. 121 (6): 1090–8. doi:10.1542/peds.2007-2104. PMID 18519477.
- ^ Klein EY, Sun L, Smith DL, Laxminarayan R (April 2013). "The changing epidemiology of methicillin-resistant Staphylococcus aureus in the United States: a national observational study". American Journal of Epidemiology. 177 (7): 666–74. doi:10.1093/aje/kws273
 . PMID 23449778.
. PMID 23449778.
- ^ "Antibiotic Resistance Threats in the United States, 2013 – Antibiotic/Antimicrobial Resistance – CDC". 2019-05-07.Templat:CDC
- ^ "ResistanceMap – Antibiotic Resistance". resistancemap.cddep.org. Center for Disease Dynamics, Economics & Policy. 2017. Diakses tanggal 27 May 2017. note: a search must be performed on the website; it is interactive and the statistics are based upon the most current information,
- ^ Hidron AI, Edwards JR, Patel J, Horan TC, Sievert DM, Pollock DA, Fridkin SK (November 2008). "NHSN annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006–2007". Infection Control and Hospital Epidemiology. 29 (11): 996–1011. doi:10.1086/591861. PMID 18947320.
- ^ Johnson AP, Pearson A, Duckworth G (September 2005). "Surveillance and epidemiology of MRSA bacteraemia in the UK". The Journal of Antimicrobial Chemotherapy. 56 (3): 455–62. doi:10.1093/jac/dki266
 . PMID 16046464.
. PMID 16046464.
- ^ Graham PL, Lin SX, Larson EL (March 2006). "A U.S. population-based survey of Staphylococcus aureus colonization". Annals of Internal Medicine. 144 (5): 318–25. doi:10.7326/0003-4819-144-5-200603070-00006. PMID 16520472.
- ^ Jernigan JA, Arnold K, Heilpern K, Kainer M, Woods C, Hughes JM (2006-05-12). "Methicillin-resistant Staphylococcus aureus as community pathogen". Symposium on Community-Associated Methicillin-resistant Staphylococcus aureus (Atlanta, Georgia, U.S.). Cited in Emerg Infect Dis. Centers for Disease Control and Prevention. Diakses tanggal 2007-01-27.
- ^ Voss, Andreas; Loeffen, Frans; Bakker, Judith; Klaassen, Corne; Wulf, Mireille (2005). "Methicillin-resistant Staphylococcus aureus in Pig Farming – Volume 11, Number 12—December 2005 – Emerging Infectious Diseases journal – CDC". Emerging Infectious Diseases (dalam bahasa Inggris). 11 (12): 1965–1966. doi:10.3201/eid1112.050428. PMC 3367632
 . PMID 16485492.
. PMID 16485492.
