Deskripsi dan Struktur Padatan: Perbedaan antara revisi
Tidak ada ringkasan suntingan |
Tidak ada ringkasan suntingan |
||
| Baris 1: | Baris 1: | ||
{{dalam perbaikan}} |
{{dalam perbaikan}} |
||
'''<big>Deskripsi dan Struktur Padatan</big>'''<br/> |
'''<big>Deskripsi dan Struktur Padatan</big>''' |
||
<br/> |
|||
Sebagian besar senyawa anorganik berada dalam bentuk padatan dan padatan dapat diklasifikasikan kembali menjadi padatan kristalin dan padatan amorf. Susunan atom atau ion dalam struktur padatan dapat direpresentasikan dalam susunan yang berbeda dari bidang datar. Bentuk atom yang biasanya dapat digunakan untuk mendeskripsikan padatan logam adalah atom netral. Hal ini karena setiap kation pada atom netral masih lengkap dikelilingi oleh elektronnya. |
|||
<br/> |
|||
=='''Sejarah Penentuan Struktur Padatan'''== |
=='''Sejarah Penentuan Struktur Padatan'''== |
||
Sebelum abad 20, para kimiawan mengalami kesulitan dalam menentukan struktur suatu senyawa. Cara yang dilakukan pada masa itu adalah dengan membandingkan senyawa yang akan ditentukan dengan senyawa yang sudah ada dimana kedua senyawa ini memiliki sifat kimia dan fisika yang identik. Namun, cara ini tidak dapat digunakan dalam menentukan struktur dari senyawa yang baru ditemukan dan tidak memiliki kemiripan dengan senyawa yang terdapat di dalam literatur.<br/> |
Sebelum abad 20, para kimiawan mengalami kesulitan dalam menentukan struktur suatu senyawa. Cara yang dilakukan pada masa itu adalah dengan membandingkan senyawa yang akan ditentukan dengan senyawa yang sudah ada dimana kedua senyawa ini memiliki sifat kimia dan fisika yang identik. Namun, cara ini tidak dapat digunakan dalam menentukan struktur dari senyawa yang baru ditemukan dan tidak memiliki kemiripan dengan senyawa yang terdapat di dalam literatur.<br/> |
||
| Baris 15: | Baris 17: | ||
Suatu kristal dapat digolongkan berdasarkan susunan partikelnya dan dapat pula berdasarkan jenis partikel penyusunnya atau interaksi yang menggabungkan partikel tersebut. |
Suatu kristal dapat digolongkan berdasarkan susunan partikelnya dan dapat pula berdasarkan jenis partikel penyusunnya atau interaksi yang menggabungkan partikel tersebut. |
||
<br/> |
<br/> |
||
[[Berkas: |
[[Berkas:Jenis kristal.jpg|center]] |
||
<br/> |
|||
| ⚫ | |||
<br/> |
<br/> |
||
| ⚫ | |||
Kristal dengan kisi yang terdiri atas atom logam yang terikat melalui ikatan logam. Atom logam merupakan atom yang memiliki energi ionisasi kecil sehingga elektron valensinya mudah lepas dan menyebabkan atom membentuk kation. Bila dua atom logam saling mendekat, maka akan terjadi tumpah tindih antara orbital-orbitalnya sehingga membentuk suatu orbital molekul. Semakin banyak atom logam yang saling berinteraksi, maka akan semakin banyak terjadi tumpang tindih orbital sehingga membentuk suatu orbital molekul baru. Terjadinya tumpang tindih orbital yang berulang-ulang menyebabkan elektron-elektron pada kulit terluar setiap atom dipengaruhi oleh atom lain sehingga dapat bergerak bebas di dalam kisi.<br/> |
Kristal dengan kisi yang terdiri atas atom logam yang terikat melalui ikatan logam. Atom logam merupakan atom yang memiliki energi ionisasi kecil sehingga elektron valensinya mudah lepas dan menyebabkan atom membentuk kation. Bila dua atom logam saling mendekat, maka akan terjadi tumpah tindih antara orbital-orbitalnya sehingga membentuk suatu orbital molekul. Semakin banyak atom logam yang saling berinteraksi, maka akan semakin banyak terjadi tumpang tindih orbital sehingga membentuk suatu orbital molekul baru. Terjadinya tumpang tindih orbital yang berulang-ulang menyebabkan elektron-elektron pada kulit terluar setiap atom dipengaruhi oleh atom lain sehingga dapat bergerak bebas di dalam kisi. |
||
<br/> |
|||
Salah satu sifat kristal logam adalah dapat ditempa. Sifat ini diperoleh dari ikatan logam yang membentuknya. Dalam ikatan logam, terjadi interaksi antara atom/ion dengan elektron bebas di sekitarnya sehingga dapat membuat logam mempertahankan strukturnya bila diberikan suatu gaya yang kuat. |
Salah satu sifat kristal logam adalah dapat ditempa. Sifat ini diperoleh dari ikatan logam yang membentuknya. Dalam ikatan logam, terjadi interaksi antara atom/ion dengan elektron bebas di sekitarnya sehingga dapat membuat logam mempertahankan strukturnya bila diberikan suatu gaya yang kuat. |
||
| Baris 36: | Baris 40: | ||
=='''Penyusunan Kristal'''== |
=='''Penyusunan Kristal'''== |
||
Pada umumnya kristal menyusun partikel-partikelnya serapat mungkin sehingga sering disebut sebagai struktur terjejal. Penyusunan yang paling sederhana adalah kubus sederhana (simple cubic packing). Setiap atom bersentuhan dengan empat atom lainnya di setiap sisi dan dua atom lain yang terletak di bawah dan di atasnya sehingga dapat dikatakan setiap atom memiliki enam atom tetangga. <br/> |
Pada umumnya kristal menyusun partikel-partikelnya serapat mungkin sehingga sering disebut sebagai struktur terjejal. Penyusunan yang paling sederhana adalah kubus sederhana (simple cubic packing). Setiap atom bersentuhan dengan empat atom lainnya di setiap sisi dan dua atom lain yang terletak di bawah dan di atasnya sehingga dapat dikatakan setiap atom memiliki enam atom tetangga. <br/> |
||
[[File:Simpel kubus.jpg|left|Penataan Kubus Sederhana.(Dari :Descriptive Inorganic Chemistry FIFTH EDITION.2010.Geoff Rayner-Canham.New York:W.H. Freeman and Company)]] |
|||
[[Berkas:Simpel kubus.jpg|left]] |
|||
<br/> |
<br/> |
||
Kubus sederhana tidaklah terlalu padat dan hanya dikenal untuk penyusunan struktur polonium dan beberapa struktur ionik. Oleh karena itu, ada alternatif penyusunan dimana lapisan kedua dari atom ditempatkan di atas lubang-lubang lapisan pertama dan lapisan ketiga ditempatkan tepat di atas lubang lapisan kedua. Cara penyusunan ini disebut kubus berpusat badan (body centered cubic).Setiap atom bersentuhan dengan empat atom di atas dan empat atom di bawahnya sehingga kubus berpusat badan memiliki delapan bilangan koordinasi. |
Kubus sederhana tidaklah terlalu padat dan hanya dikenal untuk penyusunan struktur polonium dan beberapa struktur ionik. Oleh karena itu, ada alternatif penyusunan dimana lapisan kedua dari atom ditempatkan di atas lubang-lubang lapisan pertama dan lapisan ketiga ditempatkan tepat di atas lubang lapisan kedua. Cara penyusunan ini disebut kubus berpusat badan (body centered cubic).Setiap atom bersentuhan dengan empat atom di atas dan empat atom di bawahnya sehingga kubus berpusat badan memiliki delapan bilangan koordinasi. |
||
<br/> |
<br/> |
||
[[File:Bccbcc.jpg|center|left|Penataan Body Centered Cubic.(Dari :Descriptive Inorganic Chemistry FIFTH EDITION.2010.Geoff Rayner-Canham.New York:W.H.Freeman and Company)]] |
|||
[[File:Bccbcc.jpg|center|thumb]] |
|||
<br/> |
<br/> |
||
| ⚫ | Dua kemungkinan lainnya dalam penyusunan padatan adalah berdasarkan pada penyusunan heksagonal pada setiap lapisan. Setiap atom pada susunan ini dikelilingi oleh enam atom tetangga dan lubanglubang yang terbentuk menjadi lebih dekat satu sama lainnya dibandingkan dengan susunan kubus. Ketika lapisan heksagonal kedua ditempatkan di atas lapisan pertama, sangat tidak mungkin lubang lapisan pertama dapat tertutupi secara keseluruhan, tetapi hanya setengah dari lubang tersebut yang dapat tertutupi. Jika lapisan ketiga ditempatkan di atas lubang pada lapisan kedua dengan pola susunan yang sama dengan lapisan pertama dan lapisan keempat memiliki pola yang sama dengan lapisan kedua, maka susunan ini dikenal pula dengan nama susunan abab. |
||
[[Berkas:Sukaka.jpg|center]] |
|||
<br/> |
<br/> |
||
[[File:Sukaka.jpg|centerPenataan Body Centered Cubic.(Dari :Descriptive Inorganic Chemistry FIFTH EDITION.2010.Geoff Rayner-Canham.New York:W.H.Freeman and Company)]] |
|||
| ⚫ | Dua kemungkinan lainnya dalam penyusunan padatan adalah berdasarkan pada penyusunan heksagonal pada setiap lapisan. Setiap atom pada susunan ini dikelilingi oleh enam atom tetangga dan lubanglubang yang terbentuk menjadi lebih dekat satu sama lainnya dibandingkan dengan susunan kubus. Ketika lapisan heksagonal kedua ditempatkan di atas lapisan pertama, sangat tidak mungkin lubang lapisan pertama dapat tertutupi secara keseluruhan, tetapi hanya setengah dari lubang tersebut yang dapat tertutupi. Jika lapisan ketiga ditempatkan di atas lubang pada lapisan kedua dengan pola susunan yang sama dengan lapisan pertama dan lapisan keempat memiliki pola yang sama dengan lapisan kedua, maka susunan ini dikenal pula dengan nama susunan abab. |
||
<br/> |
|||
[[Berkas:Heksagonal.jpg|right]] |
|||
[[File:Pola abab.jpg|center|Pola Penataan Heksagonal]] |
|||
<br/> |
|||
| ⚫ | Penataan heksagonal lainnya adalah menempatkan lapisan ketiga di atas lubang pada lapisan pertama dan lapisan kedua. Selanjutnya lapisan keempat mengikuti pola yang sama dengan lapisan pertama. Pola ini dikenal dengan susuna abcabc dan diaplikasikan dalam cubic closepacked (ccp) atau facecentered cubic (fcc). Kedua susunan heksagonal ini memiliki 12 bilangan koordinasi.<br/> |
||
[[File:Pola abc.jpg|center|Pola Penataan Heksagonal]] |
|||
<br/> |
<br/> |
||
| ⚫ | |||
[[Berkas:Ccpccp.jpg|left]]<br/> |
|||
=='''Aplikasi'''== |
=='''Aplikasi'''== |
||
Mengetahui struktur benda padat melalui pendekatan model-model yang ada akan memudahkan seseorang untuk memprediksi sifat-sifat dari suatu jenis benda padat, bahkan dengan memodifikasi komponen-komponen penyusun suatu zat padat sesuai dengan yang diinginkan akan menghasilkan bahah-bahan yang dapat dimanfaatkan dalam berbagai bidang kehidupan di antaranya adalah:<br/> |
Mengetahui struktur benda padat melalui pendekatan model-model yang ada akan memudahkan seseorang untuk memprediksi sifat-sifat dari suatu jenis benda padat, bahkan dengan memodifikasi komponen-komponen penyusun suatu zat padat sesuai dengan yang diinginkan akan menghasilkan bahah-bahan yang dapat dimanfaatkan dalam berbagai bidang kehidupan di antaranya adalah:<br/> |
||
| Baris 62: | Baris 68: | ||
Keramik merupakan hasil seni dan merupakan kristal, sifat keramik ditentukan oleh struktur kristalnya. Secara umum strukturnya sangat rumit dengan sedikit elektron-elektron bebas. Sedikitnya elektron-elektron bebas membuat keramik bukan termasuk konduktor, di samping itu keramik mempunyai sifat rapuh.<br/> |
Keramik merupakan hasil seni dan merupakan kristal, sifat keramik ditentukan oleh struktur kristalnya. Secara umum strukturnya sangat rumit dengan sedikit elektron-elektron bebas. Sedikitnya elektron-elektron bebas membuat keramik bukan termasuk konduktor, di samping itu keramik mempunyai sifat rapuh.<br/> |
||
Contoh |
=='''Contoh Padatan Anorganik'''== |
||
<br/> |
|||
[[File:Contoh Padatan Anorganik.jpg|center|Add caption here]] |
|||
2. Lamprophyllite <br/> |
|||
<br/> |
|||
3. Barytolamprophyllite <br/> |
|||
4. Nabalamprophyllitea <br/> |
|||
5. Orthoericssonite <br/> |
|||
6. Ericssoniteb <br/> |
|||
7. Shkatulkaliteb <br/> |
|||
8. Surkhobitec <br/> |
|||
9. Jinshajiangiteb <br/> |
|||
10. Perraultite<br/> |
|||
11. Delindeite <br/> |
|||
12. Bafertisite <br/> |
|||
13. Hejtmanite <br/> |
|||
14. Murmanited <br/> |
|||
15. Epistolited <br/> |
|||
16. Bornemanite <br/> |
|||
17. Bykovaitee <br/> |
|||
18. Vuonnemite <br/> |
|||
19. Lomonosovite <br/> |
|||
20. Syntheticf <br/> |
|||
21. Innelite <br/> |
|||
22. Yoshimuraite <br/> |
|||
23. Busseniteg <br/> |
|||
24. Quadruphite <br/> |
|||
25. Sobolevite <br/> |
|||
26. Polyphite <br/> |
|||
27. Bykovaiteb <br/> |
|||
Referensi |
Referensi |
||
<br/> |
<br/> |
||
| Baris 98: | Baris 79: | ||
<br/> |
<br/> |
||
Ferraris, Giovanni, Emil Markovicky, Stefano Merlino.2004. Crystallography of Modular Materials. Newyork: OXFORD university press. |
Ferraris, Giovanni, Emil Markovicky, Stefano Merlino.2004. Crystallography of Modular Materials. Newyork: OXFORD university press. |
||
<br/> |
|||
http://www.chem.ox.ac.uk/icl/heyes/structure_of_solids/lecture1/lec1.html |
|||
<br/> |
|||
http://www.chem-is-try.org/materi_kimia/kimia_dasar/padatan1/struktur-padatan-kristalin/ |
|||
<br/> |
|||
http://www.chem-is-try.org/materi_kimia/kimia_dasar/padatan1/berbagai-kristal/ |
|||
<br/> |
|||
http://www.chem-is-try.org/materi_kimia/kimia_dasar/struktur-material/awal-mula-penentuan-struktur/ |
|||
Revisi per 4 Desember 2011 14.38
Artikel ini sedang dalam perbaikan. Untuk menghindari konflik penyuntingan, mohon jangan melakukan penyuntingan selama pesan ini ditampilkan. Halaman ini terakhir disunting oleh Ruslan serumpun (Kontrib • Log) 4716 hari 936 menit lalu. |
Deskripsi dan Struktur Padatan
Sebagian besar senyawa anorganik berada dalam bentuk padatan dan padatan dapat diklasifikasikan kembali menjadi padatan kristalin dan padatan amorf. Susunan atom atau ion dalam struktur padatan dapat direpresentasikan dalam susunan yang berbeda dari bidang datar. Bentuk atom yang biasanya dapat digunakan untuk mendeskripsikan padatan logam adalah atom netral. Hal ini karena setiap kation pada atom netral masih lengkap dikelilingi oleh elektronnya.
Sejarah Penentuan Struktur Padatan
Sebelum abad 20, para kimiawan mengalami kesulitan dalam menentukan struktur suatu senyawa. Cara yang dilakukan pada masa itu adalah dengan membandingkan senyawa yang akan ditentukan dengan senyawa yang sudah ada dimana kedua senyawa ini memiliki sifat kimia dan fisika yang identik. Namun, cara ini tidak dapat digunakan dalam menentukan struktur dari senyawa yang baru ditemukan dan tidak memiliki kemiripan dengan senyawa yang terdapat di dalam literatur.
Salah satu metode awal yang digunakan dalam menentukan struktur senyawa adalah dengan menggunakan spektrometri sedangkan untuk senyawa yang berwujud padatan kristalin dapat digunakan metode difraksi sinar X. Metode difraksi sinar X pertama kali diperkenlakan pada awal abad ke 20 oleh William Henry Bragg (1862-1942) dan anaknya William Laurence Bragg (1890-1971). Bragg melakukan percobaan dengan menentukan struktur garam dan intan.
Proses analisis kristal dengan difraksi sinar X adalah terjadinya difraksi cahaya dalam zat yang dianalisis jika jarak antarpartikel-partikel penyusunnya teratur. Pada proses ini, panjang gelombang cahaya yang digunakan haruslah sebanding. Gelombang terdifraksi yang sefasa akan saling menguatkan sedangkan gelombang yang tidak sefasa akan saling melemahkan. Pola difraksi akan muncul bila kristal dikenai cahaya monokromatis.
Definisi Kristal
Konsep kristal adalah suatu paket yang diasumsikan sebagai bolabola keras. Kristal dapat digambarkan sebagai pola berdimensi tiga yang strukturnya berulang. Bagian terkecil dari kristal disebut sel satuan dan kumpulan dari sel satuan yang teratur membentuk suatu kisi kristal. Cabang ilmu Kimia yang mempelajari hal ini adalah kristalografi.
Suatu kristal dapat digolongkan berdasarkan susunan partikelnya dan dapat pula berdasarkan jenis partikel penyusunnya atau interaksi yang menggabungkan partikel tersebut.

- Kristal Logam
Kristal dengan kisi yang terdiri atas atom logam yang terikat melalui ikatan logam. Atom logam merupakan atom yang memiliki energi ionisasi kecil sehingga elektron valensinya mudah lepas dan menyebabkan atom membentuk kation. Bila dua atom logam saling mendekat, maka akan terjadi tumpah tindih antara orbital-orbitalnya sehingga membentuk suatu orbital molekul. Semakin banyak atom logam yang saling berinteraksi, maka akan semakin banyak terjadi tumpang tindih orbital sehingga membentuk suatu orbital molekul baru. Terjadinya tumpang tindih orbital yang berulang-ulang menyebabkan elektron-elektron pada kulit terluar setiap atom dipengaruhi oleh atom lain sehingga dapat bergerak bebas di dalam kisi.
Salah satu sifat kristal logam adalah dapat ditempa. Sifat ini diperoleh dari ikatan logam yang membentuknya. Dalam ikatan logam, terjadi interaksi antara atom/ion dengan elektron bebas di sekitarnya sehingga dapat membuat logam mempertahankan strukturnya bila diberikan suatu gaya yang kuat.
- Kristal Ionik
Kristal ionik terbentuk karena adanya gaya tarik antara ion bermuatan positif dan negatif. Umumnya, kristal ionik memiliki titik leleh tinggi dan hantaran listrik yang rendah. Contoh dari kristal ionik adalah NaCl. Kristal ionik tidak memiliki arah khusus seperti kristal kovalen sehingga pada kristal NaCl misalnya, ion natrium akan berinteraksi dengan semua ion klorida dengan intensitas interaksi yang beragam dan ion klorida akan berinteraksi dengan seluruh ion natriumnya.
- Kristal Kovalen
Atomatom penyusun kristal kovalen secara berulang terikat melalui suatu ikatan kovalen membentuk suatu kristal dengan struktur yang mirip dengan polimer atau molekul raksasa. Contoh kristal kovalen adalah intan dan silikon dioksida (SiO2) atau kuarsa. Intan memiliki sifat kekerasan yang berasal dari terbentuknya ikatan kovalen orbital atom karbon hibrida sp3.
- Kristal Molekular
Pada umumnya, kristal terbentuk dari sutau jenis ikatan kimia antara atom atau ion. Namun, pada kasus kristal molekular, kristal terbentuk tanpa bantuan ikatan, tetapi melalui interaksi lemah antara molekulnya. Salah satu contoh dari kristal molekular adalah kristal iodin.
Penyusunan Kristal
Pada umumnya kristal menyusun partikel-partikelnya serapat mungkin sehingga sering disebut sebagai struktur terjejal. Penyusunan yang paling sederhana adalah kubus sederhana (simple cubic packing). Setiap atom bersentuhan dengan empat atom lainnya di setiap sisi dan dua atom lain yang terletak di bawah dan di atasnya sehingga dapat dikatakan setiap atom memiliki enam atom tetangga.
Kubus sederhana tidaklah terlalu padat dan hanya dikenal untuk penyusunan struktur polonium dan beberapa struktur ionik. Oleh karena itu, ada alternatif penyusunan dimana lapisan kedua dari atom ditempatkan di atas lubang-lubang lapisan pertama dan lapisan ketiga ditempatkan tepat di atas lubang lapisan kedua. Cara penyusunan ini disebut kubus berpusat badan (body centered cubic).Setiap atom bersentuhan dengan empat atom di atas dan empat atom di bawahnya sehingga kubus berpusat badan memiliki delapan bilangan koordinasi.
Dua kemungkinan lainnya dalam penyusunan padatan adalah berdasarkan pada penyusunan heksagonal pada setiap lapisan. Setiap atom pada susunan ini dikelilingi oleh enam atom tetangga dan lubanglubang yang terbentuk menjadi lebih dekat satu sama lainnya dibandingkan dengan susunan kubus. Ketika lapisan heksagonal kedua ditempatkan di atas lapisan pertama, sangat tidak mungkin lubang lapisan pertama dapat tertutupi secara keseluruhan, tetapi hanya setengah dari lubang tersebut yang dapat tertutupi. Jika lapisan ketiga ditempatkan di atas lubang pada lapisan kedua dengan pola susunan yang sama dengan lapisan pertama dan lapisan keempat memiliki pola yang sama dengan lapisan kedua, maka susunan ini dikenal pula dengan nama susunan abab.
centerPenataan Body Centered Cubic.(Dari :Descriptive Inorganic Chemistry FIFTH EDITION.2010.Geoff Rayner-Canham.New York:W.H.Freeman and Company)

Penataan heksagonal lainnya adalah menempatkan lapisan ketiga di atas lubang pada lapisan pertama dan lapisan kedua. Selanjutnya lapisan keempat mengikuti pola yang sama dengan lapisan pertama. Pola ini dikenal dengan susuna abcabc dan diaplikasikan dalam cubic closepacked (ccp) atau facecentered cubic (fcc). Kedua susunan heksagonal ini memiliki 12 bilangan koordinasi.

Aplikasi
Mengetahui struktur benda padat melalui pendekatan model-model yang ada akan memudahkan seseorang untuk memprediksi sifat-sifat dari suatu jenis benda padat, bahkan dengan memodifikasi komponen-komponen penyusun suatu zat padat sesuai dengan yang diinginkan akan menghasilkan bahah-bahan yang dapat dimanfaatkan dalam berbagai bidang kehidupan di antaranya adalah:
1.Semikonduktor
Semikonduktor adalah salah satu modifikasi dari zat padat yang dimanfaatkan pada dunia elektronika, dimana bahan ini dapat berfungsi sebagai isolator pada suhu rendah dan dapat berfungsi sebagai konduktor pada suhu kamar dan ini banyak digunakan pada barang elektronik berteknologi tinggi, seperti transistor, dioda, mikroprocessor, thermistor, sel surya. Bahan yang sering digunakan untuk membuat bahan semikonduktor adalah silikon, germanium, gallium arsenide. Keistimewaan bahan ini adalah konduktivitasnya dapat dirubah-rubah dengan mengatur jumlah bahan pengotornya sesuai dengan konduktivitas yang diinginkan.
2. Alloy
Alloy adalah bahan hasil kombinasi antara dua unsur atau lebih, dimana salah satu unsurnya harus logam. Pengkombinasian dua unsur atau lebih ini bertujuan untuk memperoleh bahan yang lebih unggul sifatnya dibandingkan dengan bahan yang hanya tersusun dari satu elemen. Contohnya adalah baja, tersusun dari besi dan karbon dimana baja jauh lebih kuat dibandingkan besi. Selain itu sifat yang dimilikinyapun berbeda seperti massa jenis, daya hantar listrik, daya hantar panas dan kereaktifan.
3. Keramik
Keramik merupakan hasil seni dan merupakan kristal, sifat keramik ditentukan oleh struktur kristalnya. Secara umum strukturnya sangat rumit dengan sedikit elektron-elektron bebas. Sedikitnya elektron-elektron bebas membuat keramik bukan termasuk konduktor, di samping itu keramik mempunyai sifat rapuh.
Contoh Padatan Anorganik
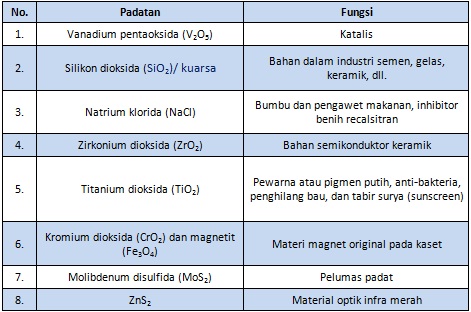
Referensi
Rayner,Geoff-Canham.2010.Descriptive Inorganic Chemistry FIFTH EDITION.New York:W.H. Freeman and Company
Shriver & Atkins’.2010.Inorganic Chemistry. Great Britain: Oxford University Press.
Ferraris, Giovanni, Emil Markovicky, Stefano Merlino.2004. Crystallography of Modular Materials. Newyork: OXFORD university press.
http://www.chem.ox.ac.uk/icl/heyes/structure_of_solids/lecture1/lec1.html
http://www.chem-is-try.org/materi_kimia/kimia_dasar/padatan1/struktur-padatan-kristalin/
http://www.chem-is-try.org/materi_kimia/kimia_dasar/padatan1/berbagai-kristal/
http://www.chem-is-try.org/materi_kimia/kimia_dasar/struktur-material/awal-mula-penentuan-struktur/
