Asam karbonat: Perbedaan antara revisi
Tampilan
Konten dihapus Konten ditambahkan
k stub |
JohnThorne (bicara | kontrib) Tidak ada ringkasan suntingan |
||
| Baris 18: | Baris 18: | ||
:CO<sub>2</sub> + H<sub>2</sub>O {{eqm}} H<sub>2</sub>CO<sub>3</sub>. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO<sub>3</sub><sup>-</sup>) dan atom [[hidrogen]]. |
:CO<sub>2</sub> + H<sub>2</sub>O {{eqm}} H<sub>2</sub>CO<sub>3</sub>. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO<sub>3</sub><sup>-</sup>) dan atom [[hidrogen]]. |
||
== |
== Referensi == |
||
{{reflist}} |
|||
== Pranala luar == |
|||
*http://www.insightempire.com/carbonic-acid/ |
*http://www.insightempire.com/carbonic-acid/ |
||
* [http://www.newton.dep.anl.gov/askasci/chem99/chem99661.htm Ask a Scientist: Carbonic Acid Decomposition] |
* [http://www.newton.dep.anl.gov/askasci/chem99/chem99661.htm Ask a Scientist: Carbonic Acid Decomposition] |
||
| Baris 24: | Baris 27: | ||
*[http://www2.iq.usp.br/docente/gutz/Curtipot_.html Carbonic acid/bicarbonate/carbonate equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet] |
*[http://www2.iq.usp.br/docente/gutz/Curtipot_.html Carbonic acid/bicarbonate/carbonate equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet] |
||
*[http://www.chem.usu.edu/~sbialkow/Classes/3600/Overheads/Carbonate/CO2.html How to calculate concentration of Carbonic Acid in Water] |
*[http://www.chem.usu.edu/~sbialkow/Classes/3600/Overheads/Carbonate/CO2.html How to calculate concentration of Carbonic Acid in Water] |
||
{{Senyawa karbonat}} |
|||
{{kimia-stub}} |
|||
[[Kategori:Asam]] |
[[Kategori:Asam]] |
||
Revisi per 5 Januari 2015 21.22

| |
| Penanda | |
|---|---|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| Sifat | |
| H2CO3 | |
| Massa molar | 62.03 g/mol |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
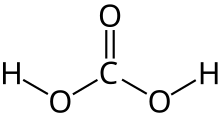
Asam karbonat adalah asam organik dengan rumus kimia H2CO3. Asam karbonat termasuk asam lemah.
Persamaan Reaksi Kimia
Ketika karbon dioksida (CO2) larut dalam air (H2O) maka akan menghasilkan asam karbonat.
- CO2 + H2O
 H2CO3. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO3-) dan atom hidrogen.
H2CO3. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO3-) dan atom hidrogen.
Referensi
Pranala luar
- http://www.insightempire.com/carbonic-acid/
- Ask a Scientist: Carbonic Acid Decomposition
- Why was the existence of carbonic acid unfairly doubted for so long?
- Carbonic acid/bicarbonate/carbonate equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet
- How to calculate concentration of Carbonic Acid in Water
