Asam karbonat: Perbedaan antara revisi
JohnThorne (bicara | kontrib) Tidak ada ringkasan suntingan |
JohnThorne (bicara | kontrib) Tambahan informasi |
||
| Baris 1: | Baris 1: | ||
{{ |
{{chembox |
||
| Watchedfields = changed |
|||
| ⚫ | |||
| verifiedrevid = 477313558 |
|||
| ImageFileL1_Ref = {{chemboximage|correct|??}} |
|||
| ImageFileL1 = Carbonic-acid-2D.svg |
|||
| ImageNameL1 = Structural formula |
|||
| ⚫ | |||
| ImageNameR1 = Ball-and-stick model |
|||
| IUPACName = Carbonic acid |
|||
| OtherNames = Carbon dioxide solution; Dihydrogen carbonate; acid of air; Aerial acid; Hydroxymethanoic acid |
|||
| Section1 = {{Chembox Identifiers |
| Section1 = {{Chembox Identifiers |
||
| KEGG_Ref = {{keggcite|correct|kegg}} |
|||
| KEGG = C01353 |
|||
| InChI = 1/CH2O3/c2-1(3)4/h(H2,2,3,4) |
|||
| InChIKey = BVKZGUZCCUSVTD-UHFFFAOYAU |
|||
| ChEMBL_Ref = {{ebicite|correct|EBI}} |
|||
| ChEMBL = 1161632 |
|||
| StdInChI_Ref = {{stdinchicite|correct|chemspider}} |
|||
| StdInChI = 1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
|||
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} |
|||
| StdInChIKey = BVKZGUZCCUSVTD-UHFFFAOYSA-N |
|||
| CASNo = 463-79-6 |
| CASNo = 463-79-6 |
||
| CASNo_Ref = {{cascite|correct|CAS}} |
|||
| PubChem = |
|||
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} |
|||
| ChemSpiderID = 747 |
| ChemSpiderID = 747 |
||
| ChEBI_Ref = {{ebicite|correct|EBI}} |
|||
| ⚫ | |||
| ChEBI = 28976 |
|||
| SMILES = O=C(O)O |
|||
| ⚫ | |||
| Section2 = {{Chembox Properties |
| Section2 = {{Chembox Properties |
||
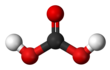
| Formula = H<sub>2</sub>CO<sub>3</sub> |
| Formula = H<sub>2</sub>CO<sub>3</sub> |
||
| MolarMass = 62.03 g/mol |
| MolarMass = 62.03 g/mol |
||
| Appearance = |
|||
| Density = 1.668 g/cm<sup>3</sup> |
|||
| Solubility = Exists only in solution |
|||
| pKa = 3.6 (p''K''<sub>a1</sub> for H<sub>2</sub>CO<sub>3</sub> only), 6.3 (p''K''<sub>a1</sub> including CO<sub>2</sub>(aq)), 10.32 (p''K''<sub>a2</sub>) |
|||
| MeltingPt = |
|||
| BoilingPt = |
|||
}} |
}} |
||
}} |
}} |
||
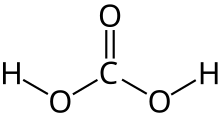
[[Berkas:Carbonic-acid-2D.svg|thumb|left|Struktur asam karbonat |
[[Berkas:Carbonic-acid-2D.svg|thumb|left|Struktur dua dimensi asam karbonat.]] |
||
'''Asam karbonat''' adalah asam organik dengan rumus kimia H<sub>2</sub>CO<sub>3</sub>. Asam karbonat termasuk asam lemah. |
'''Asam karbonat''' adalah asam organik dengan [[rumus kimia]] H<sub>2</sub>CO<sub>3</sub>. Asam karbonat termasuk asam lemah. |
||
== |
==Keseimbangan reaksi kimia== |
||
Ketika [[karbon dioksida]] (CO<sub>2</sub>) larut dalam [[air]] (H<sub>2</sub>O) maka akan menghasilkan asam karbonat. |
Ketika [[karbon dioksida]] (CO<sub>2</sub>) larut dalam [[air]] (H<sub>2</sub>O) maka akan menghasilkan asam karbonat. |
||
:CO<sub>2</sub> + H<sub>2</sub>O {{eqm}} H<sub>2</sub>CO<sub>3</sub>. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO<sub>3</sub><sup>-</sup>) dan atom [[hidrogen]]. |
:CO<sub>2</sub> + H<sub>2</sub>O {{eqm}} H<sub>2</sub>CO<sub>3</sub>. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO<sub>3</sub><sup>-</sup>) dan atom [[hidrogen]]. |
||
== Peranan asam karbonat dalam darah == |
|||
Asam karbonat merupakan langkah intermediat dalam transpor [[karbon dioksida|CO<sub>2</sub>]] ke luar dari tubuh melalui [[:en:Gas exchange|pertukaran gas secara pernapasan]]. Reaksi hidrasi CO<sub>2</sub> umumnya sangat lambat tanpa adanya katalis, tetapi [[sel darah merah]] mengandung [[:en:carbonic anhydrase|enzim karbonik anhidrase]], yang dapat meningkatkan laju reaksi serta mendisosiasi ion [[hidrogen]] (H<sup>+</sup>) dari asam karbonat yang terbentuk, menghasilkan [[bikarbonat]] (HCO<sub>3</sub><sup>−</sup>) yang larut dalam [[plasma darah]]. Reaksi yang terkatalisasi ini berbalik di [[paru-paru]], di mana bikarbonat diubah kembali menjadi CO<sub>2</sub> sehingga gas ini dapat dibuang ke luar. Keseimbangan ini berperan penting sebagai suatu [[larutan buffer|buffer]] dalam [[darah]] [[mamalia]].<ref>"excretion." Encyclopædia Britannica. Encyclopædia Britannica Ultimate Reference Suite. Chicago: Encyclopædia Britannica, 2010.</ref> |
|||
== Referensi == |
== Referensi == |
||
Revisi per 5 Januari 2015 21.32
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Carbonic acid
| |||
| Nama lain
Carbon dioxide solution; Dihydrogen carbonate; acid of air; Aerial acid; Hydroxymethanoic acid
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| H2CO3 | |||
| Massa molar | 62.03 g/mol | ||
| Densitas | 1.668 g/cm3 | ||
| Exists only in solution | |||
| Keasaman (pKa) | 3.6 (pKa1 for H2CO3 only), 6.3 (pKa1 including CO2(aq)), 10.32 (pKa2) | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Asam karbonat adalah asam organik dengan rumus kimia H2CO3. Asam karbonat termasuk asam lemah.
Keseimbangan reaksi kimia
Ketika karbon dioksida (CO2) larut dalam air (H2O) maka akan menghasilkan asam karbonat.
- CO2 + H2O
 H2CO3. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO3-) dan atom hidrogen.
H2CO3. Asam karbonat bisa berubah menjadi ion bikarbonat (HCO3-) dan atom hidrogen.
Peranan asam karbonat dalam darah
Asam karbonat merupakan langkah intermediat dalam transpor CO2 ke luar dari tubuh melalui pertukaran gas secara pernapasan. Reaksi hidrasi CO2 umumnya sangat lambat tanpa adanya katalis, tetapi sel darah merah mengandung enzim karbonik anhidrase, yang dapat meningkatkan laju reaksi serta mendisosiasi ion hidrogen (H+) dari asam karbonat yang terbentuk, menghasilkan bikarbonat (HCO3−) yang larut dalam plasma darah. Reaksi yang terkatalisasi ini berbalik di paru-paru, di mana bikarbonat diubah kembali menjadi CO2 sehingga gas ini dapat dibuang ke luar. Keseimbangan ini berperan penting sebagai suatu buffer dalam darah mamalia.[1]
Referensi
- ^ "excretion." Encyclopædia Britannica. Encyclopædia Britannica Ultimate Reference Suite. Chicago: Encyclopædia Britannica, 2010.
Pranala luar
- http://www.insightempire.com/carbonic-acid/
- Ask a Scientist: Carbonic Acid Decomposition
- Why was the existence of carbonic acid unfairly doubted for so long?
- Carbonic acid/bicarbonate/carbonate equilibrium in water: pH of solutions, buffer capacity, titration and species distribution vs. pH computed with a free spreadsheet
- How to calculate concentration of Carbonic Acid in Water