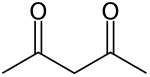
Asetilaseton
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Pentana-2,4-dion | |||
Nama lain
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Referensi Beilstein | 741937 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| Referensi Gmelin | 2537 | ||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 2310 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C5H8O2 | |||
| Massa molar | 100,12 g·mol−1 | ||
| Densitas | 0.975 g/mL[1] | ||
| Titik lebur | −23 °C (−9 °F; 250 K) | ||
| Titik didih | 140 °C (284 °F; 413 K) | ||
| 16 g/100 mL | |||
| -54.88·10−6 cm3/mol | |||
| Bahaya | |||
| Piktogram GHS |    
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H226, H302, H311, H320, H331, H335, H341, H370, H402, H412 | |||
| P201, P202, P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P281, P301+312, P302+352, P303+361+353, P304+340, P305+351+338, P307+311, P308+313, P311, P312 | |||
| Titik nyala | 34 °C (93 °F; 307 K) | ||
| 340 °C (644 °F; 613 K) | |||
| Ambang ledakan | 2.4–11.6% | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Asetilaseton adalah senyawa organik dengan rumus CH3COCH2COCH3. Senyawa ini adalah cairan tak berwarna, dikelompokkan sebagai 1,3-diketon. Senyawa ini hadir dalam kesetimbangan dengan tautomer CH3C(O)CH=C(OH)CH3. Tautomer tersebut berubah dengan cepat pada kebanyakan kondisi ketika mereka diperlakukan sebagai senyawa tunggal dalam banyak aplikasi.[2]Senyawa ini merupakan prekursor bagi anion asetilasetonat (umumnya disingkat acac−), suatu ligan bidentat. Senyawa ini juga merupakan blok pembangun bagi sintesis senyawa heterosiklik.
Sifat
Tautomerisme
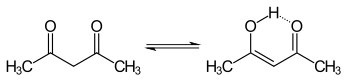
Tautomer keto dan enol dari asetilaseton hadir bersama dalam larutan. Bentuk enol memiliki simetri C2v, yang berarti atom hidrogen dibagi rata antara dua atom oksigen.[3] Dalam fasa gas, konstanta kesetimbangan, Kketo→enol, adalah 11.7, mendukung bentuk enol. Dua bentuk tautomerik dapat dibedakan dengan spektroskopi NMR, spektroskopi inframerah dan metode lainnya.[4][5]
| Pelarut | Kketo→enol |
|---|---|
| Fasa gas | 11.7 |
| Sikloheksana | 42 |
| Toluena | 10 |
| THF | 7.2 |
| DMSO | 2 |
| Air | 0.23 |
Konstanta kesetimbangan cenderung tinggi pada pelarut nonpolar; bentuk keto menjadi lebih disukai dalam pelarut ikatan hidrogen, seperti air.[6] Bentuk enol senyawa ini merupakan analog vinil dari asam karboksilat.
Sifat asam-basa
| Pelarut | T/°C | pKa[7] |
|---|---|---|
| 40% etanol/air | 30 | 9.8 |
| 70% dioksana/air | 28 | 12.5 |
| 80% DMSO/air | 25 | 10.16 |
| DMSO | 25 | 13.41 |
Asetilaseton adalah basa lemah:
- C5H8O2
 C5H7O−2 + H+
C5H7O−2 + H+
Nilai pKa yang direkomendasikan IUPAC pada kesetimbangan ini dalam larutan berair pada suhu 25 °C adalah 8.99 ± 0.04 (I = 0), 8.83 ± 0.02 (I = 0.1 M NaClO4) dan 9.00 ± 0.03 (I = 1.0 M NaClO4; I = kekuatan ionik).[8] Nilai untuk pelarut campuran tersedia. Basa yang sangat kuat, seperti senyawa organolitium, akan mendeprotonasi asetilaseton dua kali. Spesies dilitio yang dihasilkan kemudian dapat dialkilasi pada C-1.
Preparasi
Asetilaseton dibuat secara industri dengan pengaturan ulang termal dari isopropenil asetat.[9]
- CH2(CH3)COC(O)Me → MeC(O)CH2C(O)Me
Rute laboratorium untuk sintesis asetilaseton dimulai dari aseton pula. Sintesis dilakukan dengan mereaksikan aseton dan anhidrida asetat dengan penambahan katalis boron trifluorida (BF3):[10]
- (CH3CO)2O + CH3C(O)CH3 → CH3C(O)CH2C(O)CH3
Sintesis kedua melibatkan kondensasi yang dikatalisis basa aseton dan etil asetat, diikuti oleh pengasaman:[10]
- NaOEt + EtO2CCH3 + CH3C(O)CH3 → NaCH3C(O)CHC(O)CH3 + 2 EtOH
- NaCH3C(O)CHC(O)CH3 + HCl → CH3C(O)CH2C(O)CH3 + NaCl
Karena kemudahan sintesis ini, banyak analog asetilasetonat diketahui. Beberapa contoh termasuk C6H5C(O)CH2C(O)C6H5 (dbaH) dan (CH3)3CC(O)CH2C(O)CC(CH3)3. Heksafluoroasetilasetonat juga banyak digunakan untuk menghasilkan kompleks logam yang mudah menguap.
Reaksi
Kondensasi
Asetilaseton adalah prekursor bifungsional serbaguna untuk heterosiklik karena kedua gugus keto menjalani kondensasi. Hidrazin bereaksi untuk menghasilkan pirazol. Urea menghasilkan pirimidina. Kondensasi dengan dua aril dan alkilamina untuk menghasilkan NacNac, yang dalam reaksi ini atom oksigen dalam asetilaseton digantikan oleh NR (R = aril, alkil).
Kimia koordinasi
Anion asetilasetonat, acac−, membentuk kompleks dengan banyak ion logam transisi. Metode umum sintesis senyawa koordinasi ini adalah dengan mereaksikan garam logam dengan asetilaseton dengan adanya basa:[11]
- MBz + z Hacac
 M(acac)z + z BH
M(acac)z + z BH
Kedua atom oksigen mengikat logam untuk membentuk cincin kelat beranggota enam. Dalam beberapa kasus efek kelasi begitu kuat sehingga tidak diperlukan basa tambahan untuk membentuk kompleks.
Biodegradasi
Asetilaseton dapat mengalami pemecahan enzimatik: Enzim asetilaseton dioksigenase memecah ikatan karbon-karbon pada senyawa ini, menghasilkan asetat dan 2-oksopropanal. Ezim ini bergantung pada besi(II), tetapi telah terbukti berikatan pula dengan seng. Degradasi asetilaseton telah dikarakterisasi dalam bakteri Acinetobacter johnsonii.[12]
- C5H8O2 + O2 → C2H4O2 + C3H4O2
Referensi
- ^ "05581: Acetylacetone". Sigma-Aldrich.
- ^ Thomas M. Harris (2001). "2,4‐Pentanedione". e-EROS Encyclopedia of Reagents for Organic Synthesis (dalam bahasa Inggris). doi:10.1002/047084289X.rp030.
- ^ Caminati, W.; Grabow, J.-U. (2006). "The C2v Structure of Enolic Acetylacetone". J. Am. Chem. Soc. 128 (3): 854–857. doi:10.1021/ja055333g. PMID 16417375.
- ^ Manbeck, Kimberly A.; Boaz, Nicholas C.; Bair, Nathaniel C.; Sanders, Allix M. S.; Marsh, Anderson L. (2011). "Substituent Effects on Keto–Enol Equilibria Using NMR Spectroscopy". J. Chem. Educ. 88 (10): 1444–1445. doi:10.1021/ed1010932.
- ^ Yoshida, Z.; Ogoshi, H.; Tokumitsu, T. (1970). "Intramolecular hydrogen bond in enol form of 3-substituted-2,4-pentanedione". Tetrahedron. 26: 5691–5697. doi:10.1016/0040-4020(70)80005-9.
- ^ Reichardt, Christian (2003). Solvents and Solvent Effects in Organic Chemistry (dalam bahasa Inggris) (edisi ke-3rd). Wiley-VCH. ISBN 3-527-30618-8.
- ^ IUPAC SC-Database Diarsipkan 2017-06-19 di Wayback Machine. Basis data komprehensif dari data yang dipublikasikan tentang konstanta kesetimbangan kompleks dan ligan logam
- ^ Stary, J.; Liljenzin, J. O. (1982). "Critical evaluation of equilibrium constants involving acetylacetone and its metal chelates" (PDF). Pure and Applied Chemistry (dalam bahasa Inggris). 54 (12): 2557–2592. doi:10.1351/pac198254122557.
- ^ Siegel, Hardo; Eggersdorfer, Manfred (2002). "Ketones". Ullmann's Encyclopedia of Industrial Chemistry (dalam bahasa Inggris). Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_077.
- ^ a b C. E. Denoon, Jr.. "Acetylacetone". Org. Synth.; Coll. Vol. 3: 16.
- ^ O'Brien, Brian. "Co(tfa)3 & Co(acac)3 handout" (PDF). Gustavus Adolphus College.
- ^ Straganz, G.D.; Glieder, A.; Brecker, L.; Ribbons, D.W.; Steiner, W. (2003). "Acetylacetone-cleaving enzyme Dke1: a novel C–C-bond-cleaving enzyme from Acinetobacter johnsonii". Biochem. J. 369 (3): 573–581. doi:10.1042/BJ20021047. PMC 1223103
 . PMID 12379146.
. PMID 12379146.


