Malondialdehid

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
propanedial
| |||
| Nama lain
Malonic aldehyde; Malonodialdehyde; Propanedial; 1,3-Propanedial ; Malonaldehyde
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Singkatan | MDA | ||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C3H4O2 | |||
| Massa molar | 72,06 g·mol−1 | ||
| Penampilan | Needle-like solid[1] | ||
| Densitas | 0.991 g/mL | ||
| Titik lebur | 72 °C (162 °F; 345 K) | ||
| Titik didih | 108 °C (226 °F; 381 K) | ||
| Bahaya | |||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
none[1] | ||
REL (yang direkomendasikan)
|
Ca[1] | ||
IDLH (langsung berbahaya)
|
Ca [N.D.][1] | ||
| Senyawa terkait | |||
Related alkenals
|
Glucic acid 4-Hydroxynonenal | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
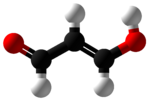
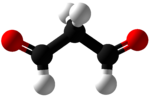
Malondialdehid (MDA) adalah senyawa organik dengan rumus CH2(CHO)2. Struktur senyawa ini lebih rumit daripada struktur kimia yang tertulis. MDA merupakan senyawa reaktif yang terbentuk secara alami dan merupakan penanda stres oksidatif.
Struktur dan sintesis
Malondialdehyde mainly exists in the enol form:[2]
- CH2(CHO)2 → HOCH=CH-CHO
Dalam pelarut organik, cis-isomer lebih disukai, sedangkan di dalam air, trans-isomer mendominasi.
Malondialdehid adalah senyawa yang sangat reaktif yang tidak biasa diamati dalam bentuk murni. Di laboratorium senyawa ini dapat dihasilkan secara in situ oleh hidrolisis 1,1,3,3-tetramethoxypropane, yang tersedia secara komersial. senyawa tersebutmudah dideprotonasi untuk menghasilkan garam natrium dari enolat (t.l. 245 °C).
Malondialdehid dihasilkan dari peroksidasi lipid asam lemak tak jenuh ganda.[3] ini adalah produk utama pada sintesis Thromboxane A2 dimana siklooksigenase 1 atau siklooksigenase2 memetabolisme asam arakidonat untuk prostaglandin H2 oleh trombosit dan berbagai macam jenis sel dan jaringan. Produk ini selanjutnya dimetabolisme oleh Thromboxane sintase untuk Thromboxane A2, 12-Hydroxyheptadecatrienoic asam, dan malondialdehid.[4][5] Atau, mungkin produk tersebut diatur ulang secara non-enzimatis menjadi campuran 8-cis dan 8-trans isomer dari 12-hydroxyeicosaheptaenoic asam ditambah malondialdehid (lihat 12-Hydroxyheptadecatrienoic asam).[6] Tingkat peroksidasi lipid dapat diperkirakan dengan jumlah malondialdehid dalam jaringan.
Biokimia
Spesies oksigen reaktif menurunkan asam lemak tak jenuh ganda, membentuk malondialdehid.[7] Senyawa Ini merupakan aldehida yang sangat reaktif dan merupakan salah satu dari banyak spesi reaktif elektrofil yang menyebabkan stres dalam sel dan membentuk ikatan kovalen dengan protein yang disebut sebagai advanced lipoxidation end-products (ALE), dalam analogi dengan advanced glycation end-products (AGE).[8] produksi aldehida ini digunakan sebagai biomarker untuk mengukur tingkat stres oksidatif dalam suatu organisme.[9][10]
Malondialdehid bereaksi dengan deoxyadenosine dan deoxyguanosine dalam DNA, membentuk DNA adduct, yang utama menjadi M1G, yang merupakan mutagenik.[11] Kelompok guanidin residu arginin mengembun dengan malondialdehid dan menghasilkan 2-aminopirimidin.
Analisis
Malondialdehid dan thiobarbituric reactive substances (TBARS) mengembun dengan dua molekul thiobarbituric acid menghasilkan senyawa turunan berwarna merah terang yang dapat diuji dengan spektrofotometer.[12] 1-Metil-2-phenylindole adalah alternatif reagenyang lebih selektif.
Bahaya dan patologi
Malondialdehid adalah senyawa reaktif dan berpotensi mutagenik.[13] Malondialdehid ditemukan minyak nabati yang dipanaskan seperti minyak bunga matahari dan minyak sawit.[14]
Kornea pasien yang menderita keratoconus dan bullous keratopathy memiliki peningkatan kadar malondialdehid, menurut penelitian.[15] MDA juga dapat ditemukan di bagian jaringan sendi dari pasien dengan osteoarthritis.[16]
Referensi
- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0377". National Institute for Occupational Safety and Health (NIOSH).
- ^ V. Nair, C. L. O'Neil, P. G. Wang "Malondialdehyde", Encyclopedia of Reagents for Organic Synthesis, 2008, John Wiley & Sons, New York. DOI:10.1002/047084289X.rm013.pub2 Article Online Posting Date: March 14, 2008
- ^ Davey MW1, Stals E, Panis B, Keulemans J, Swennen RL (2005). "High-throughput determination of malondialdehyde in plant tissues". Analytical Biochemistry. 347 (2): 201–207. doi:10.1016/j.ab.2005.09.041. PMID 16289006.
- ^ J. Biol.
- ^ Proc.
- ^ Prostaglandins Other Lipid Mediat. 1998 Jun;56(2-3):53-76
- ^ Pryor WA, Stanley JP (1975). "Letter: A suggested mechanism for the production of malondialdehyde during the autoxidation of polyunsaturated fatty acids. Nonenzymatic production of prostaglandin endoperoxides during autoxidation". J. Org. Chem. 40 (24): 3615–7. doi:10.1021/jo00912a038. PMID 1185332.
- ^ Farmer EE, Davoine C (2007). "Reactive electrophile species". Curr. Opin. Plant Biol. 10 (4): 380–6. doi:10.1016/j.pbi.2007.04.019. PMID 17646124.
- ^ Moore K, Roberts LJ (1998). "Measurement of lipid peroxidation". Free Radic. Res. 28 (6): 659–71. doi:10.3109/10715769809065821. PMID 9736317.
- ^ Del Rio D, Stewart AJ, Pellegrini N (2005). "A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress". Nutr Metab Cardiovasc Dis. 15 (4): 316–28. doi:10.1016/j.numecd.2005.05.003. PMID 16054557.
- ^ Marnett LJ (1999). "Lipid peroxidation-DNA damage by malondialdehyde". Mutat. Res. 424 (1–2): 83–95. doi:10.1016/S0027-5107(99)00010-X. PMID 10064852.
- ^ http://www.amdcc.org/shared/showFile.aspx?doctypeid=3&docid=33 Error in webarchive template: Check
|url=value. Empty. - ^ Hartman PE, Putative mutagens and carcinogens in foods.
- ^ Dourerdjou, P.; Koner, B. C. (2008), Effect of Different Cooking Vessels on Heat-Induced Lipid Peroxidation of Different Edible Oils" Journal of Food Biochemistry, 32: 740–751. DOI:10.1111/j.1745-4514.2008.00195.x
- ^ Buddi R, Lin B, Atilano SR, Zorapapel NC, Kenney MC, Brown DJ (March 2002). "Evidence of oxidative stress in human corneal diseases". J. Histochem. Cytochem. 50 (3): 341–51. doi:10.1177/002215540205000306. PMID 11850437.
- ^ Tiku ML, Narla H, Jain M, Yalamanchili P (2007). "Glucosamine prevents in vitro collagen degradation in chondrocytes by inhibiting advanced lipoxidation reactions and protein oxidation". Arthritis Research & Therapy. 9 (4): R76. doi:10.1186/ar2274. PMC 2206377
 . PMID 17686167.
. PMID 17686167.