Fluorin
| Fluorin | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Fluorin cair (pada suhu yang sangat rendah) | ||||||||||||||||||
Garis spektrum fluorin | ||||||||||||||||||
| Sifat umum | ||||||||||||||||||
| Nama, lambang | fluorin, F | |||||||||||||||||
| Pengucapan | /fluorin/[1] | |||||||||||||||||
| Alotrop | alfa, beta (lihat alotrop fluorin) | |||||||||||||||||
| Penampilan | gas: kuning sangat pucat cairan: kuning cerah padatan: alfa buram, beta transparan | |||||||||||||||||
| Fluorin dalam tabel periodik | ||||||||||||||||||
| ||||||||||||||||||
| Nomor atom (Z) | 9 | |||||||||||||||||
| Golongan | golongan 17 (halogen) | |||||||||||||||||
| Periode | periode 2 | |||||||||||||||||
| Blok | blok-p | |||||||||||||||||
| Kategori unsur | nonlogam diatomik | |||||||||||||||||
| Berat atom standar (Ar) |
| |||||||||||||||||
| Konfigurasi elektron | 1s2 2s2 2p5[2] | |||||||||||||||||
| Elektron per kelopak | 2, 7[2] | |||||||||||||||||
| Sifat fisik | ||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | gas | |||||||||||||||||
| Titik lebur | (F2) 53,48 K (−219,67 °C, −363,41 °F)[3] | |||||||||||||||||
| Titik didih | (F2) 85,03 K (−188,11 °C, −306,60 °F)[3] | |||||||||||||||||
| Kerapatan (pada STS) | 1,696[4] g/L | |||||||||||||||||
| saat cair, pada t.d. | 1,505 g/cm3[5] | |||||||||||||||||
| Titik tripel | 53,48 K, 90 kPa[3] | |||||||||||||||||
| Titik kritis | 144,41 K, 5,1724 MPa[3] | |||||||||||||||||
| Kalor peleburan | 0,51 kJ/mol[6] | |||||||||||||||||
| Kalor penguapan | 6,51 kJ/mol[7] | |||||||||||||||||
| Kapasitas kalor molar | Cp: 31 J/(mol·K)[8] (suhu 21,1 °C) Cv: 23 J/(mol·K)[8] (suhu 21,1 °C) | |||||||||||||||||
Tekanan uap
| ||||||||||||||||||
| Sifat atom | ||||||||||||||||||
| Bilangan oksidasi | −1, 0[9] (mengoksidasi oksigen) | |||||||||||||||||
| Elektronegativitas | Skala Pauling: 3,98[10] | |||||||||||||||||
| Energi ionisasi | ke-1: 1681 kJ/mol ke-2: 3374 kJ/mol ke-3: 6147 kJ/mol (artikel)[11] | |||||||||||||||||
| Jari-jari kovalen | 64 pm[12] | |||||||||||||||||
| Jari-jari van der Waals | 135 pm[13] | |||||||||||||||||
| Lain-lain | ||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||
| Struktur kristal | kubus struktur ini mengacu pada fluorin padat, pada titik didih, 1 atm[14] | |||||||||||||||||
| Konduktivitas termal | 0,02591 W/(m·K)[15] | |||||||||||||||||
| Arah magnet | diamagnetik (−1,2×10−4)[16][17] | |||||||||||||||||
| Nomor CAS | 7782-41-4[10] | |||||||||||||||||
| Sejarah | ||||||||||||||||||
| Penamaan | dari mineral fluorit, mineral itu sendiri dinamai dari Latin fluo (mengalir, dalam peleburan) | |||||||||||||||||
| Penemuan | A. Ampère (1810) | |||||||||||||||||
| Isolasi pertama | H. Moissan[10] (26 Juni 1886) | |||||||||||||||||
| Asal nama | ||||||||||||||||||
| Isotop fluorin yang utama[18] | ||||||||||||||||||
| ||||||||||||||||||
Fluor adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang F dan nomor atom 9. Namanya berasal dari bahasa Latin fluere, berarti "mengalir". Dia merupakan gas halogen univalen beracun berwarna kuning-hijau yang paling reaktif secara kimia dan elektronegatif dari seluruh unsur. Dalam bentuk murninya, dia sangat berbahaya, dapat menyebabkan pembakaran kimia parah begitu berhubungan dengan kulit. Di antara unsur-unsur, fluor berada di peringkat 24 dalam kelimpahan universal dan 13 dalam kelimpahan terestrial.Fluorit , sumber mineral utama fluor yang memberi elemen namanya, pertama kali dijelaskan pada 1529 ; seperti yang ditambahkan ke bijih logam untuk menurunkan titik leleh mereka untuk peleburan , kata kerja Latin fluo yang berarti "aliran" memberi mineral namanya. Diusulkan sebagai elemen pada tahun 1810 , fluor terbukti sulit dan berbahaya untuk terpisah dari senyawanya, dan beberapa peneliti awal meninggal atau luka yang diderita dari upaya mereka. Baru pada tahun 1886 ahli kimia Prancis Henri Moissan mengisolasi unsur fluor menggunakan elektrolisis bersuhu rendah, suatu proses yang masih digunakan untuk produksi modern. Produksi industri gas fluor untuk pengayaan uranium, aplikasi terbesarnya, dimulai selama Proyek Manhattan dalam Perang Dunia II .
Karena biaya pemurnian fluor murni, sebagian besar aplikasi komersial menggunakan senyawa fluor, dengan sekitar setengah dari fluorit yang ditambang digunakan dalam pembuatan baja. Sisa fluorit diubah menjadi fluorida hidrogen korosif dalam perjalanan ke berbagai fluorida organik, atau menjadi kriolit yang memainkan peran kunci dalam penyulingan aluminium . Fluorida organik memiliki stabilitas kimia dan termal yang sangat tinggi; penggunaan utama mereka adalah sebagai pendingin, isolasi listrik dan peralatan masak, yang terakhir sebagai PTFE (Teflon). Obat-obatan seperti atorvastatin dan fluoxetine juga mengandung fluor, dan ion fluoride menghambat gigi berlubang, dan dengan demikian menemukan penggunaan dalam pasta gigi dan fluoridasi air. Jumlah penjualan fluorochemical global mencapai lebih dari US $ 15 miliar per tahun.
Gas fluorokarbon umumnya adalah gas rumah kaca dengan potensi pemanasan global 100 hingga 20.000 kali lipat dari karbon dioksida . Senyawa organofluorin bertahan di lingkungan karena kekuatan ikatan karbon-fluorin. Fluor tidak memiliki peran metabolik yang diketahui pada mamalia ; beberapa tanaman mensintesis racun organofluorin yang menghalangi herbivora .
Karakteristik
Konfigurasi elektron
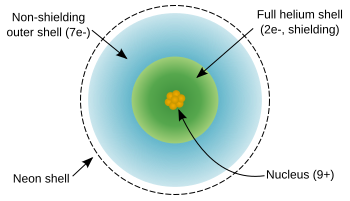
Atom fluor memiliki sembilan elektron, satu lebih sedikit daripada neon , dan konfigurasi elektron 1s22s22p5: dua elektron dalam kulit dalam yang terisi dan tujuh di kulit terluar yang membutuhkan satu lagi untuk diisi.Elektron terluar tidak efektif pada perisai nuklir , dan mengalami muatan nuklir efektif yang tinggi dari 9 - 2 = 7; ini mempengaruhi sifat fisik atom .
Energi ionisasi pertama fluor adalah ketiga tertinggi di antara semua elemen, di belakang helium dan neon, yang mempersulit pemindahan elektron dari atom fluor netral . Ia juga memiliki afinitas elektron yang tinggi, kedua setelah klor, dan cenderung menangkap elektron menjadi isoelektronik dengan neon gas mulia ; ia memiliki elektronegativitas tertinggi dari setiap elemen. Atom fluor memiliki radius kovalen kecil sekitar 60 pikometer , mirip dengan tetangganya yang memiliki oksigen dan neon.
Referensi
- ^ (Indonesia) "Fluorin". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ a b Aigueperse et al. 2005, "Fluorine", hlm. 1.
- ^ a b c d Haynes 2011, hlm. 4.121.
- ^ Aigueperse et al. 2005, "Fluorine", hlm. 2.
- ^ Jarry, Roger L.; Miller, Henry C. (1956). "The Density of Liquid Fluorine between 67 and 103°K". Journal of the American Chemical Society. 78: 1552. doi:10.1021/ja01589a012.
- ^ Dean 1999, hlm. 942.
- ^ Jaccaud et al. 2000, hlm. 382.
- ^ a b Compressed Gas Association 1999, hlm. 365.
- ^ Himmel, D.; Riedel, S. (2007). "After 20 Years, Theoretical Evidence That 'AuF7' Is Actually AuF5·F2". Inorganic Chemistry. 46 (13). 5338–5342. doi:10.1021/ic700431s.
- ^ a b c Jaccaud et al. 2000, hlm. 381.
- ^ Dean 1999, hlm. 4.6.
- ^ Dean 1999, hlm. 4.35.
- ^ Matsui 2006, hlm. 257.
- ^ Young, David A. (1975). Phase Diagrams of the Elements (Laporan). Springer. hlm. 10.
- ^ Yaws & Braker 2001, hlm. 385.
- ^ Mackay, Mackay & Henderson 2002, hlm. 72.
- ^ Cheng et al. 1999.
- ^ Chisté & Bé 2011.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||