Nogalamisin

| |
| Penanda | |
|---|---|
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C39H49NO16 | |
| Massa molar | 787.80 g/mol |
| Bahaya | |
| Bahaya utama | cardiotoxic |
| Senyawa terkait | |
Senyawa terkait
|
menogaril |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Nogalamisin adalah antibiotik antrasiklin yang diproduksi oleh bakteri tanah Streptomyces nogalater. Bakteri ini memiliki sifat antitumor tetapi juga sangat kardiotoksik. Menogaril analog semisintetik yang kurang kardiotoksik dikembangkan pada 1970-an. Namun saat ini nogalamycin dan menogaril tidak digunakan secara klinis. [1]
Biosintesis
Biosintesis antrasiklin melibatkan pembuatan inti aglikon (oleh sintase polketida tipe II) yang melekat satu atau lebih residu gula. Nogalamycin terdiri dari tiga komponen:
- nogalamycinone (hitam), inti aglikon
- nogalose (magenta)
- nogalamine (hijau)
Setiap komponen dibangun secara terpisah dan kemudian diikat bersama oleh dua glikosiltransferase.[2] Semua yang terkait dengan biosintesis nogalamycin terletak dalam kelompok gen biosintetik yang sama dari S. nogalater.
Biosintesis nogalamycinone
Jalur biosintetik menuju inti aglikon nogalamycin telah ditentukan oleh kombinasi analisis bioinformatik dan kloning komponen individu dari jalur biosintetik.[3][4][5] Rute biosintetiknya mirip dengan aklavinone (inti aglikon dari sebagian besar antrasiklin, termasuk doksorubisin), satu-satunya perbedaan adalah bahwa kelompok asil pertama yang dimasukkan ke dalam PKS adalah asetat bukan propionat. Gen-gen berikut terlibat dalam biosintesis spesies inti nogalamycinone:[3][6]
- snoa1 (ketosintase-α)
- snoa2 (ketosintase-β faktor rantai panjang)
- snoa3 (protein pembawa asil)
- snoaD (ketoreduktase)
- snoaE (aromatase)
- snoaM (siklase)
- snoaB (oksigenase)
- snoaC (metiltransferase)
- snoaL (siklase)
- snoaF (ketoreduktase)
Biosintesis nogalamin dan nogalosa
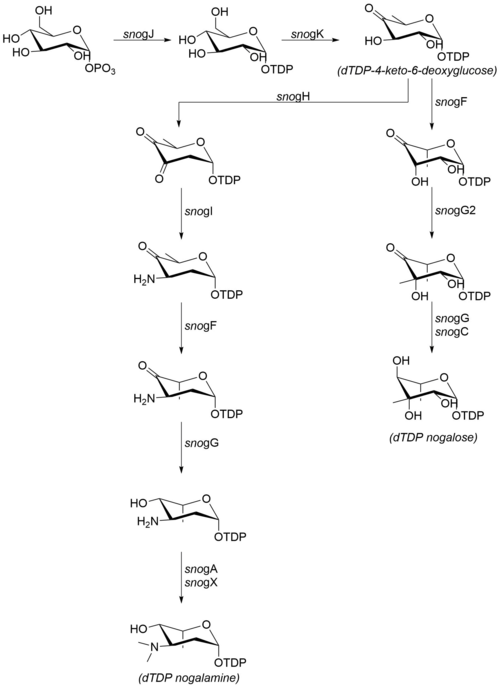
Gula gula yang melekat pada nogalamycinone diproduksi dari glukosa-1-fosfat. Meskipun langkah-langkah dari dTDP-4-keto-6-deoxyglucose belum dikonfirmasi secara in vitro, namun tingginya tingkat kesamaan urutan dengan enzim homolog dari organisme lain menunjukkan bahwa mekanisme hasil seperti yang dijelaskan di kanan.[7] Enzim berikut ini terlibat dalam biosintesis nogalamin dan nogalosa:[6]
- snogJ (dTDP-glukosela sintase)
- snogK (4,6-dehidratase)
- snogF (3,5-epimerase)
- snogH (2,3-dehidratase)
- snogN (tidak diketahui)
- snogI (aminotransferase)
- snogG (ketoreduktase)
- snogC (ketoreduktase)
- snogA (N-metiltransferase)
- snogX (N-metiltransferase)
- snogG2 (C-metiltransferase)
Perhatikan bahwa sementara banyak literatur mengacu pada bagian akhir, karbohidrat dipermetilasi sebagai "nogalose",[8] namun data yang lebih baru menunjukkan bahwa bagian nogalosa pada nogalamycin dimetilasi setelah inti nogalamycinone di glikosilasi. [2]
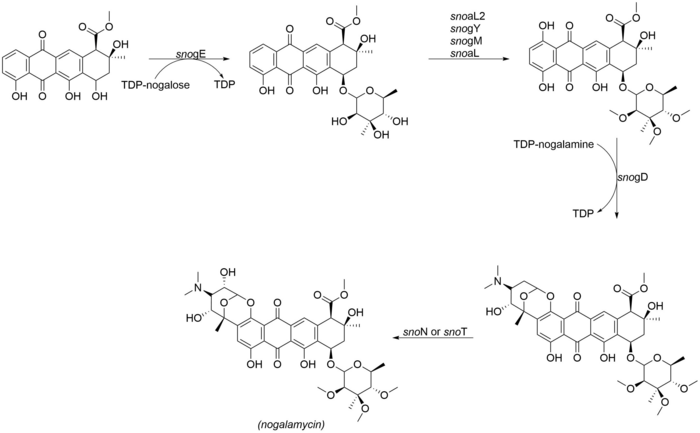
Glikosilasi dan penjahitan Nogalamycinone
Aspek yang paling penting dari struktur nogalamycin adalah perlekatan ganda nogalamine baik melalui O-glikosilasi dan juga melalui ikatan karbon-karbon pada posisi C2 dari inti nogalamycinone,[2] Enzim-enzim berikut terlibat dalam langkah-langkah penjahitan akhir dari nogalamycin:
- snogE (glikosiltransferase)
- snoaL2 (hidroksilase)
- snogY (O-metiltransferase)
- snogM (putative O-metiltransferase)
- snogL (putative O-metiltransferase)
- snogD (glikosiltransferase)
- snoN/T
Referensi
- ^ NOGALAMYCIN. ChemicalBook.com. Accessed November 28, 2012.
- ^ a b c Siitonen, V. et al. Identification of Late-Stage Glycosylation Steps in the Biosynthetic Pathway of the Anthracycline Nogalamycin. ChemBioChem 13, 120–128 (2011).
- ^ a b Torkkell, S. et al. The entire nogalamycin biosynthetic gene cluster of Streptomyces nogalater: characterization of a 20-kb DNA region and generation of hybrid structures. Mol Gen Genomics 266, 276–288 (2001).
- ^ Räty, K. et al. Cloning and characterization of Streptomyces galilaeus aclacinomycins polyketide synthase (PKS) cluster. Gene 293, 115–122 (2002).
- ^ Metsä-Ketelä, M., Palmu, K., Kunnari, T., Ylihonko, K. & Mäntsälä, P. Engineering Anthracycline Biosynthesis toward Angucyclines. Antimicrob. Agents Chemother. 47, 1291–1296 (2003).
- ^ a b Sultana, A. Mechanistic insights into the biosynthesis of polyketide antibiotics. (2006).
- ^ K. Kharel, M., Lian, H. & Rohr, J. Characterization of the TDP-d-ravidosamine biosynthetic pathway: one-pot enzymatic synthesis of TDP-d-ravidosamine from thymidine-5-phosphate and glucose-1-phosphate. Organic & Biomolecular Chemistry 9, 1799–1808 (2011).
- ^ Duchamp, D. J., Wiley, P. F., Hsiung, V. & Chidester, C. G. Structure, absolute configuration, and chemistry of nogalose. J. Org. Chem. 36, 2670–2673 (1971).