Titik tripel
Dalam termodinamika, titik tripel sebuah zat merupakan temperatur dan tekanan di mana ketiga-tiga fase (gas, cair, dan padat) zat tersebut berada dalam keadaan kesetimbangan termodinamika.[1] Sebagai contoh, titik tripel raksa terdapat pada suhu −38,8344 °C dan tekanan 0,2 mPa.
Selain titik tripel antara zat padat, cair, dan gas, terdapat pula titik-titik tripel yang melibatkan lebih dari satu fase padat untuk zat yang memiliki banyak polimorf. Helium-4 merupakan contoh kasus khusus di mana titik tripelnya melibatkan dua fase cair yang berbeda (lihat pula titik lambda). Secara umum, sebuah sistem dengan kemungkinan jumlah fase p, terdapat titik tripel.[1]
Titik tripel air digunakan untuk mendefinisikan Kelvin, satuan SI untuk temperatur termodinamika.[2] Angka yang diberikan untuk temperatur titik tripel air adalah definisi eksak dan bukanlah hasil pengukuran. Titik tripel beberapa zat digunakan sebagai titik acuan pada skala temperatur internasional ITS-90, berkisar dari titik tripel hidrogen (13,8033 K) sampai dengan titik tripel air (273,16 K).
Titik tripel air
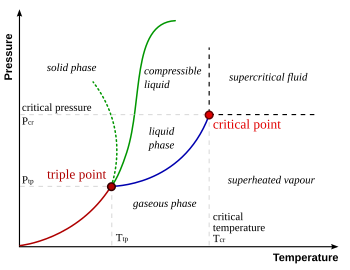
Kombinasi tunggal antara tekanan dan temperatur di mana air, es, dan uap air dapat berada bersama-sama dalam keadaan kesetimbangan yang stabil adalah tepat 273,16 K (0,01 °C) dan tekanan parsial 611,73 pascal (sekitar 6,1173 milibar, 0,0060373057 atm). Pada titik tersebut, adalah mungkin untuk mengubah semua zat menjadi es, air, atau uap air hanya dengan membuat perubahan yang cukup kecil pada tekanan dan suhu sistem. Perlu diperhatikan bahwa, bahkan jika tekanan total sistem di atas 611,73 pascal, apabila tekanan uap air tetap 611,73 pascal, kita masih dapat membuat air berada dalam titik tripel.
Air memiliki diagram fase yang tidak wajar dan kompleks, walaupun hal ini tidak mempengaruhi pembahasan titik tripelnya. Pada temperatur yang tinggi, penambahan tekanan akan menghasilkan zat cair terlebih dahulu, barulah kemudian zat padat. (Di atas 109 Pa bentuk kristal es yang terbentuk lebih padat daripada zat cair.) Pada temperatur yang rendah dan kompresi, fase cair menghilang, dan air akan langsung berubah dari gas menjadi padat.
Pada tekanan konstan di atas titik tripel, pemanasan es akan menyebabkannya berubah dari bentuk pada menjadi cair, kemudian gas (atau uap). Pada tekanan di bawah titik tripel (biasa terjadi pada luar angkasa), bentuk cair air tidak akan ada, sehingga ketika dipanaskan, es akan langsung menyublim menjadi gas.
Tabel titik tripel
Tabel di bawah ini berisi daftar titik-titik tripel untuk zat-zat yang umum.
| Zat | T (K) | P (kPa*) |
|---|---|---|
| Asetilena | 192,4 | 120 |
| Amonia | 195,40 | 6,076 |
| Argon | 83,81 | 68,9 |
| Butana | 134,6 | 7 × 10−4 |
| Karbon (grafit) | 3900 | 10100 |
| Karbon dioksida | 216,55 | 517 |
| Karbon monoksida | 68,10 | 15,37 |
| Kloroform | 175,43 | 0,870 |
| Deuterium | 18,63 | 17,1 |
| Etana | 89,89 | 8 × 10−4 |
| Etanol | 150 | 4,3 × 10−7 |
| Etilena | 104,0 | 0,12 |
| Asam format | 281,40 | 2,2 |
| Helium-4 (titik lambda) | 2,19 | 5,1 |
| Heksafluoroetana | 173,08 | 26,60 |
| Hidrogen | 13,84 | 7,04 |
| Hidrogen klorida | 158,96 | 13,9 |
| Iodin[3] | 386,65 | 12,07 |
| Isobutana | 113,55 | 1,9481 × 10−5 |
| Raksa | 234,2 | 1,65 × 10−7 |
| Metana | 90,68 | 11,7 |
| Neon | 24,57 | 43,2 |
| Nitrogen monoksida | 109,50 | 21,92 |
| Nitrogen | 63,18 | 12,6 |
| Dinitrogen oksida | 182,34 | 87,85 |
| Oksigen | 54,36 | 0,152 |
| Paladium | 1825 | 3,5 × 10−3 |
| Platinum | 2045 | 2,0 × 10−4 |
| Sulfur dioksida | 197,69 | 1,67 |
| Titanium | 1941 | 5,3 × 10−3 |
| Uranium heksafluorida | 337,17 | 151,7 |
| Air | 273,16 | 0,61 |
| Xenon | 161,3 | 81,5 |
| Seng | 692,65 | 0,065 |
* Note: sebagai perbandingan, tekanan atmosfer adalah 101.5kPa
Referensi
- ^ a b IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (1994) "Triple point".
- ^ Definition of the kelvin at BIPM
- ^ Walas, S.M., Chemical Process Equipment - Selection and Design. Elsevier, 1990, p. 639.

