Senyawa diazonium
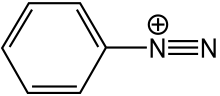
Senyawa diazonium atau garam diazonium adalah kelompok senyawa organik yang memiliki kesamaan gugus fungsional R−N+2X− di mana R merupakan semua gugus organik, seperti alkil atau aril, dan X adalah suatu anion anorganik atau organik, seperti halogen. Garam diazonium, khususnya di mana R adalah suatu gugus aril,merupakan zat antara yang penting dalam sintesis organik pewarna azo.[1]
Preparasi
Proses pembentukan senyawa diazonium disebut sebagai "diazotasi", "diazoniasi", atau "diazotisasi". Reaksi ini pertama kali dilaporkan oleh Peter Griess pada tahun 1858, yang kemudian menemukan beberapa reaksi dari kelas senyawa baru. Metode yang paling penting untuk persiapan garam diazonium adalah perlakuan terhadap amina aromatik seperti anilin dengan asam nitrit. Biasanya asam nitrit dihasilkan in situ (dalam labu yang sama) dari natrium nitrit dan asam mineral. Dalam larutan berair garam diazonium tidak stabil pada suhu di atas 5 °C; gugus −N+≡N cenderung lepas sebagai N2 (gas nitrogen).
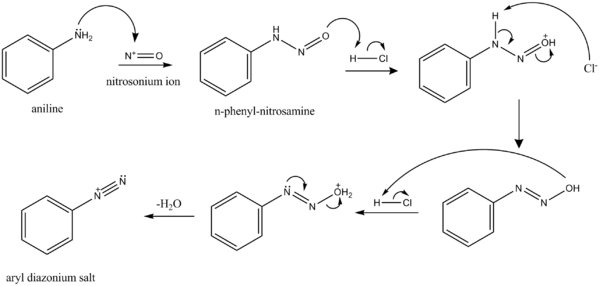 |
| Mekanisme reaksi pembentukan kation benzenadiazonium |
|---|
Senyawa diazonium salah satunya dapat diisolasi sebagai garam tetrafluoroborat, yang stabil pada suhu kamar. Seringkali, senyawa diazonium tidak diisolasi dan begitu disiapkan, langsung digunakan dalam reaksi lebih lanjut. Pendekatan ini diilustrasikan dalam penyiapan senyawa arilsulfonil:[2]
Seringkali disukai bahwa garam diazonium tetap dalam larutan, tetapi mereka cenderung berisfat jenuh. Operator terkadang dapat terbunuh dan terluka akibat kristalisasi tak terduga dari garam yang diikuti dengan munculnya ledakan.[3]
Reaksi penggandengan diazo
Reaksi garam diazonium yang paling banyak dipraktekkan adalah penggandengan azo. Dalam proses ini, senyawa diazonium diserang oleh, yaitu, digandengkan dengan, substrat yang kaya elektron. Ketika pasangan penggandengan merupakan hidrokarbon aromatik seperti anilina dan fenol, proses tersebut merupakan contoh substitusi elektrofilik aromatik:
| ArN+2 + Ar′H → ArN2Ar′ + H+ |

|

|
| Reaksi penggandengan diazo |
|---|
Kelas lain yang terpenting secara komersial dari pasangan penggandengan merupakan amida asetoasetat, seperti yang digambarkan oleh penyiapan Pigmen Yellow 12, sebuah pigmen diarilida.[4]
 |
 |
| Sintesis Pigmen Yellow 12 | |
|---|---|
Senyawa azo yang dihasilkan terkadang merupakan pewarna yang berguna dan faktanya disebut sebagai pewarna azo.[5] Warna-warna yang mendalam dari pewarna mencerminkan perpanjangan konjugasi mereka. Misalnya, pewarna yang disebut anilin kuning diproduksi dengan mencampur anilin serta larutan garam diazonium dingin dan kemudian dikocok dengan kuat. Anilin kuning diperoleh sebagai suatu padatan kuning.[6] Serupa dengan itu, suatu larutan basa Naftalen-2-ol (β-naftol) yang dingin menghasilkan endapan dengan warna jingga-merah yang kuat.[6] Metil jingga merupakan contoh pewarna azo yang digunakan di laboratorium sebagai indikator pH.
 |
 |
| Sintesis metil jingga |
|---|
Penggantian gugus N2
Kation benzenadiazonium menunjukkan berbagai reaksi di mana gugus N2 digantikan oleh gugus atau ion lain. Beberapa reaksi penggantian yang utama ditampilkan sebagai berikut.[7][8]
Penggantian oleh Halogen
Reaksi Sandmeyer
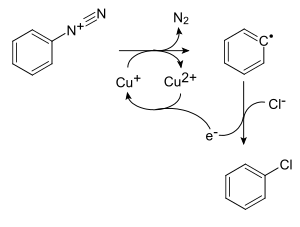
Benzenadiazonium klorida dipanaskan dengan tembaga klorida atau tembaga-bromida masing-masing dilarutkan dalam HCl atau HBr menghasilkan klorobenzena atau bromobenzena, masing-masing.
- C6H5N+2 + CuCl → C6H5Cl + N2 + Cu+
Reaksi Gatterman

Dalam reaksi Gatterman, benzenadiazonium klorida dipanaskan dengan bubuk tembaga dan HCl atau HBr menghasilkan klorobenzena serta bromobenzena masing-masing. Reaksi ini dinamai dari kimiawan Jerman Ludwig Gattermann.[9]
- C6H5N+2 + CuX → C6H5X + N2 + Cu+
Penggantian oleh iodida
Iodin tidak mudah dimasukkan ke dalam cincin benzena secara langsung. Namun dapat dimasukkan dengan memperlakukan kation arildiazonium dengan kalium iodida:
- C6H5N+2 + KI → C6H5I + K+ + N2
Penggantian oleh fluorida

Fluorobenzena dihasilkan oleh dekomposisi termal dari benzenadiazonium fluoroborat. Reaksi ini disebut reaksi Balz-Schiemann.[10]
- [C6H5N+2]BF−4 → C6H5F + BF3 + N2
Penggantian lainnya
Penggantian oleh hidrogen
Kation benzenadiazonium direduksi dengan asam hipofosfat atau natrium stannit menghasilkan benzena:
- [C6H5N+2]Cl− + H3PO2 + H2O → C6H6 + N2 + H3PO3 + HCl
Penggantian oleh gugus hidroksil

Fenol diproduksi dengan memanaskan larutan berair garam arildiazonium pada 100 °C.
- C6H5N+2 + H2O → C6H5OH + N2 + H+
Reaksi ini diberi nama dalam Bahasa Jerman Phenolverkochung ("dimasak hingga menghasilkan fenol"). Fenol yang terbentuk dapat bereaksi dengan garam diazonium dan karenanya reaksi dilakukan dengan adanya asam yang membantu dalam menekan reaksi ini lebih lanjut.
Penggantian oleh gugus siano

Gugus siano biasanya tidak dapat dimasukkan melalui substitusi nukleofilik aril halida, namun senyawa tersebut dapat dengan mudah dibuat dari garam diazonium. Ilustrasi reaksi ini adalah penyiapan benzonitril menggunakan pereaksi tembaga sianida:
- C6H5N+2 + CuCN → C6H5CN + Cu+ + N2
Reaksi ini merupakan jenis khusus dari reaksi Sandmeyer.
Penggantian oleh gugus nitro
Nitrobenzena dapat diperoleh dengan memperlakukan benzenadiazonium fluoroborat dengan natrium nitrit dengan kehadiran tembaga. Atau, diazotisasi anilin dapat dilakukan dengan kehadiran oksida tembaga, yang menghasilkan tembaga nitrit in situ:
- C6H5N+2 + CuNO2 → C6H5NO2 + N2 + Cu+
Penggantian oleh gugus tiol

Garam diazonium dapat dikonversi ke tiol dalam prosedur dua tahap. Perlakuan terhadap benzenadiazonium klorida dengan kalium ethilxantat diikuti dengan hidrolisis dari zat antara ester xantat menghasilkan tiofenol:
- C6H5N+2 + C2H5OCS−2 → C6H5SC(S)OC2H5
- C6H5SC(S)OC2H5 + H2O → C6H5SH + HOC(S)OC2H5
Penggantian oleh gugus aril
Gugus aril dapat digabungkan dengan yang lain menggunakan garam arildiazonium. Misalnya, perlakuan benzenadiazonium klorida dengan benzena (senyawa aromatik) dalam keberadaan natrium hidroksida menghasilkan difenil:
- [C6H5N+2]Cl− + C6H6 → C6H5−C6H5 + N2 + HCl
Reaksi ini dikenal sebagai reaksi Gomberg-Bachmann. Konversi serupa juga dicapai dengan memperlakukan benzenadiazonium klorida dengan etanol dan bubuk tembaga.
Penggantian oleh gugus karboksil
Diazonium fluoroborat bereaksi dengan asam karboksilat alifatik untuk menghasilkan asam benzoat yang sesuai. Reaksi ini menyediakan metode untuk mempersiapkan asam karboksilat aromatik dari asam karboksilat alifatik:
- [C6H5N+2]BF−4 + RCO2H → C6H5CO2H + BF3 + N2 + RF
Aplikasi
Penggunaan pertama dari garam diazonium adalah untuk menghasilkan kain yang dicelup cepat di air dengan cara merendam kain dalam larutan senyawa diazonium, diikuti dengan perendaman dalam larutan penggandeng (cincin kaya elektron yang mengalami substitusi elektrofilik). Aplikasi utama dari senyawa diazonium masih tetap dalam industri pewarna dan pigmen.[5]
 |
 |
| Sintesis metil merah |
|---|

Senyawa diazonium merupakan pereaksi kimia utama dalam sintesis senyawa organik, khususnya derivat aril.
Garam diazonium adalah sensitif terhadap cahaya serta terurai di bawah cahaya UV dekat atau cahaya ungu. Sifat ini telah membawa penggunaannya dalam reproduksi dokumen. Dalam proses ini, kertas atau film dilapisi dengan garam diazonium. Setelah paparan kontak di bawah cahaya, diazo residu dikonversi menjadi pewarna azo stabil dengan larutan penggandeng. Sebuah proses yang lebih umum menggunakan kertas dilapisi dengan diazo, penggandeng serta asam untuk menghambat penggandengan; setelah paparan gambar dikembangkan oleh campuran uap dari amonia dan air yang memaksa penggandengan.
Keamanan
Padatan diazonium halida terkadang mampu meledak dengan berbahaya, serta korban jiwa dan cedera telah dilaporkan.[3]
Sifat dari anion mempengaruhi kestabilan garam. Aril diazonium perklorat, seperti nitrobenzenadiazonium perklorat, telah digunakan untuk memprakarsai bahan peledak. Garam tetrafluoroborat dapat disimpan hampir tak terbatas pada suhu kamar serta terdekomposisi perlahan ketika dipanaskan.
Lihat pula
Referensi
- ^ Chemistry of the Diazonium and Diazo Groups: Part 1. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99492-8. Chemistry of the Diazonium and Diazo Groups: Part 2. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99493-6.
- ^ R. V. Hoffman (1990). "m-Trifluoromethylbenzenesulfonyl Chloride". Org. Synth.; Coll. Vol. 7: 508.
- ^ a b "UK CRHF Incident Report - Supersaturated Diazonium salt causes Fatality". Diarsipkan dari versi asli tanggal 2018-10-06. Diakses tanggal 13 Mei 2010.
- ^ K. Hunger. W. Herbst "Pigments, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2012. doi:10.1002/14356007.a20_371
- ^ a b Klaus Hunger, Peter Mischke, Wolfgang Rieper, Roderich Raue, Klaus Kunde, Aloys Engel "Azo Dyes" in Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim.doi:10.1002/14356007.a03_245.
- ^ a b Clark, Jim. "chemguide". Diakses tanggal 28 September 2011.
- ^ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 978-0-471-60180-7.
- ^ Marye Anne Fox; James K. Whitesell (2004). Organic Chemistry (edisi ke-3, illustrated). Jones & Bartlett Learning. hlm. 535–538. ISBN 978-0-7637-2197-8.
- ^ L. Gattermann (1890). "Untersuchungen über Diazoverbindungen". Berichte der deutschen chemischen Gesellschaft. 23 (1): 1218–1228. doi:10.1002/cber.189002301199.
- ^ Flood, D. T. (1943). "Fluorobenzene". Org. Synth.; Coll. Vol. 2: 295. .
Pranala luar
- W. Reusch. "Reactions of Amines". VirtualText of Organic Chemistry. Michigan State University. Diarsipkan dari versi asli tanggal 2012-12-12. Diakses tanggal 2017-02-15.


