Trietanolamina
| |

| |

| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
2,2′,2′′-Nitrilotri(etan-1-ol)[1] | |
Nama lain
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Referensi Beilstein | 1699263 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
| KEGG | |
| MeSH | Biafine |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| N(CH 2CH 2OH) 3 | |
| Massa molar | 149,19 g·mol−1 |
| Penampilan | Cairan tidak berwarna dan kental |
| Bau | Amoniakal |
| Densitas | 1.124 g/mL |
| Titik lebur | 29.202 °C; 52.595 °F; 29.475 K |
| Titik didih | 60.582 °C; 109.079 °F; 60.855 K |
| Larut | |
| log P | −0.988 |
| Tekanan uap | 1 Pa (pada 20 °C) |
| Keasaman (pKa) | 7.74[2] |
| λmaks | 280 nm |
| Indeks bias (nD) | 1.485 |
| Termokimia | |
| Kapasitas kalor (C) | 389 J K−1 mol−1 |
| Entalpi pembentukan standar (ΔfH |
−665.7 – −662.7 kJ mol−1 |
| Entalpi pembakaran standar ΔcH |
−3.8421 – −3.8391 MJ mol−1 |
| Farmakologi | |
| Kode ATC | D03 |
| Bahaya | |
| Lembar data keselamatan | hazard.com |
| Piktogram GHS | 
|
| Keterangan bahaya GHS | {{{value}}} |
| H319 | |
| P305+351+338 | |
| Titik nyala | 179 °C (354 °F; 452 K) |
| 325 °C (617 °F; 598 K) | |
| Ambang ledakan | 1.3–8.5% |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
|
| Senyawa terkait | |
Related alkanols
|
|
Senyawa terkait
|
Dietilhidroksilamin |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
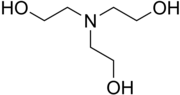
Trietanolamin adalah senyawa organik dengan rumus kimia N(CH
2CH
2OH)
3. Senyawa ini adalah cairan kental yang tidak berwarna. Senyawa ini adalah amina tersier dan triol. Triol adalah molekul dengan tiga gugus fungsi alkohol. Sekitar 150.000 ton trietanolamin diproduksi pada tahun 1999.[3] Senyawa ini adalah senyawa tidak berwarna meskipun sampel mungkin tampak kuning karena pengotor.
Produksi
Trietanolamin dihasilkan dari reaksi etilena oksida dengan amonia berair, juga dihasilkan etanolamina dan dietanolamina. Rasio produk dapat dikontrol dengan mengubah stoikiometri reaktan.[4]
Penggunaan
Trietanolamin digunakan terutama dalam pembuatan surfaktan, seperti untuk pengemulsi. Trietanolamin adalah bahan umum dalam formulasi yang digunakan untuk produk industri dan konsumen. Trietanolamin menetralkan asam lemak, mengatur dan mendaparkan pH, serta melarutkan minyak dan bahan lain yang tidak sepenuhnya larut dalam air. Garam trietanolamonium dalam beberapa kasus lebih mudah larut dibandingkan garam logam alkali yang mungkin digunakan sebaliknya, dan menghasilkan produk yang lebih basa dibandingkan dengan penggunaan hidroksida logam alkali untuk membentuk garam. Beberapa produk umum yang mengandung trietanolamin adalah losion tabir surya, deterjen laundry cair, sabun cuci piring, pembersih umum, penyanitasi tangan, semir, cairan pengerjaan logam, cat, krim cukur, dan tinta cetak.[5]
Produksi semen
Trietanolamin juga digunakan sebagai aditif organik (0,1% berat) dalam penggilingan klinker semen. Trietanolamin memfasilitasi proses penggilingan dengan mencegah aglomerasi dan pelapisan bubuk pada permukaan bola dan dinding pabrik.[6]
Kosmetik dan Kedokteran
Berbagai penyakit dan infeksi telinga diobati dengan obat tetes telinga yang mengandung trietanolamin polipeptida oleat-kondensat, seperti Cerumenex di Amerika Serikat. Dalam bidang farmasi, trietanolamin adalah bahan aktif dari beberapa obat tetes telinga yang digunakan untuk mengatasi kotoran telinga yang terkena dampak. Trietanolamin juga berfungsi sebagai penyeimbang pH pada banyak produk kosmetik yang berbeda, mulai dari krim pembersih dan susu, losion kulit, gel mata, pelembap, sampo, krim cukur, trietanolamin adalah bahan dasar yang cukup kuat: larutan 1% memiliki pH sekitar 10 , sedangkan pH kulit kurang dari pH 7 kira-kira 5,5−6,0. Emulsi krim susu pembersih berbahan dasar trietanolamin sangat baik dalam menghilangkan riasan.
Turunan
- Amustalin
- Trolnitrat
- trimustin
Pada laboratorium dan fotografi amatir
Kegunaan umum lainnya dari trietanolamin adalah sebagai zat pengompleks ion aluminium dalam larutan air. Reaksi ini sering digunakan untuk menutupi ion-ion tersebut sebelum titrasi kompleksometri dengan zat pengelat lain seperti EDTA. Trietanolamin juga telah digunakan dalam pemrosesan cuci film (perak halida). Trietanolamin telah dipromosikan sebagai alkali yang berguna oleh fotografer amatir.
Dalam holografi
Trietanolamin digunakan untuk memberikan peningkatan sensitivitas pada hologram berbasis perak-halida, dan juga sebagai bahan pembengkakan pada hologram perubahan warna. Peningkatan sensitivitas dapat dilakukan tanpa perubahan warna dengan membilas trietanolamin sebelum menggunakan alat pembersih karet dan mengeringkannya.[7]
Dalam penyepuhan tanpa listrik
Trietanolamin sekarang umum dan sangat efektif digunakan sebagai bahan pengompleks dalam penyepuhan tanpa listrik.
Dalam pengujian ultrasonik
2-3% dalam air trietanolamin digunakan sebagai zat penghambat korosi (anti karat) dalam pengujian ultrasonik perendaman.
Dalam penyolderan aluminium
Trietanolamin, dietanolamin, dan aminoetiletanolamin adalah komponen utama fluks organik cair yang umum untuk penyolderan paduan aluminium menggunakan timah-seng dan solder lunak berbahan dasar timah atau timbal lainnya.[8][9][10]
Keamanan dan Regulasi
Reaksi alergi
Sebuah penelitian tahun 1996 menemukan bahwa trietanolamin terkadang menyebabkan alergi kontak.[11] Sebuah studi tahun 2001 menemukan trietanolamin dalam tabir surya menyebabkan dermatitis kontak alergi.[12] Sebuah studi tahun 2007 menemukan trietanolamin dalam obat tetes telinga menyebabkan alergi kontak.[13] Toksisitas sistemik dan saluran pernafasan (RT) dianalisis selama 28 hari dalam penelitian inhalasi spesifik hidung tahun 2008 pada tikus besar Wistar; trietanolamin tampaknya kurang ampuh dalam hal toksisitas sistemik dan iritan RT dibandingkan dietanolamina (DEA). Paparan trietanolamin mengakibatkan peradangan fokal, dimulai pada hewan jantan tunggal dengan konsentrasi 20 mg/m3.[14]
Sebuah studi tahun 2009 menyatakan bahwa reaksi uji tempel mengungkapkan sedikit potensi iritasi dibandingkan respons alergi sebenarnya dalam beberapa kasus, dan juga menunjukkan risiko sensitisasi kulit terhadap trietanolamin tampaknya sangat rendah.[15]
Tumor
Laporan menunjukkan bahwa trietanolamin menyebabkan peningkatan kejadian pertumbuhan tumor di hati pada tikus betina B6C3F1, namun tidak pada tikus jantan atau pada tikus besar Fischer 344. Sebuah studi tahun 2004 menyimpulkan "trietanolamin dapat menyebabkan tumor hati pada tikus melalui cara kerja penipisan kolin dan efek ini kemungkinan besar disebabkan oleh penghambatan pengambilan kolin oleh sel."[16]
Toksisitas lingkungan
Sebuah studi tahun 2009 menemukan bahwa trietanolamin memiliki potensi sifat toksisitas akut, sub-kronis, dan kronis terhadap spesies perairan.[17]
Peraturan
Trietanolamin terdaftar dalam Jadwal 3, bagian B dari Konvensi Senjata Kimia karena dapat digunakan dalam pembuatan mustard nitrogen HN3.
Referensi
- ^ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. hlm. P001–P004. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Simond, M. R. (2012). "Dissociation Constants of Protonated Amines in Water at Temperatures from 293.15 K to 343.15 K". Journal of Solution Chemistry. 41: 130. doi:10.1007/s10953-011-9790-3.
- ^ Frauenkron, Matthias; Melder, Johann-Peter; Ruider, Günther; Rossbacher, Roland; Höke, Hartmut (2005), "Ethanolamines and Propanolamines", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a10_001
- ^ Weissermel, Klaus; Arpe, Hans-Jürgen; Lindley, Charlet R.; Hawkins, Stephen (2003). "Chapter 7. Oxidation Products of Ethylene". Industrial Organic Chemistry. Wiley-VCH. hlm. 159–161. ISBN 978-3-527-30578-0.
- ^ Ashford, Robert D. (2011). Ashford's Dictionary of Industrial Chemicals (edisi ke-3rd). Saltash, Cornwall: Wavelength Publications. hlm. 9252. ISBN 978-0-9522674-3-0.
- ^ Sohoni, S.; Sridhar, R.; Mandal, G. (1991). "Effect of grinding aids on the fine grinding of limestone, quartz and portland cement clinker". Powder Technology. 67 (3): 277–286. doi:10.1016/0032-5910(91)80109-V.
- ^ "Holoforum.org". Holoforum.org. Diakses tanggal 2016-07-16.
- ^ "Kapp Liquid Flux SDS" (PDF). kappalloy.com. Diakses tanggal 9 April 2019.
- ^ "Harris Stay-Clean Aluminum Flux SDS" (PDF). lincolnelectric.com. Diakses tanggal 9 April 2019.
- ^ "Superior #1260 Flux SDS" (PDF). superiorflux.com. Diakses tanggal 9 April 2019.
- ^ Hamilton, T. K.; Zug, K. A. (1996). "Triethanolamine allergy inadvertently discovered from a fluorescent marking pen". Am. J. Contact Dermat. 7 (3): 164–5. doi:10.1016/S1046-199X(96)90006-8. PMID 8957332.
- ^ Chu, C. Y.; Sun, C. C. (2001). "Allergic contact dermatitis from triethanolamine in a sunscreen". Contact Dermatitis. 44 (1): 41–2. doi:10.1034/j.1600-0536.2001.440107-8.x. PMID 11156016.
- ^ Schmutz, J. L.; Barbaud, A.; Tréchot, P. (2007). "Contact allergy to triethanolamine in ear drops and shampoo". Ann. Dermatol. Venereol. 134 (1): 105. doi:10.1016/S0151-9638(07)89009-0. PMID 17384563.
- ^ Gamer, A. O.; Rossbacher, R.; Kaufmann, W.; van Ravenzwaay, B. (2008). "The inhalation toxicity of di- and triethanolamine upon repeated exposure". Food Chem. Toxicol. 46 (6): 2173–2183. doi:10.1016/j.fct.2008.02.020. PMID 18420328.
- ^ Lessmann, H.; Uter, W.; Schnuch, A.; Geier, J. (2009). "Skin sensitizing properties of the ethanolamines mono-, di-, and triethanolamine. Data analysis of a multicentre surveillance network (IVDK*) and review of the literature". Contact Dermatitis. 60 (5): 243–255. doi:10.1111/j.1600-0536.2009.01506.x
 . PMID 19397616.
. PMID 19397616.
- ^ Stott, W. T.; Radtke, B. J.; Linscombe, V. A.; Mar, M. H.; Zeisel, S. H. (2004). "Evaluation of the potential of triethanolamine to alter hepatic choline levels in female B6C3F1 mice". Toxicol. Sci. 79 (2): 242–7. doi:10.1093/toxsci/kfh115. PMC 1592523
 . PMID 15056812.
. PMID 15056812.
- ^ Libralato, G.; Volpi Ghirardini, A.; Avezzù, F. (2009). "Seawater ecotoxicity of monoethanolamine, diethanolamine and triethanolamine". J. Hazard. Mater. 176 (1–3): 535–9. doi:10.1016/j.jhazmat.2009.11.062. PMID 20022426.

