Strok
Artikel ini memberikan informasi dasar tentang topik kesehatan. |
| Strok | |
|---|---|
 | |
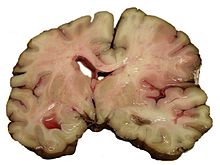
| CT scan menunjukkan adanya iskemik pada penampang melintang otak | |
| Informasi umum | |
| Spesialisasi | Neurologi, Bedah saraf |
Strok (bahasa Inggris: stroke, cerebrovascular accident, CVA) adalah suatu kondisi yang terjadi ketika pasokan darah ke suatu bagian otak tiba-tiba terganggu. Dalam jaringan otak, kurangnya aliran darah menyebabkan serangkaian reaksi biokimia, yang dapat merusakkan atau mematikan sel-sel saraf di otak. Kematian jaringan otak dapat menyebabkan hilangnya fungsi yang dikendalikan oleh jaringan itu. Strok adalah penyebab kematian yang ketiga di Amerika Serikat dan banyak negara industri di Eropa (Jauch, 2005). Bila dapat diselamatkan, kadang-kadang penderita mengalami kelumpuhan pada anggota badannya, hilangnya sebagian ingatan atau kemampuan bicaranya. Beberapa tahun belakangan ini makin populer istilah serangan otak. Istilah ini berpadanan dengan istilah yang sudah dikenal luas, "serangan jantung". strok terjadi karena cabang pembuluh darah terhambat oleh emboli. Emboli bisa berupa kolesterol atau udara.
Klasifikasi
Strok dibagi menjadi dua jenis yaitu strok iskemik maupun strok hemorragik. Sebuah prognosis hasil sebuah penelitian di Korea menyatakan bahwa,[1] 75,2% strok iskemik diderita oleh kaum pria dengan prevalensi berupa hipertensi, kebiasaan merokok dan konsumsi alkohol. Berdasarkan sistem TOAST, komposisi terbagi menjadi 20,8% LAAS, 17,4% LAC, 18,1% CEI, 16,8% UDE dan 26,8% ODE.
Strok hemorragik
Pada strok hemorragik, pembuluh darah pecah sehingga menghambat aliran darah yang normal dan darah merembes ke dalam suatu daerah di otak dan merusaknya. Hampir 70 persen kasus strok hemorrhagik terjadi pada penderita hipertensi.[butuh rujukan]
Strok hemorragik terbagi menjadi subtipe intracerebral hemorrhage (ICH), subarachnoid hemorrhage (SAH),[2] cerebral venous thrombosis, dan spinal cord stroke.[3]
Strok iskemik
Pada strok iskemik, penyumbatan bisa terjadi di sepanjang jalur pembuluh darah arteri yang menuju ke otak. Darah ke otak disuplai oleh dua arteria karotis interna dan dua arteri vertebralis. Arteri-arteri ini merupakan cabang dari lengkung aorta jantung (arcus aorta).
Reversible Ischemic Neurologic Deficit (RIND)
Defisit neurologis lebih dari 24 jam namun kurang dari 72 jam.
Sistem klasifikasi etiologis
Beberapa sistem klasifikasi yang didasarkan pada pertimbangan etiologi telah diterapkan pada strok iskemik.[4] Beberapa sistem tersebut gagal mengikuti perkembangan jaman dan tidak lagi dipergunakan, beberapa sistem yang lain masih dapat diterima oleh sebagian masyarakat dan dipergunakan dalam lingkup yang terbatas. Berikut adalah sistem klasifikasi yang paling mutakhir dan paling banyak digunakan.
Sistem TOAST
Sistem TOAST (bahasa Inggris: Trial of ORG 10172 in Acute Stroke Treatment) pertama kali dikembangkan pada terapi strok iskemik akut pada awal tahun 1990. Sistem ini didasarkan pada sebagian besar fitur klinis namun tetap mempertimbangkan informasi diagnostik dari CT, MRI, transthoracic echocardiography, extracranial carotid ultrasonography, dan jika memungkinkan, cerebral angiography.
Sistem TOAST membagi strok menjadi 5 subtipe yaitu,[5][6] large artery atherosclerosis (LAAS), cardiaoembolic infarct (CEI), small artery occlusion/lacunar infarct (LAC), stroke of another determined cause/origin (ODE), dan stroke of an undetermined cause/origin (UDE).
Sistem CCS
Klasifikasi sistem CCS (bahasa Inggris: Causative Classification of Stroke System) mirip dengan sistem TOAST dengan perbedaan pada subtipe large artery atherosclerosis dibedakan menjadi occlusive dan stenotic. Sebagai contoh, penurunan diameter ≥ 50%, atau penurunan diameter <50% disertai plaque ulceration atau trombosis. Dan subtipe undetermined cause dibedakan lebih lanjut menjadi unknown, incomplete evaluation, unclassified stroke (more than one etiology), dan cryptogenic embolism.
Sistem ASCO
ASCO merupakan akronim dari atherothrombosis, small vessel disease, cardiac causes, and other uncommon causes. Sistem ASCO merupakan klasifikasi berdasarkan sistem fenotipe. Tiap fenotipe masih terbagi menjadi jenjang 0, 1, 2, 3 atau 9. Jenjang 0 berarti disease is completely absent, 1 berarti definitely a potential cause of the index stroke, 2 untuk causality uncertain dan 3 untuk unlikely a direct cause of the index stroke (but disease is present), 9 bagi grading is not possible due to insufficient work-up.[7]
Pada sistem ini, penderita dapat dikategorikan menjadi lebih dari satu subtipe etiologis, misalnya, penderita dengan ateroma karotid yang menyebabkan stenosis 50% dan fibrilasi atrial dengan aterosklerosis dan emboli kardiak, atau dijabarkan menjadi seperti A1-S9-C0-O3.
Sistem UCSD Stroke DataBank
Sistem UCSD mengklasifikan strok iskemik menjadi large-vessel stenotic, large-vessel occlusive, Small-vessel stenotic, small-vessel occlusive, embolic dan unknown cause. Sedangkan klasifikasi strok hemorragik terbagi menjadi subtipe yang sama yaitu tipe intracerebral dan subarachnoid.
Sistem HCSR
Sistem HCSR (bahasa Inggris: Harvard Cooperative Stroke Registry) membuat klasifikasi menjadi subtipe strok yang disertai trombosis pada arteri atau dengan infark lakunar, cerebral embolism, intracerebral hematoma, subarachnoid hemorrhage dari malformasi aneurysm atau arteriovenous.[8]
Sistem NINCDS Stroke Data Bank
Pada Stroke Data Bank of the National Institute of Neurological and Communicative Disorders and Stroke memklasifikasi menjadi subtipe diagnostik berdasarkan riwayat klinis penderita, pemeriksaan, test laborat meliputi tomografi, noninvasive vascular imaging, dan saat memungkinkan dan relevan, angiografi. Dari diagnosa tersebut subtipe infarcts of undetermined cause (IUC) dapat diklasifikasi ulang menjadi subtipe embolisme idiopatik, stenosis atau trombosis pada pembuluh nadi, infark lakunar, infarksi superfisial dan sindrom nonlakunar.[9]
Sistem lain
Beberapa ahli lain mempertimbangan klasifikasi berdasarkan fenotipe seperti keberadaan internal carotid artery plaque, intima-media thickness, leukoaraiosis, cerebral microbleeds (CMB), atau multiple lacunae.[3]
CMB adalah deposit hemosiderin intraserebral yang terdapat pada ruang pervaskular.[10] Ekspresi CMB sangat tinggi pada infark lakunar dan infark aterotrombotik, dan berekspresi rendah pada infarksi kardioembolik. CMB dan leukoaraiosis sangat berkaitan erat. Hasil prognosis menunjukkan bahwa CMB ditemukan pada 47-80% kasus primary intracerebral haemorrhage dan 0-78% dalam kasus ischaemic cerebrovascular disease.[11]
Patofisiologi
Hingga saat ini patofisiologi strok merupakan studi yang sebagian besar didasarkan pada serangkaian penelitian,[12] terhadap berbagai proses yang saling terkait, meliputi kegagalan energi, hilangnya homeostasis ion sel, asidosis, peningkatan kadar Ca2+ sitosolik, eksitotoksisitas, toksisitas dengan radikal bebas, produksi asam arakidonat, sitotoksisitas dengan sitokina, aktivasi sistem komplemen, disrupsi sawar darah otak, aktivasi sel glial dan infiltrasi leukosit.[13]
Pusat area otak besar yang terpapar iskemia akan mengalami penurunan aliran darah yang dramatis, menjadi cedera dan memicu jenjang reaksi seperti lintasan eksitotoksisitas yang berujung pada nekrosis yang menjadi pusat area infark dikelilingi oleh penumbra/zona peri-infarksi. Menurut morfologi, nekrosis merupakan bengkak selular akibat disrupsi inti sel, organel, membran plasma, dan disintegrasi struktur inti dan sitoskeleton.
Pada area penumbra, apoptosis neural akan berusaha dihambat oleh kedua mekanisme eksitotoksik dan peradangan,[14] oleh karena sel otak yang masih normal akan menginduksi sistem kekebalan turunan untuk meningkatkan toleransi jaringan otak terhadap kondisi iskemia, agar tetap dapat melakukan aktivitas metabolisme. Protein khas CNS seperti pancortin-2 akan berinteraksi dengan protein modulator aktin, Wiskott-Aldrich syndrome protein verprolin homologous-1 (WAVE-1) dan Bcl-xL akan membentuk kompleks protein mitokondrial untuk proses penghambatan tersebut.
Riset terkini menunjukkan bahwa banyak neuron pada area penumbra dapat mengalami apoptosis setelah beberapa jam/hari sebagai bagian dari proses pemulihan jaringan pasca strok dengan 2 lintasan, yaitu lintasan ekstrinsik dan lintasan intrinsik.
Iskemia tidak hanya mempengaruhi jaringan parenkima otak, namun berdampak pula pada sistem ekstrakranial. Oleh karena itu strok akan menginduksi imunosupresi yang dramatis melalui aktivasi berlebih sistem saraf simpatetik, sehingga memungkinkan terjadinya infeksi bakterial seperti pneumonia.
Eksitotoksisitas asam glutamat
Asam glutamat merupakan asam amino neurotransmiter eksitatorial utama pada otak, akan menumpuk pada ruang ekstraselular dan mengaktivasi pencerapnya.[13] Aktivasi pencerap glutamat akan mempengaruhi konsentrasi ion intraselular, terutama ion Na+ dan Ca2+. Peningkatan influx ion Na+ dapat membuat sel menjadi cedera pada awal mula terjadinya iskemia, namun riset menunjukkan bahwa sebagian besar kerusakan sel yang ditimbulkan oleh toksisitas asam glutamat saat terjadi iskemia lebih disebabkan oleh peningkatan berlebih influx ion kalsium intraselular yang kemudian menimbulkan efek toksik.
Stres oksidatif
Sepanjang proses strok, terjadi peningkatan radikal bebas seperti anion superoksida, radikal hidroksil dan NO. Sumber utama senyawa radikal bebas turunan oksigen yang biasa disebut spesi oksigen reaktif dalam proses iskemia adalah mitokondria. Sedangkan produksi senyawa superoksida saat pasca iskemia adalah metabolisme asam arakidonat melalui lintasan siklo-oksigenase dan lipo-oksigenase. Radikal bebas juga dapat diproduksi oleh sel mikroglia yang teraktivasi dan leukosit melalui sistem NADPH oksidase segera setelah terjadi reperfusi pada jaringan iskemik. Oksidasi tersebut akan menyebabkan kerusakan lebih lanjut pada jaringan dan merupakan molekul yang penting untuk memicu apoptosis setelah strok iskemik.
NO umumnya dihasilkan dari L-arginina dengan salah satu isoform NO sintase, dan merupakan kluster diferensiasi neuron pada seluruh bagian otak dengan sebutan nNOS. Aktivasi nNOS memerlukan kalsium/kalmodulin. Di sisi lain, ekspresi iNOS (bahasa Inggris: inducible NOS) terdapat pada sel radang seperti sel mikroglia dan monosit. Kedua isoform nNOS dan iNOS memiliki peran yang merusak otak pada rentang waktu iskemia. Namun isoform yang ketiga eNOS (bahasa Inggris: endothelial NOS) memiliki efek vasodilasi dan tidak bersifat merusak.
Aktivasi pencerap NMDA saat iskemia akan menstimulasi produksi NO oleh nNOS. NO yang terbentuk akan masuk ke dalam sitoplasma dan bereaksi dengan superoksida dan menghasilkan sejenis spesi oksigen yang sangat reaktif yaitu peroksinitrita (ONOO-).
Pasca iskemia, kedua jenis spesi oksigen reaktif dan spesi nitrogen reaktif kemudian berperan untuk mengaktivasi beberapa lintasan metabolisme seperti radang, apoptosis, dan penurunan pasokan oksigen yang berdampak pada peningkatan asam laktat melalui glikolisis anaerobik atau asidosis. Selain itu, akan nampak ekspresi gen iNOS pada sel vaskular maupun sel yang mengalami peradangan dan ekspresi gen COX-2 pada sel saraf di area antara infark dan penumbra. Kedua gen radang ini akan meningkatkan kerusakan iskemik.[15]
Peroksidasi lipid
Selain menghasilkan berbagai senyawa ROS, lintasan asidosis juga turut serta dalam proses sintesis protein intraselular. Peroksidasi lipid pada membran sel yang menginduksi apoptosis pada neuron, akan menghasilkan senyawa aldehida yang disebut 4-hidroksinonenal (4-HNE) yang akan bereaksi dengan transporter membran seperti Na+/K+ ATPase, transporter glutamat dan transporter glukosa.
Kerusakan pada transporter membran, yang menyebabkan influx berlebih ion Ca2+ dan radikal bebas, lebih lanjut akan mengaktivasi faktor transkripsi neuroprotektif seperti NF-κB, HIF-1 dan IRF-1. Aktivasi faktor transkripsi ini akan menginduksi produksi sitokina radang seperti IL-1, IL-6, TNF-α, kemokina seperti IL-8, MCP-1, molekul adhesi sel seperti selektin, ICAM-1, VCAM-1 dan gen pro-radang lainnya seperti IIP-10.
Disfungsi sawar darah otak
Sawar darah otak yang merupakan jaringan endotelium pada otak akan merespon kondisi cedera akibat strok dengan meningkatkan permeabilitas dan menurunkan fungsi sawarnya, bersamaan dengan degradasi lamina basal pada dinding pembuluhnya. Oleh sebab itu, pada kondisi akut, strok akan meningkatkan interaksi antara sel endotelial otak dengan sel ekstravaskular seperti astrosit, mikroglia, neuron, dengan sel intravaskular seperti keping darah, leukosit; dan memberikan kontribusi lebih lanjut pada proses peradangan, disamping perubahan sirkulasi kadar ICAM-1, trombomodulin, faktor jaringan dan tissue factor pathway inhibitor.[16] Disfungsi endotelial yang menyebabkan defisiensi sawar darah otak, impaired cerebral autoregulation dan perubahan protrombotik dipercaya merupakan penyebab cerebral small vessel disease (SVD). Penderita (SVD) dapat mengalami infark lakunar, atau dengan disertai leukoaraiosis.
Dari 594 penderita strok, leukoaraiosis ditemukan pada 55,4% cerebral large vessel disease (LVD) atau ateroskeloris, 30,3% pada SVD dan 14,3% pada cardioembolic disease. Pada pronosis LVD, leukoaraiosis memiliki kecenderungan ke arah grup stenosis intrakranial dengan 40,3% untuk grup intrakranial, 26,9% untuk grup ekstrakranial dan 45,5% untuk grup kombinasi keduanya. Tidak ditemukan korelasi antara leukoaraiosis dengan diabetes mellitus, hiperlipidemia, merokok, hipertensi dan penyakit jantung.[17]
Infiltrasi leukosit
Pada jaringan otak terdapat beberapa populasi sel dengan kapasitas untuk mensekresi sitokina setelah terjadi stimulasi iskemia, yaitu sel endotelial, astrosit, sel mikroglia dan neuron.
Peran respon peradangan pasca iskemia dilakukan oleh sel mikroglia, terutama pada area penumbra dengan sekresi sitokina pro-radang, metabolit dan enzim toksik. Selain itu, sel mikroglia dan astrosit juga mensekresi faktor neuroprotektif seperti eritropoietin, TGFβ1, dan metalotionein-2.
Terdapat banyak bukti yang menunjukkan peran leukosit pada patogenesis cedera akibat strok seperti cedera pada jaringan akibat reperfusi dan disfungsi mikrovaskular. Bukti-bukti tersebut dapat diklasifikasikan menjadi 3 bagian pokok yaitu,
- terjadi akumulasi leukosit pasca iskemia hingga terjadi cedera jaringan
- simtoma iskemia direspon dengan peningkatan neutrofil.[18] Pada percobaan dengan tikus, rendahnya populasi neutrofil pada sirkulasi darah menunjukkan volume infark yang lebih kecil.
- pencegahan adhesi sel antara leukosit dengan sel endotelial pada sawar darah otak, dengan antibodi monoklonal terbukti dapat memberikan perlindungan terhadap cedera akibat strok.
Akumulasi sel T terjadi pasca iskemia,[18] dan diperkirakan merupakan penyebab terjadinya reperfusi. Sel T CD8 dapat menginduksi cedera otak dengan molekul dari granula sitotoksik. Sel TH1 CD4+ dengan sekresi sitokina pro-radang termasuk IL-2, IL-12, IFN-γ dan TNF-α dapat memperburuk efek yang ditimbulkan strok, sedangkan Sel TH2 CD4+ dengan sitokina anti-radang seperti IL-4, IL-5, IL-10 dan IL-13 lebih mempunyai peran protektif.
Faktor risiko
- Merokok
- Alkohol
- Diet
- tingginya kadar kolesterol
- Riwayat keluarga [19]
Hipertensi
Hipertensi akan menstimulasi pembentukan plak aterosklerotik pada pembuluh arteri dan arteriol pada otak, serta menginduksi lintasan lipohialinosis pada pembuluh ganglia basal, hingga menyebabkankan infark lakunar atau pendarahan otak.[20]
Fibrilasi atrial
Fibrilasi atrial merupakan indikasi terjadinya kardioembolisme, sedangkan kardioembolisme merupakan 20% penyebab stok iskemik.[21] Kardioembolisme terjadi akibat kurangnya kontraksi otot jantung pada bilik kiri, disebut stasis, yang terjadi oleh penumpukan konsentrasi fibrinogen, D-dimer dan faktor von Willebrand.[22] Hal ini merupakan indikasi status protrombotik dengan infark miokardial, yang pada gilirannya, akan melepaskan trombus yang terbentuk, dengan konsekuensi peningkatan risiko embolisasi pada otak. Sekitar 2,5% penderita infark miokardial akut akan mengalami strok dalam kurun waktu 2 hingga 4 minggu, 8% pria dan 11% wanita akan mengalami strok iskemik dalam waktu 6 tahun, oleh karena disfungsi dan aneurysm bilik kiri jantung.
Aterosklerosis
Penelitian mengenai lintasan aterogenesis yang memicu aterosklerosis selama ini terfokus pada pembuluh nadi koroner, namun proses serupa juga terjadi pada otak dan menyebabkan strok iskemik.[23] Aterosklerosis dapat terjadi pada pembuluh nadi otak seperti pembuluh karotid, pembuluh nadi pada otak tengah, dan pembuluh basilar, atau pada pembuluh arteriol otak seperti pembuluh lenticulostriate, basilar penetrating, dan medullary. Beberapa riset menunjukkan bahwa mekanisme aterosklerosis yang terjadi pada pembuluh nadi dapat sedikit berbeda dengan mekanisme pada pembuluh arteriol.
Aterosklerosis intrakranial dianggap sebagai kondisi yang sangat jarang terjadi. Hasil otopsi infark otak dari 339 penderita strok yang meninggal akibat aterosklerosis intrakranial, ditemukan 62,2% plak intrakranial dan 43,2% stenosis intrakranial.[24] Hasil otopsi oleh National Cardiovascular Center, Osaka, Jepang pada 142 penderita strok yang meninggal dalam waktu 30 hari sejak terhitung sejak terjadi serangan iskemia, menunjukkan bahwa kedua jenis trombus yang kaya akan keping darah dan yang kaya akan fibrin berkembang pada culprit plaque di dalam pembuluh nadi otak merupakan faktor utama penyebab strok aterotrombotik.[25] 70% kasus strok kardioembolik menunjukkan keberadaan trombus sebagai sumber potensial terbentuknya emboli pada jantung atau pembuluh balik pada penderita patent foramen ovale dan tetralogy of Fallot. Umumnya trombus yang kaya akan keping darah yang mengendap pada pembuluh balik jantung, akan terlepas dan membentuk emboli pada pembuluh nadi otak.
Diabetes mellitus
Berdasarkan studi hasil otopsi, penderita diabetes mellitus rentan terhadap infark lakunar dan cerebral small vessel disease. Studi epidemiologi menunjukkan bahwa diabetes merupakan faktor risiko bagi strok iskemik. Patogenesis strok yang dipicu tampaknya dimulai dari reasi berlebih glikasi dan oksidasi, disfungsi endotelial, peningkatan agregasi keping darah, defisiensi fibrinolisis dan resistansi insulin.[26] Pada hewan tikus, strok iskemik yang terjadi pada diabetes mellitus akan memicu strok hemorragik yang disertai dengan peningkatan enzim MMP-9 pada otak yang memperburuk kondisi leukoaraiosis.[27]
Transient Ischemic Attack (TIA)
Transient ischemic attack (TIA), disebut juga acute cerebrovascular syndrome (ACVS),[28] adalah salah satu faktor risiko dari strok iskemik.[29]
TIA dapat dijabarkan sebagai episode singkat disfungsi neurologis yang biasanya terjadi akibat gangguan vaskular,[30] berupa simtoma iskemia pada otak atau retina yang berlangsung kurang dari 24 jam, atau kurang dari 1 jam,[31] tanpa meninggalkan bekas berupa infark serebral[32] akut.[33]
Dari sudut pandang lain, oleh karena strok merupakan defisiensi neurologis akibat perubahan aliran darah pada jaringan otak, maka TIA dapat dikatakan sebagai indikasi atau simtoma yang ditimbulkan dari perubahan aliran darah otak yang tidak dapat dideteksi secara klinis dalam waktu 24 jam.[34]
TIA tidak selalu menjadi indikasi akan terjadinya strok di kemudian hari, dan jarang sekali dikaitkan dengan strok hemorragik primer. Pada populasi manusia yang telah beranjak tua, TIA diinduksi oleh terhalangnya aliran darah pada pembuluh darah besar terutama akibat aterotrombosis, namun pada penderita usia di bawah 45 tahun TIA umumnya disebabkan oleh robeknya pembuluh darah (bahasa Inggris: arterial dissection), migrain dan obat-obatan sympathomimetic. TIA juga dapat disebabkan oleh :
- Large artery atherothrombosis with distal flow reduction
- Arteriosklerosis pada pembuluh darah kecil ("lacunar TiAs")
- Emboli Kardiogenic dan emboli antar-arteri
- Vasospasma
- Vaskulitis
- Sludging-polycythemia. sickle cell anemia. Trombositemia dan sejenisnya
- Hypercoaguable states-puerperium. oral contraceptive use. 'sticky platelet syndrome" dan sejenisnya
- Meningitis
- Cortical vein thrombosis-dehydration. Puerperium. Infection. Neoplasma dan sejenisnya
- Displasia fibromuskular
- Sindrom Moyamoya
- Arteritis Takayasu
Namun beberapa kondisi lain dapat menimbulkan gejala yang sangat serupa dengan TIA, seperti focal seizure activity, migraine (?"spreading depression"), compressive mononeuropathies (carpal tunnel syndrome. ulnar elbow compression and so forth), sindrom Adams-Stokes, tumor otak dengan gejala neurologik transien, hematoma subdural, Demyelinating disease, hipoglisemia, hiperglisemia, primary ocular disease-glaucoma, vitreal hemorrhage. floaters and the like, functional disorders-conversion hysteria, malingering, hiperventilasi.
Cardiac papillary fibroelastoma (CPF)
Dari 725 kasus CPF, 55% merupakan penderita pria dengan lokasi tumor, umumnya, ditemukan pada permukaan valvular, terutama pada katup trikuspidalis aortik, selain katup mitralis. Tumor juga ditemukan pada permukaan non-valvular, seperti pada bilik kiri. Ukuran tumor bervariasi dari 2 mm hingga 70 mm.[35]
Manifestasi klinis CPF meliputi strok, infark miokardial, emboli paru, gagal jantung congestive dan serangan jantung mendadak.[36] Meskipun demikian, tidak semua penderita menunjukkan simtoma demikian.
Cryptogenic cerebral infarction (CCI)
CCI paling banyak ditemukan pada penderita patent foramen ovale baik yang disertai maupun tidak disertai septal aneurysm.[37][38] Sejak tahun 1989, CCI merupakan penyebab 40% kasus strok iskemik. 4,9% pria dan 2,4% wanita mengalami mutasi genetik galaktosidase-alfa yang merupakan indikasi penyakit Fabry, sedangkan studi lain menunjukkan keterkaitan dengan trombofilia.[39] Lintasan patogenesis CCI diperkirakan meliputi aterosklerosis pada pembuluh nadi otak, baik yang bersifat intrakranial seperti moderate middle cerebral artery stenosis, ekstrakranial seperti vertebral artery origin stenosis atau proksimal seperti thick plaques in the aortic arch yang selama ini dianggap tidak berkaitan dengan patogenesis strok.[40]
Patent foramen ovale (PFO)
Sindrom platipnea-ortodeoksia merupakan kondisi yang jarang terjadi dengan simtoma berupa dispnea dan desaturasi arterial. PFO merupakan salah satu bentuk sindrom platipnea-ortodeoksia dengan peningkatan ortostatik pada area defisiensi atrial septal.[41] Hasil diagnosa PFO yang sering ditemukan pada CCI dan migrain, juga diperkirakan sebagai penyebab emboli pada penderita tromboembolisme arterial.
Diagnosis
Diagnosis strok adalah secara klinis beserta pemeriksaan penunjang. Pemeriksaan penunjang yang dapat dilakukan antara lain CT scan kepala, MRI. Untuk menilai kesadaran penderita strok dapat digunakan Skala Koma Glasgow. Untuk membedakan jenis stroke dapat digunakan berbagai sistem skor, seperti Skor Strok Siriraj, Algoritma Stroke Gajah Mada, atau Algoritma Junaedi.
Simtoma klinis
Fitur strok iskemik yang sangat umum, menurut Uniformed Services University of the Health Sciences, masih berdasar pada banyaknya hasil diagnosis pemeriksaan fisik terhadap penderita yang dirangkum dalam satu kurun waktu. USUHS merangkumnya menjadi tabel berikut agar dapat digunakan masyarakat awam untuk mengenali gejala klinis strok sedini mungkin. Dan bagi tenaga medis profesional, The National Institute of Health telah membuat tabel skala strok sebagai panduan guna melakukan diagnosis dalam waktu kurang dari sekitar 5 hingga 10 menit.
Simtoma paraklinis
Beberapa senyawa biokimiawi di dalam serum darah yang dapat dijadikan dasar diagnosis dan prognosis terjadinya nekrosis otak antara lain:[42]
S100-β
S100-β adalah peptida yang disekresi astrosit pada saat terjadi cedera otak, proses neurodegenerasi dan kelainan psikiatrik. S100-β merupakan senyawa pengikat kalsium, secara in vitro, pada konsentrasi rendah, interaksi dengan sistem kekebalan pada otak akan meningkatkan kelangsungan hidup bagi neuron yang sedang berkembang, namun, pada konsentrasi yang lebih tinggi, S100-β akan menstimulasi produksi sitokina pro-peradangan dan apoptosis.
Studi pada hewan menunjukkan efek neuroprotektif S100-β dengan teraktivasinya proses selular pada neuron yang menahan eksitotoksisitas yang diinduksi NMDA. Peningkatan serum S100-β selalu terjadi pada strok iskemik, dan terjadi pula pada kondisi yang lain seperti traumatic brain injury (TBI), Alzheimer dan schizophrenia.
Saat terjadi strok iskemik, konsentrasi serum S100-β mencapai titik maksimum pada hari ke-2 hingga 4. Nilai konsentrasi maksimum S100-β berkaitan dengan skala strok NIH, ukuran dan patofisiologi infark, sehingga semakin tinggi nilai maksimum S100-β, semakin tinggi pula risiko terjadinya transformasi hemorragik. Peningkatan S100-β juga ditemukan pada strok hemorragik primer, yang menunjukkan volume hematoma awal.
Peningkatan kadar S100-β tidak harus terjadi dengan cepat, dan masih banyak sel selain astrosit dan sel Schwann yang menhasilkan S100-β, sehingga penggunaan nilai serum S100-β sebagai salah satu dasar diagnosis strok masih cukup rentan. Namun beberapa studi telah menunjukkan bahwa serum S100-β lebih terkait dengan kondisi integritas sawar darah otak.
Glial fibrillary-associated protein (GFAP)
GFAP merupakan monomeric intermediate filament protein yang terdapat pada astrosit dan sel ependimal otak yang berfungsi sebagai bagian sitoskeleton. Kadar serum S100-β dan GFAP akan meningkat tajam pada hari 1-2 sesuai dengan ukuran infark, dan kembali normal sekitar 3 minggu kemudian.
Serum GFAP merupakan indikator yang lebih peka daripada S100-β pada strok minor maupun guratan kecil, namun waktu tunda peningkatan serum ini membuat aplikasi diagnostiknya menjadi terbatas.
Myelin basic protein (MBP)
MBP adalah protein hidrofilik penting bagi struktur selubung mielin. Kadar MBP dalam CSF sering digunakan sebagai indikasi aktivitas patogen dalam sklerosis multipel. Strok juga disertai dengan peningkatan kadar MBP dalam CSF sekitar 1 minggu setelah terjadinya serangan, dan kembali normal setelah minggu ketiga.
Fatty acid-binding proteins (FABPs)
FABP adalah kelompok molekul intraselular yang berperan dalam menyangga dan sebagai transportasi asam lemak berantai panjang, yang akan segera disekresi ke dalam sirkulasi darah sesaat setelah terjadi kerusakan sel. Pada tubuh manusia terdapat 9 jenis FABP yang tersebar pada masing-masing jenis jaringan yang berbeda. 4 jenis FABP terdapat pada sistem saraf, dua diantaranya hanya ditemukan pada sistem saraf pusat orang dewasa, yaitu brain-type (B-FABP) pada glia dan heart-type (H-FABP) pada neuron.
Ditemukannya H-FABP pada berbagai jenis jaringan merupakan indikasi infak miokardial akut. B-FABP berada pada jaringan di dalam sistem saraf pusat dan tidak dapat dideteksi pada serum darah manusia sehat. Serum H-FABP dan B-FABP akan tajam dalam 2-3 jam sejak terjadi serangan strok. B-FABP merupakan indikasi yang sangat peka terhadap infark lakunar dan infark subkortikal, namun tidak menunjukkan tingkat kerusakan yang terjadi pada neuron, dan bukan merupakan indikasi spesifik terjadinya strok. Sebaliknya peningkatan H-FABP berbanding lurus dengan ukuran infark dan tingkat kerusakan saraf.
Neuron-specific enolase (NSE)
NSE merupakan salah satu dari tiga bentuk enolase, sebuah enzim yang terdapat pada lintasan glikolisis. Walaupun cukup spesifik pada neuron, NSE juga dapat ditemukan pada kultur sel neuroendokrin dan bentuk sel kanker terkait. Konsentrasi NSE di dalam CSF akan meningkat seiring terjadinya strok iskemik dan sejumlah cedera otak lain seperti subarachnoid hemorrhage, ICH, dan lain-lain, hingga mulai dapat dideteksi setelah 4-8 jam setelah terjadinya serangan. Konsentrasi tertinggi setelah terjadi strok iskemik memiliki korelasi dengan nilai pada skala strok NIH.
Protein tau (TP)
Otak memiliki 6 isomer TP yang memungkinkan terbentuknya mikrotubula dengan interaksi tubulin. Peningkatan kadar TP terjadi dengan sangat lambat dan hanya 27% total konsentrasi yang mengalami peningkatan di luar batas atas ambang normal dalam waktu 24 jam setelah serangan strok iskemik, namun nilai konsentrasi ini menunjukkan ukuran infark dan strata serangan strok. Peningkatan kadar TP dalam CSF pasca strok juga merupakan indikasi ukuran infark. Akan tetapi strok tidak mempengaruhi kadar β-amyloid, ApoE dan klusterin dalam CSF.
Penanganan
Penderita strok biasanya diberikan oksigen, dipasang infus untuk memasukkan cairan dan zat makanan, diberikan manitol atau kortikosteroid untuk mengurangi pembengkakan dan tekanan di dalam otak pada penderita strok akut.[43] Penelitian terakhir menunjukkan bahwa kelumpuhan dan gejala lainnya bisa dicegah atau dipulihkan jika recombinan tissue plasminogen activator (RTPA) atau streptokinase yang berfungsi menghancurkan emboli diberikan dalam waktu 3 jam setelah timbulnya strok.
Metode perawatan hemodilusi dengan menggunakan albumin masih kontroversial,[44] namun penelitian oleh The Amsterdam Stroke Study memberikan prognosis berupa penurunan angka kematian dari 27% menjadi 16%, peningkatan kemandirian aktivitas dari 35% menjadi 48%, saat 3 bulan sejak terjadi serangan strok akut.
Pencegahan
Pada manusia tanpa faktor risiko strok dengan umur di bawah 65 tahun, risiko terjadinya serangan strok dalam 1 tahun berkisar pada angka 1%.[45] Setelah terjadinya serangan strok ringan atau TIA, penggunaan senyawa anti-koagulan seperti warfarin, salah satu obat yang digunakan untuk penderita fibrilasi atrial,[46] akan menurunkan risiko serangan strok dari 12% menjadi 4% dalam satu tahun. Sedangkan penggunaan senyawa anti-keping darah seperti aspirin, umumnya pada dosis harian sekitar 30 mg atau lebih, hanya akan memberikan perlindungan dengan penurunan risiko menjadi 10,4%.[47] Kombinasi aspirin dengan dipyridamole memberikan perlindungan lebih jauh dengan penurunan risiko tahunan menjadi 9,3%.
Cara yang terbaik untuk mencegah terjadinya strok adalah dengan mengidentifikasi orang-orang yang berisiko tinggi dan mengendalikan faktor risiko strok sebanyak mungkin, seperti kebiasaan merokok, hipertensi, dan stenosis pada pembuluh karotid,[48] mengatur pola makan yang sehat dan menghindari makanan yang mengandung kolesterol jahat (LDL), serta olaraga secara teratur. Stenosis merupakan efek vasodilasi endotelium yang umumnya disebabkan oleh turunnya sekresi NO oleh sel endotelial, dapat diredam asam askorbat yang meningkatkan sekresi NO oleh sel endotelial melalui lintasan NO sintase atau siklase guanilat, mereduksi nitrita menjadi NO dan menghambat oksidasi LDL[49] pada lintasan aterosklerosis.
Beberapa institusi kesehatan seperti American Heart Association atau American Stroke Association Council, Council on Cardiovascular Radiology and Intervention memberikan panduan pencegahan yang dimulai dengan penanganan seksama berbagai penyakit yang dapat ditimbulkan oleh aterosklerosis, penggunaan senyawa anti-trombotik untuk kardioembolisme dan senyawa anti-keping darah bagi kasus non-kardioembolisme,[50] diikuti dengan pengendalian faktor risiko seperti arterial dissection, patent foramen ovale, hiperhomosisteinemia, hypercoagulable states, sickle cell disease; cerebral venous sinus thrombosis; strok saat kehamilan, strok akibat penggunaan hormon pasca menopause, penggunaan senyawa anti-koagulan setelah terjadinya cerebral hemorrhage; hipertensi,[51] hipertensi, kebiasaan merokok, diabetes, fibrilasi atrial, dislipidemia, stenosis karotid, obesitas, sindrom metabolisme, konsumsi alkohol berlebihan, konsumsi obat-obatan berlebihan, konsumsi obat kontrasepsi, mendengkur, migrain, peningkatan lipoprotein dan fosfolipase.
Prognosis
Bagian ini memerlukan pengembangan. Anda dapat membantu dengan mengembangkannya. |
Referensi
- ^ (Inggris) "Ischemic stroke in Korean young adults". Department of Neurology, University of Ulsan, Asan Medical Center; Kwon SU, Kim JS, Lee JH, Lee MC. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Influence of stroke subtype on quality of care in the Get With The Guidelines–Stroke Program". Calgary Stroke Program (E.E.S.), Hotchkiss Brain Institute, University of Calgary, Canada; Duke Clinical Research Institute (L.L., A.H.), Department of Epidemiology (M.J.R.), Michigan State University, Division of Cardiology (C.P.C.), Brigham & Women's Hospital, Division of Cardiology (G.C.F.), University of California, Stroke Service (L.H.S.), Massachusetts General Hospital; E E. Smith, MD, MPH, L Liang, PhD, A Hernandez, MD, M J. Reeves, PhD, C P. Cannon, MD, G C. Fonarow, MD, dan L H. Schwamm, MD. Diakses tanggal 2011-07-25.
- ^ a b (Inggris) "Classification of stroke subtypes". Department of Neurology and Stroke Center, INSERM U-698 and Paris-Diderot University, Bichat University Hospital; Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Hennerici MG. Diakses tanggal 2011-08-01.
- ^ (Inggris) "Advances in the Diagnosis of Etiologic Subtypes of Ischemic Stroke". Stroke Service and A. A. Martinos Center for Biomedical Imaging, Departments of Neurology and Radiology, Massachusetts General Hospital, Harvard Medical School; Hakan Ay. Diakses tanggal 2011-07-25.
- ^ (Inggris) "Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment". Department of Neurology, University of Iowa; Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, Marsh EE 3rd. Diakses tanggal 2011-08-01.
- ^ (Inggris) "Cerebrovascular risk factors and clinical classification of strokes". Department of Internal Medicine and Cardioangiology, University of Palermo; Pinto A, Tuttolomondo A, Di Raimondo D, Fernandez P, Licata G. Diakses tanggal 2011-08-21.
- ^ (Inggris) "New approach to stroke subtyping: the A-S-C-O (phenotypic) classification of stroke". Department of Neurology and Stroke Center, INSERM U-698 and Paris-Diderot University, Bichat University Hospital; Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Hennerici MG. Diakses tanggal 2011-08-01.
- ^ (Inggris) "The Harvard Cooperative Stroke Registry: a prospective registry". Mohr JP, Caplan LR, Melski JW, Goldstein RJ, Duncan GW, Kistler JP, Pessin MS, Bleich HL. Diakses tanggal 2011-08-01.
- ^ (Inggris) "Infarks of undetermined cause: the NINCDS Stroke Data Bank". Neurological Institute, Columbia-Presbyterian Medical Center; Sacco RL, Ellenberg JH, Mohr JP, Tatemichi TK, Hier DB, Price TR, Wolf PA. Diakses tanggal 2011-08-01.
- ^ (Inggris) "Silent cerebral microbleeds on susceptibility-weighted imaging of patients with ischemic stroke and leukoaraiosis". Department of Neurology, Capital Medical University, Beijing Anzhen Hospital; Gao T, Wang Y, Zhang Z. Diakses tanggal 2011-08-01.
- ^ (Inggris) "Cerebral microbleeds: old leaks and new haemorrhages". Department of Neuroradiology, University Medical Centre Hamburg-Eppendorf; Fiehler J. Diakses tanggal 2011-08-01.
- ^ (Inggris) "Pathophysiology of stroke: lessons from animal models". Department of Experimental Neurology Charité, Humboldt University; Mergenthaler P, Dirnagl U, Meisel A. Diakses tanggal 2011-07-28.
- ^ a b (Inggris) "Pathophysiology, treatment, and animal and cellular models of human ischemic stroke". School of Biomedical Sciences, University of Queensland, Department of Neurology and Stroke Center, National Taiwan University Hospital and National Taiwan University College of Medicine, Department of Pharmacology, Monash University; Trent M Woodruff, John Thundyil, Sung-Chun Tang, Christopher G Sobey, Stephen M Taylor, dan Thiruma V Arumugam. Diakses tanggal 2011-07-30.
- ^ (Inggris) "Pathobiology of ischaemic stroke: an integrated view". Dept of Neurology, Charité Hospital; Dirnagl U, Iadecola C, Moskowitz MA. Diakses tanggal 2011-07-28.
- ^ (Inggris) "Molecular pathology of cerebral ischemia: delayed gene expression and strategies for neuroprotection". Department of Neurology, University of Minnesota Medical School; Iadecola C, Ross ME. Diakses tanggal 2011-07-28.
- ^ (Inggris) "Markers of endothelial dysfunction in lacunar infarction and ischaemic leukoaraiosis". Department of Clinical Neurosciences, St George’s Hospital Medical School, Department of Haematology, Guy’s and St Thomas’s Trust, St Thomas’s Hospital, Institute of Neurology, National Hospital for Neurology and Neurosurgery, Department of Neurology, St James’s Hospital, Department of Neurology, Stoke Mandeville Hospital, Thames Valley Nuffield Hospital; Ahamad Hassan, Beverley J. Hunt, Michael O’Sullivan, Kiran Parmar, John M. Bamford, Dennis Briley, Martin M. Brown, Dafydd J. Thomas dan Hugh S. Markus. Diakses tanggal 2011-08-02.
- ^ (Inggris) "The leukoaraiosis is more prevalent in the large artery atherosclerosis stroke subtype among Korean patients with ischemic stroke". Department of Neurology, Department of Radiology, The Catholic University of Korea, Department of Neurology, National Cancer Center; Seung-Jae Lee, Joong-Seok Kim, Kwang-Soo Lee, Jae-Young An, Woojun Kim, Yeong-In Kim, Bum-Soo Kim, dan So-Lyung Jung. Diakses tanggal 2011-08-02.
- ^ a b (Inggris) "Stroke and T-cells". Laboratory of Neurosciences, National Institute on Aging Intramural Research Program; Arumugam TV, Granger DN, Mattson MP. Diakses tanggal 2011-07-28.
- ^ (Inggris) Floßmann, Enrico (2004). "Systematic Review of Methods and Results of Studies of the Genetic Epidemiology of Ischemic Stroke". Stroke. 35: 212–227. Diakses tanggal 13 November 2010.
- ^ (Inggris)"Hypertension and Cerebrovascular Dysfunction". Costantino Iadecola, Division of Neurobiology, Department of Neurology and Neuroscience, Weill Cornell Medical College; Costantino Iadecola dan Robin L. Davisson. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Prevention Strategies for Cardioembolic Stroke: Present and Future Perspectives". Department of Neurology, Institute of Experimental Neurology (INSPE), IRCCS San Raffaele, Department Neurology, Sohag University Hospital, Unità Gravi Cerebrolesioni Acquisite (UGCA) Ospedale San Giovanni Battista; Giacomo Giacalone, Mohammed Abballa Abbas, dan Francesco Corea. Diakses tanggal 2011-08-08.
- ^ (Inggris)"Cardioembolic Stroke: Clinical Features, Specific Cardiac Disorders and Prognosis". Cerebrovascular Division, Department of Neurology, Hospital Universitari del Sagrat Cor, Universitat de Barcelona, CIBER de Enfermedades Respiratórias (CB06/06). Instituto Carlos III, Department of Cardiology, Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat; Adrià Arboixab dan Josefina Alióc. Diakses tanggal 2011-09-02.
- ^ (Inggris) "Atherosclerosis and Thrombus Formation". Stroke Center at University of Washington in Saint Louis, School of Medicine. Diakses tanggal 2011-07-28.
- ^ (Inggris) "Autopsy prevalence of intracranial atherosclerosis in patients with fatal stroke". Assistance Publique-Hôpitaux de Paris; Mazighi M, Labreuche J, Gongora-Rivera F, Duyckaerts C, Hauw JJ, Amarenco P. Diakses tanggal 2011-08-02.
- ^ (Inggris) "Heart and vessel pathology underlying brain infarction in 142 stroke patients". Department of Pathology, National Cardiovascular Center; Ogata J, Yutani C, Otsubo R, Yamanishi H, Naritomi H, Yamaguchi T, Minematsu K. Diakses tanggal 2011-08-02.
- ^ (Inggris) "Diabetes mellitus and cerebrovascular disease". Department of Neurological Sciences, Rush-Presbyterian-St. Luke's Medical Center; Lukovits TG, Mazzone TM, Gorelick TM. Diakses tanggal 2011-08-07.
- ^ (Inggris) "White Matter Damage and the Effect of Matrix Metalloproteinases in Type 2 Diabetic Mice After Stroke". Department of Neurology (J.C., X.C., A.Z., Y.C., C.R., M.C.), Henry Ford Hospital, Department of Physics (M.C.), Oakland University; Jieli Chen, MD, Xu Cui, PhD, Alex Zacharek, MS, Yisheng Cui, MD, Cynthia Roberts, BS, and Michael Chopp, PhD. Diakses tanggal 2011-08-08.
- ^ (Inggris) "[Transient ischemic attack, a medical emergency]". Department of Neurology, Tokyo Women's Medical University School of Medicine; Uchiyama S. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Short term and long term risk of incident ischemic stroke after transient ischemic attack". Department of Epidemiology, Cardiovascular Health Research Unit, Department of Medicine, Department of Biostatistics, Department of Neurology, University of Washington, Group Health Research Institute, Seattle Epidemiologic Research and Information Center, Department of Veterans Affairs Office of Research and Development; Evan L Thacker, SM, Kerri L Wiggins, MS, RD, Kenneth M Rice, PhD, WT Longstreth, Jr, MD, MPH, Joshua C Bis, PhD, Sascha Dublin, MD, PhD, Nicholas L Smith, PhD, Susan R Heckbert, MD, PhD, dan Bruce M Psaty, MD, PhD. Diakses tanggal 2011-07-27.
Transient ischemic attack (TIA) is a risk factor for ischemic stroke, and clinically diagnosed TIA is an opportunity for stroke prevention.
- ^ (Inggris) "[Transient ischemic attacks: a new definition]". Moonen G, Delcourt C, Lievens I, Hans G. Diakses tanggal 2011-07-27.
- ^ (Inggris) "Transient ischemic attack: definition and natural history". Cerebrovascular Disease Service, Palmer 127, West Campus, Beth Israel Deaconess Medical Center; Caplan LR. Diakses tanggal 2011-07-27.
- ^ (Inggris) Wu, Caren M (2007). "Early Risk of Stroke After Transient Ischemic Attack". Arch Intern Med. 167 (22): 2417–2422. Diakses tanggal 12 November 2010.
- ^ (Inggris) "Definition and evaluation of transient ischemic attack: a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association Stroke Council; Council on Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; and the Interdisciplinary Council on Peripheral Vascular Disease. The American Academy of Neurology affirms the value of this statement as an educational tool for neurologists". American Heart Association; American Stroke Association Stroke Council; Council on Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; Interdisciplinary Council on Peripheral Vascular Disease.; Easton JD, Saver JL, Albers GW, Alberts MJ, Chaturvedi S, Feldmann E, Hatsukami TS, Higashida RT, Johnston SC, Kidwell CS, Lutsep HL, Miller E, Sacco RL. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Clinical Evaluation and Management of Transient Ischemic Attacks". Division of Neurology, Department of Neurosciences, University of California; John F. Rothrock, MD, Director, UCSD Stroke Program. Diakses tanggal 2011-07-27.
- ^ (Inggris) "Cardiac papillary fibroelastoma: a comprehensive analysis of 725 cases". Division of Cardiology, Long Island College Hospital; Gowda RM, Khan IA, Nair CK, Mehta NJ, Vasavada BC, Sacchi TJ. Diakses tanggal 2011-08-02.
- ^ (Inggris) "Papillary Fibroelastoma of the Aortic Valve as a Cause of Transient Ischemic Attack". Department of Cardiovascular Surgery, Texas Heart Institute at St. Luke's Episcopal Hospital; Mehmet H. Akay, MD, Moritz Seiffert, BS, dan David A. Ott, MD. Diakses tanggal 2011-08-02.
- ^ (Inggris) "Patent foramen ovale as a risk factor for cryptogenic stroke". Columbia-Presbyterian Medical Center; Di Tullio M, Sacco RL, Gopal A, Mohr JP, Homma S. Diakses tanggal 2011-08-02.
- ^ (Inggris) "[Cryptogenic stroke and patent foramen ovale]". Inselspital Bern, Universitätsspital; Windecker S, Nedeltchev K, Wahl A, Meier B. Diakses tanggal 2011-08-02.
- ^ (Inggris) "[Cryptogenic cerebral infarction: from classification to concept]". SourceCHU de la Cavale Blanche, Service de neurologie; Timsit S, Breuilly C. Diakses tanggal 2011-08-01.
- ^ (Inggris) "Underlying pathology of stroke of unknown cause (cryptogenic stroke)". INSERM U-698 and Paris-Diderot University; Amarenco P. Diakses tanggal 2011-08-02.
- ^ (Inggris) "Transhepatic Approach to Closure of Patent Foramen Ovale". Cardiology Department, Arizona Heart Hospital & Institute, Internal Medicine Department, Banner Good Samaritan Medical Center; Jamal Hussain, MD, FACC, Robert Strumpf, MD, Aslan GhandForoush, DO, Ayman Jamal, MD, dan Edward Diethrich, MD. Diakses tanggal 2011-08-02.
- ^ (Inggris)"Molecular biomarkers in stroke diagnosis and prognosis". Department of Neurology, Massachusetts General Hospital, Harvard Medical School; Matthew B Maas dan Karen L Furie. Diakses tanggal 2011-09-02.
- ^ (Indonesia) Misbach, H Jusuf. "Penanganan Stroke". Medicastore. Diakses tanggal 13 November.
- ^ (Inggris) "Custom-tailored hemodilution with albumin and crystalloids in acute ischemic stroke". Department of Rheology, St. Lucas Hospital; Goslinga H, Eijzenbach V, Heuvelmans JH, van der Laan de Vries E, Melis VM, Schmid-Schönbein H, Bezemer PD. Diakses tanggal 2011-08-21.
- ^ (Inggris) "[Atrial fibrillation and apoplexy--risks and prevention]". Københavns praktiserende laegers laboratorium, AFASAK 2 Center; Koefoed BG, Gulløv AL, Petersen P. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Stroke risk factors and stroke prevention". Department of Neurology, College of Physicians and Surgeons, Columbia University; Elkind MS, Sacco RL. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Dipyridamole for preventing stroke and other vascular events in patients with vascular disease". Julius Center for General Practice and Patient Oriented Research / Univ. Department of Neurology, University Medical Center Utrecht; De Schryver EL, Algra A, van Gijn J. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Primary stroke prevention". Department of Neurology, University of Cincinnati; Sauerbeck LR. Diakses tanggal 2011-08-21.
- ^ (Inggris)"How does ascorbic acid prevent endothelial dysfunction?". Department of Medicine, Vanderbilt University School of Medicine; May JM. Diakses tanggal 2011-08-24.
- ^ (Inggris) "Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline". American Heart Association; American Stroke Association Council on Stroke; Council on Cardiovascular Radiology and Intervention; American Academy of Neurology.; Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K, Goldstein LB, Gorelick P, Halperin J, Harbaugh R, Johnston SC, Katzan I, Kelly-Hayes M, Kenton EJ, Marks M, Schwamm LH, Tomsick T. Diakses tanggal 2011-08-21.
- ^ (Inggris) "Primary prevention of ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council: cosponsored by the Atherosclerotic Peripheral Vascular Disease Interdisciplinary Working Group; Cardiovascular Nursing Council; Clinical Cardiology Council; Nutrition, Physical Activity, and Metabolism Council; and the Quality of Care and Outcomes Research Interdisciplinary Working Group". American Heart Association; American Stroke Association Stroke Council; Goldstein LB, Adams R, Alberts MJ, Appel LJ, Brass LM, Bushnell CD, Culebras A, DeGraba TJ, Gorelick PB, Guyton JR, Hart RG, Howard G, Kelly-Hayes M, Nixon JV, Sacco RL. Diakses tanggal 2011-08-21.
