Heksametilfosforamida
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Heksametilfosforamida
| |
| Nama lain
Heksametapol
HMPA | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| C6H18N3OP | |
| Massa molar | 179,20 g/mol |
| Densitas | 1,03 g/cm³ |
| Titik lebur | 7,20 °C |
| Titik didih | 235 °C |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
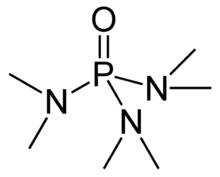
Heksametilfosforamida (disingkat HMPA) adalah cairan organik yang tidak berwarna dengan rumus kimia [(CH3)2N]3PO.
HMPA adalah oksida fosfina tersier HMPT, P(NMe2)3 yang sangat basa. Sama seperti oksida fosfina lainnya, molekul HMPA memiliki inti tetrahedral dan ikatan P-O yang sangat polar dengan muatan negatif secara signifikan berada pada atom oksigen.
Aplikasi
HMPA digunakan sebagai pelarut polimer, pelarut selektif untuk gas, stabilisator pada polistirena terhadap degradasi termal, sebagai pelarut laboratorium untuk reaksi organologam dan organik. Ia juga telah diuji sebagai penghambat api dan sebagai kemosterilan serangga, tetapi tidak ditemukan aplikasi HMPA untuk tujuan ini.
Ia sangat berguna dalam meningkatkan selektivitas reaksi-reaksi organik tertentu. Contohnya pada beberapa reaksi deprotonasi. HMPA terurai menjadi oligomer basa litium seperti butillitium. Oleh karena HMPA juga melarutkan kation namun tidak pada anion, ia digunakan sebagai pelarut untuk beberapa reaksi SN2 yang sulit. Atom oksigen yang bersifat basa pada HMPA berkoordinasi dengan kation litium.[1] Kompleks peroksida molibdenum HMPA digunakan dalam kimia sintetik sebagai oksidan.
Reagen alternatif
Dimetil sulfoksida sering kali dapat digunakan untuk menggantikan HMPA sebagai pelarut. Kedua-duanya merupakan akseptor ikatan hidrogen yang kuar, dan atom oksigennya dapat mengikat kation logam. Alternatif lainnya meliputi tetraalkilurea[2] dan alkilurea siklik seperti DMPU.[3]
Toksisitas
HMPA sedikit beracun, namun ditemukan menyebabkan kanker hidung pada tikus percobaan.[1] HMPA dapat didegradasi menjadi senyawa yang kurang beracun oleh asam klodrida.
Referensi
- ^ a b Dykstra, R. R. "Hexamethylphosphoric Triamide" Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, Ltd. DOI: 10.1002/047084289X.rh020
- ^ Beck, A. K.; Seebach, D. "N,N'-Dimethylpropyleneurea" in Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, New York. DOI: 10.1002/047084289X.rd366.
- ^ Triptikumar Mukhopadhyay, Dieter Seebach (1982). "Substitution of HMPT by the cyclic urea DMPU as a cosolvent for highly reactive nucleophiles and bases". Helvetica Chimica Acta. 65 (1): 385–391. doi:10.1002/hlca.19820650141.
- Merck Index, 12th Edition, 4761.
