Potensial elektrode
Potensial elektrode, E, dalam kimia atau elektrokimia, menurut definisi IUPAC,[1] adalah gaya gerak listrik (GGL, electromotive force atau EMF) dari suatu sel yang dibangun dari dua elektrode:[2]
- di sisi kiri diagram sel adalah elektrode hidrogen standar (SHE), dan
- di sisi kanan adalah elektrode yang dimaksud.
SHE didefinisikan memiliki potensial 0 V, sehingga potensial sel bertanda dari pengaturan di atas adalah[3]
- Esel = Ekiri (SHE) − Ekanan = 0 V − Eelektrode = Eelektrode.
SHE adalah katode dan elektrode adalah anoda.
Asal dan interpretasi
Potensial elektrode muncul pada antarmuka antara elektrode dan elektrolit karena transfer spesi bermuatan melintasi antarmuka, adsorpsi ion spesifik pada antarmuka, dan adsorpsi/orientasi spesifik molekul polar, termasuk yang ada pada pelarut.
Potensial elektrode adalah potensial listrik pada komponen elektrode. Dalam sel, terdapat potensial elektrode untuk katode dan potensial elektrode untuk anode. Perbedaan antara dua potensial elektrode sama dengan potensial sel:[3]
- Esel = Ekatode − Eanoda.
Potensial elektrode yang diukur dapat berupa yang terdapat pada kesetimbangan pada elektrode kerja ("potensial reversibel"), atau potensial dengan reaksi bersih non-nol pada elektrode kerja tetapi arus bersih nol ("potensial korosi",[4] "potensial campuran"), atau potensial dengan arus bersih non-nol pada elektrode kerja (seperti dalam korosi Galvani atau voltametri). Potensi reversibel terkadang dapat dikonversi menjadi potensial elektrode standar untuk spesi elektroaktif tertentu dengan mengekstrapolasi nilai terukur ke keadaan standar.
Nilai potensial elektrode di bawah non-kesetimbangan tergantung pada sifat dan komposisi fase kontak, dan pada kinetika reaksi elektrode pada antarmuka (lihat persamaan Butler–Volmer).[5]
Asumsi operasional untuk penentuan potensial elektrode dengan elektrode hidrogen standar melibatkan elektrode referensi ini dengan ion hidrogen dalam larutan ideal yang memiliki "potensial nol pada semua suhu" ekuivalen dengan entalpi pembentukan standar ion hidrogen juga "nol pada semua suhu".
Pengukuran
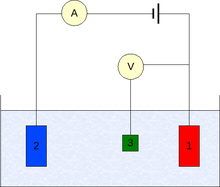
Pengukuran umumnya dilakukan menggunakan pengaturan tiga elektrode (lihat gambar):[6]
- elektrode kerja,
- elektrode pembantu,
- elektrode referensi (elektrode hidrogen standar atau yang sebanding).
Dalam hal arus bersih non-nol pada elektrode, penting untuk meminimalkan penurunan IR ohmik dalam elektrolit, misalnya, dengan menempatkan elektrode referensi di dekat permukaan elektrode kerja, atau dengan menggunakan elektrolit pendukung dengan konduktivitas yang cukup tinggi.[7] Pengukuran potensial dilakukan dengan terminal positif dari elektrometer yang terhubung ke elektrode kerja dan terminal negatif ke elektrode referensi.
Perbedaan potensial dari sel yang dirakit dari dua elektrode
Potensial sel yang dirakit dari dua elektrode dapat ditentukan dari dua potensial elektrode individu yang digunakan
- ΔVsel = Ered,katode − Ered,anoda
atau, setara dengan,
- ΔVsel = Ered,katode + Eoks,anoda.
Hal ini mengikuti definisi IUPAC mengenai perbedaan potensial listrik dari sel galvanik,[8] di mana perbedaan potensial listrik sel adalah perbedaan dari potensial elektrode di sebelah kanan dan kiri sel galvanik. Ketika ΔVsel bernilai positif, maka muatan listrik positif mengalir melalui sel dari elektrode kiri (anoda) ke elektrode kanan (katode).
Lihat pula
- Potensial listrik
- Potensial elektrokimiawi
- Persamaan Nernst
- Perbedaan potensial (tegangan)
- Potensial elektrode standar
- Tabel potensial elektrode standar
- Elektrolisis
- Elektrokimia
Referensi
- ^ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Dikompilasi oleh A. D. McNaught dan A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versi terkoreksi daring XML: http://goldbook.iupac.org (2006–) dibuat oleh M. Nic, J. Jirat, B. Kosata; pembaharuan dikompilasi oleh A. Jenkins. ISBN 0-9678550-9-8. DOI:10.1351/goldbook. Entry: "Electrode Potential".
- ^ Zoski, C. G., ed. (2006). Handbook of Electrochemistry (dalam bahasa Inggris). Boston, MA: Elsevier. ISBN 9780444519580. OCLC 162129983.
- ^ a b Sawyer, D. T., Sobkowiak, A. & Roberts, J. L. (1995). Electrochemistry for Chemists (dalam bahasa Inggris) (edisi ke-2). Hoboken, NJ: Wiley. ISBN 9780471594680.
- ^ "Getting Started with Electrochemical Corrosion Measurement: Review of the Electrochemical Basis of Corrosion". Gamry Instruments (dalam bahasa Inggris). Diakses tanggal 13 Januari 2017.
- ^ Walsh, F. C. (1992). "The Kinetics of Electrode Reactions: Part I—General Considerations and Electron Transfer Control". The International Journal of Surface Engineering and Coatings (dalam bahasa Inggris). 70 (1): 50–54. doi:10.1080/00202967.1992.11870941.
- ^ Bard, A. J. & Faulkner, L. R. (2001). Electrochemical Methods: Fundamentals and Applications (edisi ke-2). Hoboken, NJ: Wiley. ISBN 9780471043720.
- ^ Oelßner, W., Berthold, F. & Guth, U. (2006). "The iR drop – well‐known but often underestimated in electrochemical polarization measurements and corrosion testing". Materials and Corrosion (dalam bahasa Inggris). 57 (6): 455–466. doi:10.1002/maco.200603982.
- ^ IUPAC Gold Book. Definition of the potential difference of a galvanic cell. http://goldbook.iupac.org/E01934.html.
