Ion lawan

Sebuah ion lawan (bahasa Inggris: counterion atau counter ion) adalah ion yang menyertai spesies ion untuk menjaga netralitas listrik. Dalam garam dapur (NaCl), ion natrium (bermuatan positif) adalah ion lawan dari ion klorin (bermuatan negatif) dan sebaliknya. Ion lawan lebih umum dirujuk sebagai anion atau kation, tergantung listriknya. Oleh karena itu, ion lawan dari anion adalah kation, dan sebaliknya.
Kimia antarmuka
[sunting | sunting sumber]Ion lawan adalah ion bergerak dalam polimer dan koloid pertukaran ion.[1] Resin penukar ion adalah polimer dengan muatan bersih negatif atau positif. Resin penukar kation berisi polimer anionik dengan kation lawan, biasanya Na+ (natrium). Resin memiliki afinitas yang lebih tinggi terhadap ion lawan yang bermuatan lebih tinggi, misalnya Ca2+ (kalsium) dalam hal penghilangan kesadahan air. Sebaliknya, resin penukar anion biasanya tersedia dalam bentuk Cl− (klorida), yang memiliki ion lawan bergerak tinggi.
Ion lawan digunakan dalam katalisis transfer fase. Dalam aplikasi tipikal ion lawan lipofilik seperti benzalkonium melarutkan pereaksi dalam pelarut organik.
Kimia larutan
[sunting | sunting sumber]Kelarutan garam dalam pelarut organik merupakan fungsi baik kation dan anion. Kelarutan kation dalam pelarut organik dapat ditingkatkan jika anionnya bersifat lipofilik. Analog dengan hal tersebut, kelarutan anion dalam pelarut organik meningkat dengan kation lipofilik. Kation lipofilik yang paling umum adalah kation amonium kuarterner, yang disebut "garam kuat".
- Anion lawan lipofilik
-
Litium tetrakis(pentafluorofenil)borat adalah garam litium dengan anion tetraarilborat yang sangat lipofilik, sering dirujuk sebagai anion koordinasi lemah.[2]
-
Tetrafenilborat kurang lipofil daripada turunan perfluorinasinya, tetapi banyak digunakan sebagai zat pengendap.
-
Heksafluorofosfat adalah anion koordinasi lemah yang umum.
-
Seperti digambarkan oleh ion lawan kecil tetrafluoroborat (BF−4), kation lipofilik cenderung simetris dan bermuatan tunggal.
- Kation lawan lipofilik
-
Bis(trifenilfosfin)iminium klorida adalah garam klorida dari kation fosfonium [Ph3PNPPh3]+ lipofilik dan besar.
-
Tetraphenylphosphonium chloride (C6H5)4PCl, disingkat Ph4PCl atau PPh4Cl adalah klorida dari kation fosfonium simetris yang sering digunakan dalam kimia organologam. Garam arsonium juga dikenal baik.
-
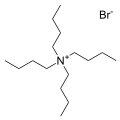
Garam bromida tetrabutilamonium, salah satu kation lawan yang paling umum. Banyak analog "garam kuat" yang diketahui.
-
Kation logam alkali terikat oleh eter mahkota, suatu kation lawan lipofilik yang diketahui, seperti digambarkan oleh [Li(12-crown-4)2]+.
Banyak kompleks organologam kationik diisolasi dengan ion lawan non-koordinasi yang lengai. Ferosenium tetrafluoroborat adalah salah satu contohnya.
Elektrokimia
[sunting | sunting sumber]Untuk mencapai konduktivitas ionik tinggi, pengukuran elektrokimia dilakukan dengan adanya kelebihan elektrolit. Dalam air, elektrolit seringkali berupa garam sederhana seperti kalium klorida. Untuk pengukuran dalam larutan non air, digunakan garam yang terdiri dari kation dan anion lipofilik, misalnya tetrabutilamonium heksafluorofosfat. Bahkan dalam kasus seperti itu potensi dipengaruhi oleh pasangan ion, efek yang ditekankan dalam pelarut dengan konstanta dielektrik rendah.[3]
In order to achieve high ionic conductivity, electrochemical measurements are conducted in the presence of excess electrolyte. In water the electrolyte is often a simple salt such as potassium chloride. For measurements in nonaqueous solutions, salts composed of both lipophilic cations and anions are employed, e.g., tetrabutylammonium hexafluorophosphate. Even in such cases potentials are influenced by ion-pairing, an effect that is accentuated in solvents of low dielectric constant.
Kestabilan ion lawan
[sunting | sunting sumber]Untuk banyak aplikasi, ion lawan hanya menyediakan muatan dan lipofilisitas yang memungkinkan manipulasi ion mitranya. Ion lawan diharapkan bersifat lengai secara kimia. Untuk anion lawan, kelengaian dinyatakan dalam hal kebasaan Lewis rendah. Ion lawan idealnya kasar dan tidak reaktif. Untuk kation lawan amonium dan fosfonium kuaterner, kelengaian terkait dengan ketahanan degradasi oleh basa kuat dan nukleofil kuat.
Referensi
[sunting | sunting sumber]- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "counter-ions".
- ^ I. Krossing and I. Raabe (2004). "Noncoordinating Anions - Fact or Fiction? A Survey of Likely Candidates". Angewandte Chemie International Edition. 43 (16): 2066–2090. doi:10.1002/anie.200300620. PMID 15083452.
- ^ Geiger, W. E., Barrière, F., "Organometallic Electrochemistry Based on Electrolytes Containing Weakly-Coordinating Fluoroarylborate Anions", Acc. Chem. Res. 2010, 43, 1030. doi:10.1021/ar1000023

![Litium tetrakis(pentafluorofenil)borat adalah garam litium dengan anion tetraarilborat yang sangat lipofilik, sering dirujuk sebagai anion koordinasi lemah [en].[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png/152px-Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png)

![Heksafluorofosfat adalah anion koordinasi lemah [en] yang umum.](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4f/PF6.png/98px-PF6.png)

![Bis(trifenilfosfin)iminium klorida adalah garam klorida dari kation fosfonium [Ph3PNPPh3]+ lipofilik dan besar.](http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/PPNCl.png/180px-PPNCl.png)

![Kation logam alkali terikat oleh eter mahkota, suatu kation lawan lipofilik yang diketahui, seperti digambarkan oleh [Li(12-crown-4)2]+.](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png/118px-Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png)