Gaya antarmolekul
Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul-molekul atau antara bagian yang terpisah jauh dari suatu makromolekul. Gaya tersebut dapat berupa kohesi antara molekul serupa, seperti contohnya pada tegangan permukaan, atau adhesi antara molekul tak serupa, contohnya pada kapilaritas.
Gaya antarmolekul ini memiliki sifat tarik menarik dan juga tolak-menolak antar molekul. Ketika dua molekulnya berdekatan, gaya tolak antara muatan yang sama akan timbul dan semakin tinggi energi tolaknya. Oleh karena itu akan dibutuhkan energi yang lebih tinggi pula untuk memampatkan suatu molekul.
Penelitian gaya antarmolekul bermula dari pengamatan makroskopik yang menunjukkan adanya aksi gaya-gaya pada tingkat molekul atau mikroskopik. Pengamatan ini meliputi sikap termodinamik gas non-ideal yang dicerminkan oleh koefisien virial, tekanan uap, viskositas, tegangan permukaan dan data adsorpsi.
Rujukan pertama mengenai gaya-gaya mikroskopik didapati pada tulisan Alexis Clairaut yang berjudul "Theorie de la Figure de la Terre".[1] Sejumlah cendekiawan yang berkontribusi terhadap penelitian gaya-gaya mikroskopik antara lain adalah: Laplace, Gauss, Maxwell dan Boltzmann.
Gaya Van der Waals terdiri dari tiga macam, yaitu:
- Gaya Keesom/Gaya elektrostatis, meliputi interaksi antara:
- molekul ionik dengan molekul ionik
- dipol permanen dengan dipol permanen
- Gaya Debye (interaksi antara dipol permanen dengan dipol terinduksi)
- Gaya London/Gaya Dispersi (interaksi antara dipol sementara dengan dipol terinduksi)
Gaya dipol–dipol
[sunting | sunting sumber]Molekul polar memiliki distribusi atau kerapatan elektron yang tidak merata dikarenakan pada molekul polar memiliki perbedaan keelektronegatifan yang besar. Perbedaaan keelektronegatifan ini menyebabkan suatu atom terbagi menjadi dua muatan (dipol), satu ujung memiliki muatan positif dan ujung lainnya bermuatan negatif. Terdapat kecenderungan bahwa ujung positif akan berdekatan dengan ujung negatif atom lain yang berada di dekatnya.2 Keadaan ini disebabkan adanya gaya tarik-menarik yang disebut dengan gaya tarik dipol–dipol.
Hubungan gaya dipol – dipol dengan sifat fisik suatu senyawa. Semakin rendah gaya tarik dipol-dipol antar molekul, maka titik didih maupun titik leleh senyawa tersebut akan semakin tinggi. Kenyataan ini menyatakan bahwa gaya tarik dipol-dipol bukan merupakan faktor utama penentu besarnya titik leleh maupun titik didih suatu senyawa. Gaya dipol-dipol merupakan gaya yang bekerja antara molekul-molekul polar, yaitu antara molekul yang memiliki momen dipol. Semakin besar momen dipolnya, maka semakin kuat gayanya.
Suatu contoh interaksi dipol-dipol dapat dilihat pada asam klorida (HCl): ujung positif suatu molekul polar akan saling menarik dengan ujung negatif molekul lain dan mempengaruhi posisinya. Molekul polar mempunyai gaya tarik resultan. Contoh-contoh molekul polar adalah asam klorida (HCl) dan kloroform (CHCl3).
Ikatan hidrogen
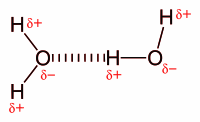
[sunting | sunting sumber]Ikatan hidrogen (hydrogen bond) adalah gaya tarik menarik antara suatu pasangan dari sebuah atom elektronegatif dan sebuah atom hidrogen yang terikat dengan nitrogen, oksigen, atau fluorin.[2] Ikatan hidrogen sering digambarkan sebagai suatu interaksi dipol-dipol elektrostatik yang kuat. Namun, juga memiliki sejumlah ciri ikatan kovalen: mempunyai arah, lebih kuat dari interaksi van der Waals, menghasilkan jarak antaratom yang lebih pendek dari jumlah jari-jari van der Waals, dan umumnya melibatkan pasangan dalam jumlah terbatas, yang dapat ditafsirkan sebagai sejenis valensi.
Ikatan hidrogen antarmolekul menyebabkan tingginya titik didih air (100 °C) dibanding hidrida golongan 16 lain, yang tidak mempunyai ikatan hidrogen. Ikatan hidrogen antarmolekul juga turut menyebabkan struktur sekunder, tersier, dan kuarterner dari protein dan asam nukleat. Ikatan ini juga berperan penting pada struktur polimer, baik sintetik maupun alamiah.
Gaya van der Waals
[sunting | sunting sumber]Gaya ini dikemukakan pertama kali oleh Johannes van der Waals (1837-1923). Gaya van der Waals merupakan gaya tarik menarik listrik yang relatif lemah akibat kepolaran molekul yang permanen atau terinduksi. Kepolaran permanen terjadi akibat kepolaran di dalam molekul, sedangkan kepolaran tidak permanen terjadi akibat molekul terinduksi oleh partikel lain yang bermuatan sehingga molekul bersifat polar sesaat secara spontan.
Konsep gaya tarik menarik antar molekul ini digunakan untuk menurunkan persamaan zat-zat yang berada dalam fase gas. Gaya ini terjadi karena adanya gaya tarik menarik antara inti atom dengan elektron atom lain yang disebut gaya tarik menarik elektrostatis (gaya coulomb) yang umumnya terdapat pada senyawa polar. Pada molekul non polar gaya van der Waals timbul karena adanya dipol-dipol sesaat atau gaya London.
Berdasarkan kepolaran partikelnya gaya van der Waals dibagi menjadi:
- Interaksi ion-dipol (molekul polar)
- Interaksi dipol-dipol
- Interaksi ion-dipol terinduksi
- Interaksi dipol-dipol terinduksi
Interaksi ion-dipol (molekul polar)
[sunting | sunting sumber]Terjadi interaksi/tarik menarik antara ion dengan molekul polar (dipol) yang relatif cukup kuat.
Interaksi dipol-dipol
[sunting | sunting sumber]Merupakan interaksi antara sesama molekul polar (dipol) yang terjadi antara ekor dan kepala dari molekul itu sendiri.
Interaksi ion-dipol terinduksi
[sunting | sunting sumber]Merupakan interaksi ion dengan dipol terinduksi. Dipol terinduksi merupakan molekul netral dan menjadi dipol akibat induksi partikel bermuatan yang berada di dekatnya. Ikatan ini relatif lemah karena kepolaran molekul terinduksi relatif kecil daripada dipol permanen.
Interaksi dipol-dipol terinduksi
[sunting | sunting sumber]Molekul dipol dapat membuat molekul netral lain yang bersifat dipol terinduksi sehingga terjadi interaksi dipol-dipol terinduksi dan ikatannya relatif lemah sehingga prosesnya berlangsung secara lambat. Antar aksi dipol terinduksi-dipol terinduksi (gaya london)
Gaya van der Waals bersifat permanen sehingga lebih kuat dari gaya london. Gaya van der Waals terdapat pada senyawa hidrokarbon seperti CH4. Perbedaan keelektronegatifan C(2,5) dengan H(2,1) sangat kecil, yaitu 0,4. Senyawa-senyawa yang memiliki ikatan van der Waals akan mempunyai titik didih yang sangat rendah, tetapi akan semakin tinggi apabila massa molekul relatif (Mr) bertambah karena ikatan akan semakin kuat (C4H10 > C3H8 > C2 H6> CH4).
Gaya London
[sunting | sunting sumber]Gaya London pertama kali ditemukan oleh seorang ahli fisika dari Jerman, Fritz London, pada tahun 1930. Gaya London adalah gaya tarikan lemah yang disebabkan oleh dipol imbasan sekejap atau sesaat yang terjadi karena adanya pergerakan elektron dalam suatu orbital. Pergerakan tersebut dapat mengakibatkan tidak meratanya kerapatan elektron pada atom, sehingga atom tersebut mempunyai satu sisi dipol dengan muatan lebih negatif dibandingkan sisi yang lain. Mudahnya suatu atom untuk membentuk dipol sesaat disebut dengan polarisabilitas. Dipol–dipol ini dikatakan sesaat karena pergerakan elektronnya milyaran kali dalam satu detik.
Dipol sesaat pada suatu atom dapat mengimbas (menginduksi) atom yang berada di sekitarnya sehingga terjadi dipol terimbas. Hal tersebut yang menyebabkan terjadinya gaya tarik-menarik antara dipol sesaat dengan dipol terimbas.
Pergerakan elektron yang mengakibatkan dipol sesaat dalam suatu molekul akan bertambah besar apabila molekul tersebut memiliki jumlah elektron yang semakin besar pula. Jumlah elektron yang besar berkaitan dengan massa molekul relatif (Mr) molekul tersebut, sehingga semakin besar Mr suatu molekul, maka semakin besar polarisabilitasnya dan semakin besar pula Gaya Londonnya. Molekul dengan struktur panjang mempunyai kemungkinan lebih besar untuk mengalami dipol sesaat atau polarisabilitas. Hal ini dikarenakan molekul dengan struktur panjang mempunyai bidang yang lebih luas bila dibandingkan dengan molekul yang memiliki struktur lebih rapat dan kecil.
Kekuatan gaya London bergantung pada beberapa faktor, antara lain kerumitan molekul dan ukuran molekul.
Kerumitan molekul
[sunting | sunting sumber]Lebih banyak terdapat interaksi pada molekul kompleks dari molekul sederhana, sehingga gaya London lebih besar dibandingkan molekul sederhana. Semakin besar Mr semakin kuat gaya London.
Ukuran molekul
[sunting | sunting sumber]Molekul yang lebih besar mempunyai tarikan lebih besar daripada molekul berukuran kecil, sehingga mudah terjadi kutub listrik sesaat yang menimbulkan gaya London besar. Dalam satu golongan dari atas ke bawah, ukurannya bertambah besar, sehingga gaya Londonnya juga semakin besar.
Gaya London biasanya terjadi pada gas mulia yang mempunyai keelektronegatifan nol (stabil). Contohnya pada Neon, dimana gas Neon bisa dicairkan pada suhu yang tinggi atau rendah. Pada suhu yang sangat rendah atom-atom Neon akan saling berdekatan sehingga kestabilan elektronnya akan terganggu. Hal ini menyebabkan dalam atom Neon terbentuk dua kutub (dipol) antara molekul yang sama. Dipol ini membentuk ikatan sehingga Neon berubah menjadi cair. Dipol ini bersifat sementara, karena elektron selalu bergerak dalam orbital sehingga pada saat berikutnya dipol itu hilang.
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ H. Margenau, N Kestner, Theory of intermolecular forces, International Series of Monographs in Natural Philosophy, Pergamon Press
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "hydrogen bond".
Pranala luar
[sunting | sunting sumber]- Perangkat lunak untuk menghitung gaya antarmolekul
- Quantum 3.2 Diarsipkan 2017-09-14 di Wayback Machine.
- SAPT Diarsipkan 2023-04-19 di Wayback Machine.: An ab initio quantumchemical package
- intermolecular potential Diarsipkan 2014-03-28 di Wayback Machine.