Pewarnaan Ziehl–Neelsen

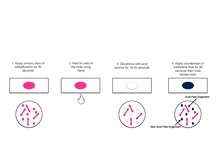
Pewarnaan Ziehl–Neelsen adalah salah satu jenis pewarnaan bakteri tahan asam (BTA), yang pertama kali diperkenalkan oleh Paul Ehrlich. Pewarnaan Ziehl–Neelsen adalah pewarnaan bakteriologis yang digunakan untuk mengidentifikasi organisme tahan asam, terutama jenis Mycobacterium. Pewarnaan ini dinamai dari dua dokter Jerman yang menyempurnakan metode: ahli bakteriologi Franz Ziehl (1859–1926) dan ahli patologi Friedrich Neelsen (1854–1898).
Bakteri anggota genus Mycobacterium adalah bakteri yang tumbuh lambat, berbentuk batang kecil yang sedikit melengkung atau lurus, dan dianggap sebagai Gram-positif. Beberapa jenis mikobakteria membentuk benang atau filamen. Beberapa mikobakteria adalah makhluk saprofit yang hidup bebas, tetapi banyak yang merupakan patogen yang menyebabkan penyakit pada hewan dan manusia. Mycobacterium bovis menyebabkan TBC pada sapi. Karena TBC dapat menular ke manusia, susu dipasteurisasi untuk membunuh semua bakteri yang ada.[1] Beberapa spesies mikobakteria yang menyebabkan penyakit pada manusia termasuk Mycobacterium leprae, Mycobacterium kansasii, Mycobacterium marinum, Mycobacterium bovis, Mycobacterium africanum serta Mycobacterium tuberculosis yang menyebakan tuberkulosis (TB). Mycobacterium tuberculosis adalah bakteri di udara yang biasanya menginfeksi paru-paru manusia.[2][3] Gejala TB meliputi batuk berat, nyeri dada, kelelahan, penurunan berat badan, tidak nafsu makan, kedinginan, demam, muntah darah dan berkeringat di malam hari.[4] Metode khusus untuk mengobati infeksi TB meliputi penggunaan isoniazid, rifapentin, dan rifampin. Metode akan diubah untuk penderita juga mempunyai alergi terhadap obat.[5] Uji penyakit TB meliputi uji darah, uji air liur, dan rontgen dada.[6] Sampel liur pasien diambil untuk uji TB melalui pewarnaan bakteri tahan asam. Organisme tahan asam seperti Mycobacterium mengandung sejumlah besar lilin dan zat lipid dalam dinding sel mereka yang disebut asam mikolat. Asam ini menghambat upaya pewarnaan dengan metode biasa seperti pewarnaan Gram.[7] Pewarnaan ini juga dapat digunakan untuk mewarnai beberapa bakteri lain, seperti Nocardia. Reagen yang digunakan untuk pewarnaan Ziehl-Neelsen adalah karbol fuchsin, alkohol asam, dan metilena biru. Spesimen bakteri tahan asam akan berwarna merah cerah setelah pewarnaan.
Jamur
[sunting | sunting sumber]Pewarnaan Ziehl–Neelsen juga dapat membantu dalam membedakan dan mengidentifikasi jamur.[8] Hasil pewarnaan ZIehl-Neelsen bervariasi karena banyak dinding sel jamur tidak tahan asam.[9] Contoh dari jamur tahan asam yang biasanya diwarnai dengan pewarnaan Ziehl-Neelsen adalah Histoplasma (HP).[10] Histoplasma ditemukan di tanah dan kotoran burung serta kelelawar.[11] Manusia dapat menderita histoplasmosis ketika menghirup spora jamur ini. Spora akan memasuki tubuh dan menuju paru-paru di mana ia mulai berkembang menjadi semacam ragi.[12] Jamur akan masuk ke aliran darah dan mempengaruhi kelenjar getah bening dan bagian tubuh lainnya. Biasanya orang tidak sakit parah karena menghirup spora, tetapi akan menunjukkan gejala flu.[13]
Pewarnaan Ziehl–Neelsen juga berguna dalam identifikasi beberapa protozoa parasit, seperti Cryptosporidium dan Isospora.
Sejarah
[sunting | sunting sumber]Pada tahun 1882 Robert Koch menemukan penyebab penyakit mematikan tuberkulosis.[14] Segera setelah penemuan Koch, Paul Ehrlich mengembangkan pewarnaan untuk Mycobacterium tuberculosis, yang disebut pewarnaan tawas hematoksilin.[15] Franz Ziehl kemudian mengubah teknik pewarnaan Ehrlich dengan menambahkan larutan asam dalam alkohol sebagai mordan. Friedrich Neelsen mempertahankan penggunaan mordan, tetapi mengubah pewarna utama menjadi karbol fuchsin. Modifikasi Ziehl dan Neelsen secara bersama-sama telah mengembangkan metode pewarnaan Ziehl-Neelsen. Pewarnaan bakteri tahan asam lainnya dikembangkan oleh Joseph Kinyoun dengan menggunakan teknik pewarnaan Ziehl-Neelsen tetapi tanpa prosedur pemanasan. Pewarnaan baru dari Kinyoun ini dinamai pewarnaan Kinyoun atau disebut juga "Ziehl-Neelsen dingin".
Mekanisme
[sunting | sunting sumber]
Awalnya, pemberian karbol fuchsin akan mewarnai semua sel bakteri, baik BTA (tahan asam) maupun BTTA (tidak tahan asam). Pemanasan bertujuan untuk membuka lapisan lilin dan asam mikolat yang ada pada dinding sel BTA. Ketika dicelupkan ke asam-alkohol, hanya BTA yang mempertahankan zat warna. Sementara BTTA melepas pewarna dan jadi tak berwarna. Untuk mewarnai bakteri BTTA, diberikan pewarna tambahan seperti malasit hijau atau metilena biru, sehingga bakteri BTA akan berwarna merah, sementara BTTA tampak biru atau hijau ketika diamati dengan mikroskop.
Referensi
[sunting | sunting sumber]- ^ Sandman, Kathleen, Joanne Willey, and Dorothy Wood. Prescott’s Microbiology. 11th ed. New York, NY: McGraw-Hill Higher Education, 2020. Print. p. 541
- ^ Centers for Disease Control and Prevention. Basic TB Facts. March 11, 2016. https://www.cdc.gov/tb/topic/basics/default.htm
- ^ Centers for Disease Control and Prevention. How TB Spreads. March 11, 2016. https://www.cdc.gov/tb/topic/basics/howtbspreads.htm
- ^ Centers for Disease Control and Prevention. Signs & Symptoms. March 11, 2016. https://www.cdc.gov/tb/topic/basics/signsandsymptoms.htm
- ^ Centers for Disease Control and Prevention. Treatment Regimens for Latent TB Infection (LTBI). March 11, 2016. https://www.cdc.gov/tb/topic/treatment/ltbi.htm
- ^ Centers for Disease Control and Prevention. Testing & Diagnosis. March 11, 2016. https://www.cdc.gov/tb/topic/testing/default.htm
- ^ Morello, Josephine A., Paul A. Granato, Marion E. Wilson, and Verna Morton. Laboratory Manual and Workbook in Microbiology: Applications to Patient Care. 10th ed. Boston: McGraw-Hill Higher Education, 2006. Print.[halaman dibutuhkan]
- ^ Veerappan, R., Miller, L. E., Sosinski, C., & Youngberg, G. A. (2006) Narrow‐spectrum staining pattern of Pityrosporum. Journal of Cutaneous Pathology: November 2006, Vol. 33, No. 11, pp. 731-734.
- ^ Haque, A. (2010). Special Stains Use in Fungal Infections. Connection: 187-194
- ^ Rajeshwari, M., Xess, I., Sharma, M. C., & Jain, D. (2017). Acid-Fastness of Histoplasma in Surgical Pathology Practice. Journal of pathology and translational medicine, 51(5), 482–487. doi:10.4132/jptm.2017.07.11
- ^ Centers for Disease Control and Prevention. Histoplasmosis. August 13, 2018. https://www.cdc.gov/fungal/diseases/histoplasmosis/index.html.
- ^ Centers for Disease Control and Prevention. Sources of Histoplasmosis. February 11, 2019. https://www.cdc.gov/fungal/diseases/histoplasmosis/causes.html
- ^ Centers for Disease Control and Prevention. Symptoms of Histoplasmosis. August 13, 2018. https://www.cdc.gov/fungal/diseases/histoplasmosis/symptoms.html
- ^ DiNardo, Andrew R.; Lange, Christoph; Mandalakas, Anna M. (1 May 2016). "Editorial Commentary: 1, 2, 3 (Years) … and You're Out: The End of a 123-year Historic Era". Clinical Infectious Diseases. 62 (9): 1089–1091. doi:10.1093/cid/ciw041. PMID 26839384.
- ^ Singhal, Ritu; Myneedu, Vithal Prasad (Maret 2015). "Microscopy as a diagnostic tool in pulmonary tuberculosis". International Journal of Mycobacteriology. 4 (1): 1–6. doi:10.1016/j.ijmyco.2014.12.006. PMID 26655191.
- ^ "Online Microbiology Notes". Online Microbiology Notes. Diakses tanggal 2017-11-29.
- ^ "Home – microbeonline". microbeonline.com. Diakses tanggal 2017-11-29.
- ^ Kumar, Surinder (2012). Textbook of Microbiology. hlm. 315.
Pranala luar
[sunting | sunting sumber] Media tentang Pewarnaan Ziehl-Neelsen di Wikimedia Commons
Media tentang Pewarnaan Ziehl-Neelsen di Wikimedia Commons
