2-Butanol
| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
Butan-2-ol[2] | |
| Nama lain | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Referensi Beilstein | 773649 1718764 (R) |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Nomor EC | |
| Referensi Gmelin | 1686 396584 (R) |
| MeSH | 2-butanol |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII |
|
| Nomor UN | 1120 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C4H10O | |
| Massa molar | 74,12 g·mol−1 |
| Densitas | 0,808 g cm−3 |
| Titik lebur | −115 °C; −175 °F; 158 K |
| Titik didih | 98 hingga 100 °C; 208 hingga 212 °F; 371 hingga 373 K |
| 290 g/L[3] | |
| log P | 0,683 |
| Tekanan uap | 1,67 kPa (pada 20 °C) |
| Keasaman (pKa) | 17,6 [4] |
| −5,7683×10−5 cm3 mol−1 | |
| Indeks bias (nD) | 1,3978 (pada 20 °C) |
| Termokimia | |
| Kapasitas kalor (C) | 197,1 J K−1 mol−1 |
| Entropi molar standar (S |
213,1 J K−1 mol−1 |
| Entalpi pembentukan standar (ΔfH |
−343,3 to −342,1 kJ mol−1 |
| Entalpi pembakaran standar ΔcH |
−2,6611 to −2,6601 MJ mol−1 |
| Bahaya | |
| Lembar data keselamatan | inchem.org |
| Piktogram GHS |  
|
| Keterangan bahaya GHS | {{{value}}} |
| H226, H319, H335, H336 | |
| P261, P305+351+338 | |
| Titik nyala | 22 hingga 27 °C (72 hingga 81 °F; 295 hingga 300 K) |
| 405 °C (761 °F; 678 K) | |
| Ambang ledakan | 1,7–9,8% |
| Dosis atau konsentrasi letal (LD, LC): | |
LCLo (terendah tercatat)
|
16000 ppm (tikus, 4 hr) 10670 ppm (mencit, 3,75 hr) 16000 ppm (mencit, 2,67 hr)[5] |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
TWA 150 ppm (450 mg/m3)[5] |
REL (yang direkomendasikan)
|
TWA 100 ppm (305 mg/m3) ST 150 ppm (455 mg/m3)[5] |
IDLH (langsung berbahaya)
|
2000 ppm[5] |
| Senyawa terkait | |
Related butanols
|
n-Butanol Isobutanol tert-Butanol |
Senyawa terkait
|
Butanon |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
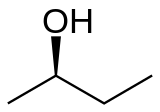
2-Butanol, atau sec-butanol, adalah senyawa organik dengan rumus kimia CH3CH(OH)CH2CH3. Alkohol sekunder ini berupa cairan tak berwarna yang mudah terbakar dan dapat bercampur dengan air (perbandingan 2-butanol:air = 1:3), dan bercampur sempurna dengan pelarut organik. 2-Butanol ini diproduksi dalam skala besar, terutama sebagai prekursor untuk metil etil keton, suatu pelarut industri. 2-Butanol bersifat kiral sehingga dapat diperoleh sebagai dua stereoisomer yang disimbolkan sebagai (R)-(−)-2-butanol dan (S)-(+)-2-butanol. Normalnya dijumpai sebagai campuran kedua stereoisomer tersebut dengan perbandingan 1:1 — suatu campuran rasemat.
 |

|
 |

|
| (R)-(−)-2-butanol | (S)-(+)-2-butanol |
Pabrikasi dan pembuatan
[sunting | sunting sumber]2-Butanol dibuat secara industri dengan hidrasi 1-butena atau 2-butena:
Asam sulfat digunakan sebagai katalis untuk konversi ini.[6]
Dalam skala laboratorium, ia dapat dibuat melalui reaksi Grignard dengan mereaksikan etilmagnesium bromida dengan asetildehida dalam dietil eter kering atau tetrahidrofuran (THF).
Meskipun beberapa 2-butanol digunakan sebagai pelarut, ia utamanya diubah menjadi butanon (metil etil keton, MEK), suatu pelarut industri yang penting dan ditemukan dalam banyak pembersih rumah tangga dan penghilang cat. Meskipun penghilang cat sudah mulai menghindari pemakaian MEK karena masalah kesehatan dan legalitas baru. Ester volatil dari 2-butanol memiliki aroma yang harum dan dalam jumlah yang kecil digunakan sebagai parfum atau perisa buatan.[6]
Kelarutan
[sunting | sunting sumber]Kelarutan 2-butanol yang dicantumkan seringkali tidak tepat,[3] termasuk beberapa referensi yang sangat terkenal seperti Merck Index, CRC Handbook of Chemistry and Physics, dan Lange's Handbook of Chemistry. Bahkan International Programme on Chemical Safety mencantumkan juga kelarutan yang salah. Kesalahan berjamaah disebabkan oleh Beilstein's Handbuch der Organischen Chemie (Handbook of Organic Chemistry). Karya ini menyantumkan kelarutan yang salah yaitu 12,5 g/100 g air. Banyak sumber lain menggunakan kelarutan ini, yang telah menggelinding bagaikan bola salju menjadi kesalahan massal di dunia industri. Data yang benar (35,0 g/100 g pada 20 °C, 29 g/100 g pada 25 °C, dan 22 g/100 g pada 30 °C) pertama kali dipublikasikan pada tahun 1886 oleh Alexejew dan data yang serupa dilaporkan oleh ilmuwan lain termasuk Dolgolenko dan Dryer berturut-turut pada tahun 1907 dan 1913.
Pencegahan
[sunting | sunting sumber]Seperti butanol lainnya, 2-butanol memiliki toksisitas aku yang rendah. LD50nya adalah 4400 mg/kg (tikus, oral).[6]
Beberapa kejadian ledakan telah dilaporkan[7][8][9] selama distilasi konvensional 2-butanol, nampaknya akibat dari penumpukan peroksida dengan titik didih yang lebih tinggi dari pada alkohol murni (sehingga terkonsentrasi pot penampung selama distilasi). Oleh karena alkohol, tidak seperti eter, tidak diketahui mampu membentuk peroksida renik, bahayanya menjadi terabaikan. 2-Butanol adalah Bahan Kimia Pembentuk Peroksida Kelas B (Class B Peroxide Forming Chemicals).[10]
Referensi
[sunting | sunting sumber]- ^ "Alcohols Rule C-201.1". Nomenclature of Organic Chemistry (The IUPAC 'Blue Book'), Sections A, B, C, D, E, F, and H. Oxford: Pergamon Press. 1979.
Penamaan seperti isopropanol, sec-butanol, dan tert-butanol tidak benar karena tidak ada hidrokarbon isopropana, sec-butana, dan tert-butana yang dapat diberi akhiran "-ol"; nama-nama seperti itu harus ditinggalkan. Akan tetapi, isopropil alkohol, sec-butil alkohol, dan tert-butil alkohol diperbolehkan (lihat Aturan C-201.3) karena radikal isopropil, sec-butil, dan tert-butil memang ada
- ^ "2-butanol - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 26 March 2005. Identification and Related Records. Diakses tanggal 12 October 2011.
- ^ a b Alger, Donald B. (November 1991). "The water solubility of 2-butanol: A widespread error". Journal of Chemical Education. 68 (11): 939. doi:10.1021/ed068p939.1.
- ^ Serjeant, E.P., Dempsey B.; Ionisation Constants of Organic Acids in Aqueous Solution. International Union of Pure and Applied Chemistry (IUPAC). IUPAC Chemical Data Series No. 23, 1979. New York, New York: Pergamon Press, Inc., p. 989
- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0077". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Hahn, Heinz-Dieter; Dämbkes, Georg; Rupprich, Norbert (2005), "Butanols", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH.
- ^ Doyle, R. R. (1986). "2-Butanol safety warning". Journal of Chemical Education. 63 (2): 186. doi:10.1021/ed063p186.2
 .
.
- ^ Peterson, Donald (11 May 1981). "Letters: Explosion of 2-butanol". Chemical & Engineering News. 59 (19): 3. doi:10.1021/cen-v059n019.p002
 .
.
- ^ Watkins, Kenneth W. (May 1984). "Demonstration hazard". Journal of Chemical Education. 61 (5): 476. doi:10.1021/ed061p476.3
 .
.
- ^ "Classification List of Peroxide Forming Chemicals". ehs.ucsc.edu.

