Ikatan polar molekul anorganik
Ikatan polar molekul anorganik adalah ikatan yang umumnya disebabkan oleh adanya perbedaan keelektronegatifan pada molekul anorganik. Ikatan polar dapat terjadi pada senyawa yang memiliki ikatan ion (ikatan yang terjadi akibat adanya serah terima pasangan elektron) ataupun ikatan kovalen (ikatan yang terjadi akibat adanya pemakaian bersama pasangan elektron). Selain keelektronegatifan, terdapat beberapa faktor lain yang menyebabkan suatu molekul bersifat polar seperti momen dipol, momen ikatan, momen pasangan elektron bebas, kation, anion, serta konfigurasi elektron. Faktor-faktor tersebut merupakan faktor yang disebabkan karena keberadaan molekul itu sendiri. Selain itu, ternyata keberadaan molekul tetangga dapat menyebabkan timbulnya sifat polar. Hal ini dijelaskan melalui gaya antarmolekul yang terjadi dalam molekul tersebut.
Kepolaran yang disebabkan karena keberadaan diri molekul
[sunting | sunting sumber]Kepolaran senyawa kovalen
[sunting | sunting sumber]Keelektronegatifan
[sunting | sunting sumber]Menurut Linus Pauling, keelektronegatifan merupakan kemampuan suatu atom untuk menarik elektron-elektron dari atom lain ke dalam dirinya sendiri dalam suatu molekul.[1]

Dalam suatu senyawa, apabila atom-atomnya memiliki perbedaan nilai keelektronegatifan maka akan terbentuk ikatan kovalen polar. Ikatan ini terbentuk karena atom yang lebih elektropositif akan kekurangan rapatan elektron sehingga atom yang elektropositif tersebut akan menghasilkan muatan parsial positif (δ+). Sedangkan atom yang lebih elektronegatif akan menghasilkan muatan parsial negatif (δ- ). Muatan parsial ini akan menyebabkan timbulnya momen ikatan yang mempunyai arah dari muatan parsial positif ke muatan parsial negatif. Momen ikatan ini dapat terjadi karena perbedaan keelektronegatifan di antara dua atom yang berikatan. Sebagai contoh, momen ikatan yang terjadi pada molekul HCl.

Pengaruh momen dipol dalam kepolaran molekul anorganik
[sunting | sunting sumber]Momen dipol (µ) merupakan jumlah vektor dari momen ikatan dan momen pasangan elektron bebas dalam suatu molekul.[2] Molekul dikatakan bersifat polar jika memiliki µ > 0 atau µ ≠ 0 dan dikatakan bersifat nonpolar jika memiliki µ = 0 .
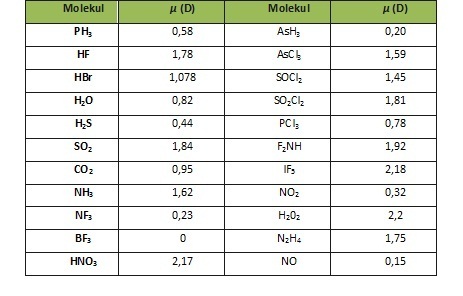
Molekul yang memiliki atom yang sama seperti Cl2, Br2, I2, dan H2 bersifat nonpolar karena molekul tersebut tidak memiliki momen ikatan maupun maupun momen pasangan elektron bebas (PEB) sehingga momen dipolnya bernilai 0. Tidak hanya molekul dengan atom-atom yang sama, pada molekul yang memiliki atom-atom yang berbeda pun dapat bersifat nonpolar. Misalnya pada molekul PCl5,CO2,SF6, dan COCl2. Pada molekul CO2, muatan parsial positif terdapat pada atom karbon sedangkan muatan parsial negatif terdapat pada atom oksigen, sehingga momen ikatan pada CO2 memiliki arah dari atom C yang bermuatan parsial positif ke atom O yang bermuatan parsial negatif. Momen ikatan pada molekul ini akan saling meniadakan, akibatnya momen dipolnya bernilai nol. Sehingga molekul ini dapat dikatakan sebagai molekul nonpolar.

Molekul H2O bersifat polar karena memiliki momen dipol yang bernilai 1,84 D. Nilai momen dipol ini didapatkan berdasarkan jumlah vektor dari momen ikatan H-O dan momen PEB. Atom O lebih elektronegatif daripada atom H sehingga arah momen ikatan O-H akan mengarah ke atom O. Sedangkan untuk arah momen pasangan elektron bebas mengarah dari atom O menuju ke pasangan elektron bebas. Momen ikatan dan momen H20 dapat dilihat pada gambar di bawah ini.

Pengaruh arah momen elektron ikatan dan momen pasangan elektron bebas terhadap kepolaran molekul anorganik
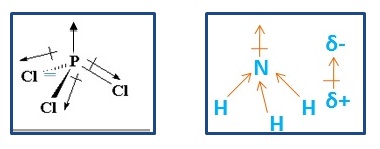
[sunting | sunting sumber]Momen pasangan elektron bebas dan momen ikatan yang searah akan memiliki tingkat kepolaran yang lebih tinggi dibandingkan dengan yang berlawanan arah . Contohnya, NH3 dan PCl3 sama-sama bersifat polar, namun tingkat kepolarannya berbeda. Pada molekul NH3, momen ikatan N-H dan momen pasangan elektron bebas memiliki arah yang searah, sedangkan pada molekul PCl3 memiliki momen ikatan dan momen pasangan elektron bebas yang berlawanan arah, sehingga kepolaran NH3 lebih tinggi daripada PCl3.
Kepolaran senyawa ion
[sunting | sunting sumber]Pada umumnya, senyawa yang terbentuk akibat penggabungan antara logam dengan nonlogam memiliki sifat senyawa ionik. Akan tetapi, tidak semua senyawa dari penggabungan ini bersifat ionik. Senyawa ini dapat lebih mengarah ke sifat kovalen ketika elektron terluar dari anion ditarik kuat oleh kation, sehingga rapatan anion akan mengalami distorsi/penyimpangan terhadap kation.[3] Distorsi ini dapat dilihat dari rapatan elektron yang mulanya digambarkan seperti bola akan menjadi lonjong (elektron terluar dari anion ditarik kuat oleh kation). Akibat dari distorsi ini maka senyawa yang mulanya bersifat ionik akan berubah menjadi kovalen dan akan terjadi polarisasi. Semakin besar sifat polarisasinya maka semakin besar pula derajat ikatan kovalensinya. Menurut Kasimir Fajans, ahli kimia, terdapat beberapa aturan perihal polarisasi tersebut, antara lain:
- Suatu kation akan lebih mudah mengalami polarisasi ketika ukuran kation tersebut kecil dengan muatan positif yang besar
- Mn2O7 memiliki muatan positif lebih besar dibandingkan dengan muatan positif pada MnO sehingga Mn2O7 lebih bersifat kovalen polar daripada bersifat ionik.
- Suatu anion akan lebih mudah mengalami polarisasi ketika ukuran dan muatan negatif yang dimiliki anion tersebut besar.
- AlI3 memiliki muatan negatif yang sama namun dengan ukuran anion yang lebih besar jika dibandingkan dengan AlF3 sehingga AlI3 lebih mengarah untuk membentuk ikatan kovalen yang polar dibandingkan dengan AlF3 yang tidak bersifat polar.
- Kation yang tidak memiliki konfigurasi gas mulia lebih mudah mengalami polarisasi.
- Kation K+ pada senyawa KCl memiliki konfigurasi gas mulia yaitu [Ar] sedangkan kation Ag+ pada AgCl tidak memiliki konfigurasi gas mulia yaitu [Kr]4d10, sehingga kation Ag+ lebih mudah mengalami polarisasi daripada kation K+.
Kepolaran yang disebabkan keberadaan molekul tetangganya
[sunting | sunting sumber]Molekul nonpolar dengan molekul nonpolar
[sunting | sunting sumber]Suatu molekul monoatomik yang bersifat nonpolar akan menghasilkan muatan positif dan muatan negatif yang berimpit akibat pergerakan distribusi rata-rata inti atom dan elektron di sekitar inti. Rapatan elekton dari molekul tersebut berupa bola yang simetri.

Keadaan elektron yang selalu bergerak menyebabkan polarisasi rapatan elektron dan penyimpangan dari simetri bola. Sehingga pusat muatan positif dan muatan negatif memisah(berbentuk lonjong) dan molekul tersebut dikatakan memiliki dipol sesaat (temporary dipole)

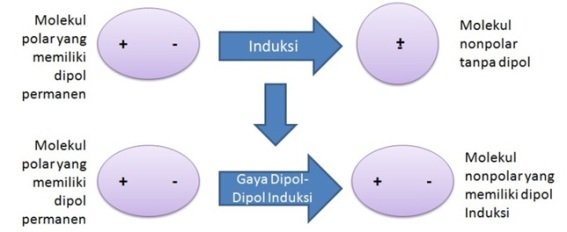
Jika di dekat molekul yang memiliki dipol sesaat terdapat molekul nonpolar, molekul yang memilki dipol sesaat akan menginduksi (dipol induksi) molekul nonpolar tersebut. Akibat adanya dipol sesaat dan dipol induksian tersebut maka akan terbentuk gaya elektrostatik atau yang disebut gaya London di antara kedua molekul tersebut.

Kemampuan polarisasi atau polarizabilities molekul dinyatakan dengan simbol α. Pada molekul-molekul dengan bentuk yang sama, bertambahnya massa molekul akan menyebabkan bertambahnya jumlah elektron. Hal ini menyebabkan pengaruh inti atom terhadap awan elektron yang semakin lemah, sehingga akan mudah dipolarisasi dan gaya London yang terjadi pun akan semakin kuat. Gaya London yang semakin kuat menyebabkan proses peleburan dan pendidihan molekul-molekul yang terlibat dalam gaya tersebut memerlukan energi yang besar untuk memperbesar jarak antarmolekul nonpolar.
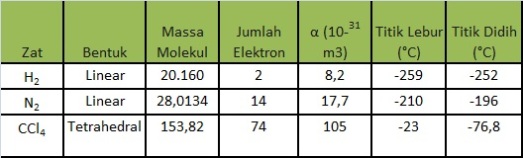
Selain itu, akibat dari gaya London juga menyebabkan molekul nonpolar dapat larut dalam pelarut non polar. Misalnya, senyawa BI3 yang mempunyai kemampuan polarisasi yang tinggi akan larut dalam senyawa CCl4 yang juga mempunyai kemampuan polarisasi yang tinggi.
Molekul polar dengan molekul nonpolar
[sunting | sunting sumber]Molekul polar yang memiliki dipol permanen akan menginduksi molekul nonpolar yang tidak memiliki dipol, sehingga akan terjadi gaya elektrostatik di antara keduanya atau yang disebut gaya dipol-dipol induksi. Gaya ini menyebabkan senyawa nonpolar dapat larut atau sedikit larut dalam pelarut polar. Misalnya, gaya dipol-dipol induksi antara H2O yang bersifat polar dan O2 yang bersifat nonpolar akan menyebabkan O2 dapat larut sedikt dalam H2O (gas O2 yang dilarutkan dalam 100 gram air memiliki kelarutan 0,006945 pada suhu 0 °C).[4]
Molekul polar dengan molekul polar
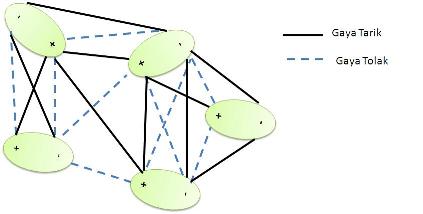
[sunting | sunting sumber]Ketika molekul yang polar berdekatan dengan molekul yang polar, maka akan timbul gaya elektrostatik di antara keduanya. Gaya ini disebut gaya dipol-dipol. Melalui gaya ini, zat terlarut yang bersifat polar dapat larut dalam pelarut polar yang mempunyai konstanta dielektrik yang besar.

Molekul-molekul polar yang berada dalam fase cair, pusat muatan negatif akan berdekatan dengan pusat muatan positif, begitu pun sebaliknya. Peristiwa ini menyebabkan gaya tarik antar molekul akan lebih kuat daripada gaya tolaknya.
Referensi
[sunting | sunting sumber]- ^ House, J. E dan Kathleen A. House. (2010) Descriptive Inorganic Chemistry Second Edition, p. 64
- ^ Effendy. (2008) Teori VSEPR, Kepolaran, dan Gaya Antarmolekul, p. 159
- ^ Rayner, Geoff dan Tina Overton (2010). Descriptive Inorganic Chemistry Fifth Edition, p.96
- ^ House, J. E. (2008). Inorganic Chemistry, p. 187
Daftar pustaka
[sunting | sunting sumber]- Effendy. (2008). Teori VSEPR, Kepolaran, dan Gaya Antarmolekul. Malang: Bayumedia Publishing. ISBN 979-3323-06-4.
- House, J. E. (2008). Inorganic Chemistry. USA: Academic Press. ISBN 978-0-12-356786-4.
- House, J. E dan Kathleen A. House (2010). Descriptive Inorganic Chemistry Second Edition. Oxford: Elsevie Inc. ISBN 978-0-12-088755-2
- J.Gillespie, R dan Paul L.A.Popelier. (2001). Chemical Bonding and Molecular Geometry. New York: Oxford University Press. ISBN 0-19-510496-X (ppk), 0-19-510495-1 (cloth).
- James E, H,dkk. (1993). Inorganic Chemistry Principle of Structure and Reactivity Fourth Edition. New York: Harpen Collins College Publishers . ISBN 0-06-042995-X
- Nelson, P. G. (2011). Introduction To Inorganic Chemistry. Ventus Publishing Aps. ISBN 979-3323-06-4
- Rayner, Geoff dan Tina Overton (2010). Descriptive Inorganic Chemistrym Fifth Edition. New York: W.H. Freeman and Company. ISBN-13: 978-1-4292-2434-5 dan ISBN-10: 1-4292-1814-2.
- Shriver dan Atkins. (2010). Inorganic Chemistry Fifth Edition. Oxford University Press: New York. ISBN 978-1-42-921820-7.
Pranala luar
[sunting | sunting sumber]- D.C. Krause (2000). Intermolecular Forces. Retrieved December 1, 2011.
