Potensial elektrode: Perbedaan antara revisi
Baru |
k Bot: Perubahan kosmetika |
||
| Baris 1: | Baris 1: | ||
'''Potensial elektroda''', ''E'', dalam [[kimia]] atau [[elektrokimia]], menurut definisi [[International Union of Pure and Applied Chemistry|IUPAC]],<ref>IUPAC. [[Compendium of Chemical Terminology]], 2nd ed. (the "Gold Book"). Dikompilasi oleh A. D. McNaught dan A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versi terkoreksi daring XML: http://goldbook.iupac.org (2006–) dibuat oleh M. Nic, J. Jirat, B. Kosata; pembaharuan dikompilasi oleh A. Jenkins. {{ISBN|0-9678550-9-8}}. {{doi|10.1351/goldbook}}. |
'''Potensial elektroda''', ''E'', dalam [[kimia]] atau [[elektrokimia]], menurut definisi [[International Union of Pure and Applied Chemistry|IUPAC]],<ref>IUPAC. [[Compendium of Chemical Terminology]], 2nd ed. (the "Gold Book"). Dikompilasi oleh A. D. McNaught dan A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versi terkoreksi daring XML: http://goldbook.iupac.org (2006–) dibuat oleh M. Nic, J. Jirat, B. Kosata; pembaharuan dikompilasi oleh A. Jenkins. {{ISBN|0-9678550-9-8}}. {{doi|10.1351/goldbook}}. [http://goldbook.iupac.org/E01956.html Entry: "Electrode Potential"].</ref> adalah [[gaya gerak listrik]] (GGL, ''electromotive force'' atau EMF) dari suatu [[sel galvani|sel]] yang dibangun dari dua [[elektroda]]:<ref>{{cite book|editor=Zoski, C. G. |title=Handbook of Electrochemistry |publisher=[[Elsevier]] |year=2006 |isbn=9780444519580 |language=en |location=Boston, MA |oclc=162129983}}</ref> |
||
* di sisi kiri diagram sel adalah [[elektroda hidrogen standar]] (SHE), dan |
* di sisi kiri diagram sel adalah [[elektroda hidrogen standar]] (SHE), dan |
||
* di sisi kanan adalah elektroda yang dimaksud. |
* di sisi kanan adalah elektroda yang dimaksud. |
||
SHE didefinisikan memiliki potensial 0 [[volt|V]], sehingga potensial sel bertanda dari pengaturan di atas adalah<ref name=Sawyer /> |
SHE didefinisikan memiliki potensial 0 [[volt|V]], sehingga potensial sel bertanda dari pengaturan di atas adalah<ref name=Sawyer /> |
||
:''E''<sub>sel</sub> = ''E''<sub>kiri (SHE)</sub> − |
:''E''<sub>sel</sub> = ''E''<sub>kiri (SHE)</sub> − ''E''<sub>kanan</sub> = 0 V − ''E''<sub>elektroda</sub> = ''E''<sub>elektroda</sub>. |
||
SHE adalah [[katoda]] dan elektroda adalah [[anoda]]. |
SHE adalah [[katoda]] dan elektroda adalah [[anoda]]. |
||
| Baris 12: | Baris 12: | ||
Potensial elektroda adalah [[potensial listrik]] pada komponen elektroda. Dalam sel, terdapat potensial elektroda untuk katoda dan potensial elektroda untuk anoda. Perbedaan antara dua potensial elektroda sama dengan potensial sel:<ref name=Sawyer>{{cite book|author=Sawyer, D. T., Sobkowiak, A. & Roberts, J. L. |title=Electrochemistry for Chemists |edition=2 |publisher=Wiley |year=1995 |isbn=9780471594680 |language=en |location=Hoboken, NJ}}</ref> |
Potensial elektroda adalah [[potensial listrik]] pada komponen elektroda. Dalam sel, terdapat potensial elektroda untuk katoda dan potensial elektroda untuk anoda. Perbedaan antara dua potensial elektroda sama dengan potensial sel:<ref name=Sawyer>{{cite book|author=Sawyer, D. T., Sobkowiak, A. & Roberts, J. L. |title=Electrochemistry for Chemists |edition=2 |publisher=Wiley |year=1995 |isbn=9780471594680 |language=en |location=Hoboken, NJ}}</ref> |
||
:''E''<sub>sel</sub> = |
:''E''<sub>sel</sub> = ''E''<sub>katoda</sub> − ''E''<sub>anoda</sub>. |
||
Potensial elektroda yang diukur dapat berupa yang terdapat pada [[kesetimbangan termodinamika|kesetimbangan]] pada elektroda kerja ("potensial reversibel"), atau potensial dengan reaksi bersih non-nol pada elektroda kerja tetapi arus bersih nol ("potensial [[korosi]]",<ref>{{cite web|url=https://www.gamry.com/application-notes/corrosion-coatings/basics-of-electrochemical-corrosion-measurements/|title=Getting Started with Electrochemical Corrosion Measurement: Review of the Electrochemical Basis of Corrosion |accessdate=13 Januari 2017 |website=Gamry Instruments|language=en}}</ref> "potensial campuran"), atau potensial dengan arus bersih non-nol pada elektroda kerja (seperti dalam [[korosi Galvani]] atau [[voltametri]]). Potensi reversibel terkadang dapat dikonversi menjadi [[potensial elektroda standar]] untuk spesi elektroaktif tertentu dengan mengekstrapolasi nilai terukur ke [[keadaan standar]]. |
Potensial elektroda yang diukur dapat berupa yang terdapat pada [[kesetimbangan termodinamika|kesetimbangan]] pada elektroda kerja ("potensial reversibel"), atau potensial dengan reaksi bersih non-nol pada elektroda kerja tetapi arus bersih nol ("potensial [[korosi]]",<ref>{{cite web|url=https://www.gamry.com/application-notes/corrosion-coatings/basics-of-electrochemical-corrosion-measurements/|title=Getting Started with Electrochemical Corrosion Measurement: Review of the Electrochemical Basis of Corrosion |accessdate=13 Januari 2017 |website=Gamry Instruments|language=en}}</ref> "potensial campuran"), atau potensial dengan arus bersih non-nol pada elektroda kerja (seperti dalam [[korosi Galvani]] atau [[voltametri]]). Potensi reversibel terkadang dapat dikonversi menjadi [[potensial elektroda standar]] untuk spesi elektroaktif tertentu dengan mengekstrapolasi nilai terukur ke [[keadaan standar]]. |
||
| Baris 21: | Baris 21: | ||
== Pengukuran == |
== Pengukuran == |
||
[[Berkas:Three electrode setup.png|jmpl| |
[[Berkas:Three electrode setup.png|jmpl|ka|Pengaturan tiga-elektroda untuk pengukuran potensial elektroda]] |
||
Pengukuran umumnya dilakukan menggunakan pengaturan tiga elektroda (lihat gambar):<ref>{{cite book |author=Bard, A. J. & Faulkner, L. R. |title=Electrochemical Methods: Fundamentals and Applications |edition=2 |publisher=Wiley |year=2001 |isbn=9780471043720 |location=Hoboken, NJ}}</ref> |
Pengukuran umumnya dilakukan menggunakan pengaturan tiga elektroda (lihat gambar):<ref>{{cite book |author=Bard, A. J. & Faulkner, L. R. |title=Electrochemical Methods: Fundamentals and Applications |edition=2 |publisher=Wiley |year=2001 |isbn=9780471043720 |location=Hoboken, NJ}}</ref> |
||
# elektroda kerja, |
# elektroda kerja, |
||
| Baris 34: | Baris 34: | ||
Potensial sel yang dirakit dari dua elektroda dapat ditentukan dari dua potensial elektroda individu yang digunakan |
Potensial sel yang dirakit dari dua elektroda dapat ditentukan dari dua potensial elektroda individu yang digunakan |
||
:Δ''V''<sub>sel</sub> = |
:Δ''V''<sub>sel</sub> = ''E''<sub>red,katoda</sub> − ''E''<sub>red,anoda</sub> |
||
atau, setara dengan, |
atau, setara dengan, |
||
:Δ''V''<sub>sel</sub> = |
:Δ''V''<sub>sel</sub> = ''E''<sub>red,katoda</sub> + ''E''<sub>oks,anoda</sub>. |
||
Hal ini mengikuti definisi IUPAC mengenai perbedaan [[potensial listrik]] dari sel galvanik,<ref>IUPAC Gold Book. Definition of the potential difference of a galvanic cell. |
Hal ini mengikuti definisi IUPAC mengenai perbedaan [[potensial listrik]] dari sel galvanik,<ref>IUPAC Gold Book. Definition of the potential difference of a galvanic cell. http://goldbook.iupac.org/E01934.html.</ref> di mana perbedaan potensial listrik sel adalah perbedaan dari potensial elektroda di sebelah kanan dan kiri sel galvanik. Ketika Δ''V''<sub>sel</sub> bernilai positif, maka [[muatan listrik]] positif mengalir melalui sel dari elektroda kiri ([[anoda]]) ke elektroda kanan ([[katoda]]). |
||
== Lihat pula == |
== Lihat pula == |
||
Revisi per 11 Agustus 2018 17.11
Potensial elektroda, E, dalam kimia atau elektrokimia, menurut definisi IUPAC,[1] adalah gaya gerak listrik (GGL, electromotive force atau EMF) dari suatu sel yang dibangun dari dua elektroda:[2]
- di sisi kiri diagram sel adalah elektroda hidrogen standar (SHE), dan
- di sisi kanan adalah elektroda yang dimaksud.
SHE didefinisikan memiliki potensial 0 V, sehingga potensial sel bertanda dari pengaturan di atas adalah[3]
- Esel = Ekiri (SHE) − Ekanan = 0 V − Eelektroda = Eelektroda.
SHE adalah katoda dan elektroda adalah anoda.
Asal dan interpretasi
Potensial elektroda muncul pada antarmuka antara elektroda dan elektrolit karena transfer spesi bermuatan melintasi antarmuka, adsorpsi ion spesifik pada antarmuka, dan adsorpsi/orientasi spesifik molekul polar, termasuk yang ada pada pelarut.
Potensial elektroda adalah potensial listrik pada komponen elektroda. Dalam sel, terdapat potensial elektroda untuk katoda dan potensial elektroda untuk anoda. Perbedaan antara dua potensial elektroda sama dengan potensial sel:[3]
- Esel = Ekatoda − Eanoda.
Potensial elektroda yang diukur dapat berupa yang terdapat pada kesetimbangan pada elektroda kerja ("potensial reversibel"), atau potensial dengan reaksi bersih non-nol pada elektroda kerja tetapi arus bersih nol ("potensial korosi",[4] "potensial campuran"), atau potensial dengan arus bersih non-nol pada elektroda kerja (seperti dalam korosi Galvani atau voltametri). Potensi reversibel terkadang dapat dikonversi menjadi potensial elektroda standar untuk spesi elektroaktif tertentu dengan mengekstrapolasi nilai terukur ke keadaan standar.
Nilai potensial elektroda di bawah non-kesetimbangan tergantung pada sifat dan komposisi fase kontak, dan pada kinetika reaksi elektroda pada antarmuka (lihat persamaan Butler–Volmer).[5]
Asumsi operasional untuk penentuan potensial elektroda dengan elektroda hidrogen standar melibatkan elektroda referensi ini dengan ion hidrogen dalam larutan ideal yang memiliki "potensial nol pada semua suhu" ekuivalen dengan entalpi pembentukan standar ion hidrogen juga "nol pada semua suhu".
Pengukuran
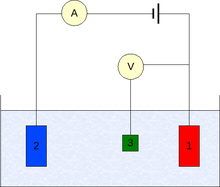
Pengukuran umumnya dilakukan menggunakan pengaturan tiga elektroda (lihat gambar):[6]
- elektroda kerja,
- elektroda pembantu,
- elektroda referensi (elektroda hidrogen standar atau yang sebanding).
Dalam hal arus bersih non-nol pada elektroda, penting untuk meminimalkan penurunan IR ohmik dalam elektrolit, misalnya, dengan menempatkan elektroda referensi di dekat permukaan elektroda kerja, atau dengan menggunakan elektrolit pendukung dengan konduktivitas yang cukup tinggi.[7] Pengukuran potensial dilakukan dengan terminal positif dari elektrometer yang terhubung ke elektroda kerja dan terminal negatif ke elektroda referensi.
Perbedaan potensial dari sel yang dirakit dari dua elektroda
Potensial sel yang dirakit dari dua elektroda dapat ditentukan dari dua potensial elektroda individu yang digunakan
- ΔVsel = Ered,katoda − Ered,anoda
atau, setara dengan,
- ΔVsel = Ered,katoda + Eoks,anoda.
Hal ini mengikuti definisi IUPAC mengenai perbedaan potensial listrik dari sel galvanik,[8] di mana perbedaan potensial listrik sel adalah perbedaan dari potensial elektroda di sebelah kanan dan kiri sel galvanik. Ketika ΔVsel bernilai positif, maka muatan listrik positif mengalir melalui sel dari elektroda kiri (anoda) ke elektroda kanan (katoda).
Lihat pula
- Potensial listrik
- Potensial elektrokimiawi
- Persamaan Nernst
- Perbedaan potensial (tegangan)
- Potensial elektroda standar
- Tabel potensial elektroda standar
- Elektrolisis
- Elektrokimia
Referensi
- ^ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Dikompilasi oleh A. D. McNaught dan A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versi terkoreksi daring XML: http://goldbook.iupac.org (2006–) dibuat oleh M. Nic, J. Jirat, B. Kosata; pembaharuan dikompilasi oleh A. Jenkins. ISBN 0-9678550-9-8. DOI:10.1351/goldbook. Entry: "Electrode Potential".
- ^ Zoski, C. G., ed. (2006). Handbook of Electrochemistry (dalam bahasa Inggris). Boston, MA: Elsevier. ISBN 9780444519580. OCLC 162129983.
- ^ a b Sawyer, D. T., Sobkowiak, A. & Roberts, J. L. (1995). Electrochemistry for Chemists (dalam bahasa Inggris) (edisi ke-2). Hoboken, NJ: Wiley. ISBN 9780471594680.
- ^ "Getting Started with Electrochemical Corrosion Measurement: Review of the Electrochemical Basis of Corrosion". Gamry Instruments (dalam bahasa Inggris). Diakses tanggal 13 Januari 2017.
- ^ Walsh, F. C. (1992). "The Kinetics of Electrode Reactions: Part I—General Considerations and Electron Transfer Control". The International Journal of Surface Engineering and Coatings (dalam bahasa Inggris). 70 (1): 50–54. doi:10.1080/00202967.1992.11870941.
- ^ Bard, A. J. & Faulkner, L. R. (2001). Electrochemical Methods: Fundamentals and Applications (edisi ke-2). Hoboken, NJ: Wiley. ISBN 9780471043720.
- ^ Oelßner, W., Berthold, F. & Guth, U. (2006). "The iR drop – well‐known but often underestimated in electrochemical polarization measurements and corrosion testing". Materials and Corrosion (dalam bahasa Inggris). 57 (6): 455–466. doi:10.1002/maco.200603982.
- ^ IUPAC Gold Book. Definition of the potential difference of a galvanic cell. http://goldbook.iupac.org/E01934.html.
