Xenon tetrafluorida

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Xenon tetrafluoride
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| XeF4 | |||
| Massa molar | 207.2836 g mol−1 | ||
| Penampilan | Padat putih | ||
| Densitas | 4.040 g cm−3, padat | ||
| Titik lebur | 117 °C memejalwap (390 K)[1] | ||
| Bertindak balas | |||
| Struktur | |||
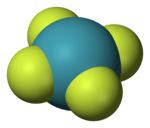
| D4h | |||
| geometri molekul persegi panjang | |||
| 0 D | |||
| Termokimia | |||
| Entropi molar standar (S |
146 J·mol−1·K−1[2] | ||
| Entalpi pembentukan standar (ΔfH |
−251 kJ·mol−1[2] | ||
| Bahaya | |||
| Titik nyala | ? °C | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Xenon tetrafluorida salahsatu senyawa kimia dengan formula kimia XeF4. Ia adalah senyawa gas murni yang pertamakali ditemukan.[3] Senyawa ini dihasilkan dari reaksi kimia gas xenon dan fluorin, F2, seperti berikut:[4][5]
Reaksi ini bersifat eksoterma, melepaskan energi 251 Kilojoule untuk setiap mol xenon.[3]
XeF4 adalah bahan kristal tak berwarna dalam keadaan normal. Struktur kristalnya ditemukan pada 1963 menggunakan teknik spektroskopi NMR dan kristalografi sinar-X.[6][7] Strukturnya adalah persegi panjang seperti yang telah dibuktukan oleh percobaan difraksi neutron[8] dan dibenarkan oleh teori VSEPR karena xenon mempunyai 2 pasangan elektron tunggal diatas dan dibawah bidang molekul itu.
XeF4 memejalwap pada suhu 115.7 derajat celsius.
Seperti fluorida xenon yang lain, penghasilan XeF4 adalah eksogernik. Ia stabil pada suhu dan tekanan normal. Semuanya bisa terus bereaksi dengan air, melepaskan gas xenon murni, hidrogen fluorida dan molekul oksigen. Reaksi ini berlaku di udara yang sedikit lembab. Oleh karena itu, XeF4 harus ditempatkan di tempat khusus.
Referensi
[sunting | sunting sumber]- ^ Arnold F. Holleman; Egon Wiberg (2001). Nils Wiberg, ed. Inorganic chemistry. translated by Mary Eagleson, William Brewer. Academic Press. hlm. 394. ISBN 0-12-352651-5.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. hlm. A23. ISBN 0-618-94690-X.
- ^ a b Zumdahl (2007). Chemistry. Boston: Houghton Mifflin. hlm. 243. ISBN 0-618-52844-X.
- ^ Claassen, H. H.; Selig, H.; Malm, J. G. (1962). "Xenon Tetrafluoride". J. Am. Chem. Soc. 84 (18): 3593. doi:10.1021/ja00877a042.
- ^ C. L. Chernick, H. H. Claassen, P. R. Fields 1, H. H. Hyman, J. G. Malm, W. M. Manning, M. S. Matheson, L. A. Quarterman, F. Schreiner, H. H. Selig, I. Sheft, S. Siegel, E. N. Sloth, L. Stein, M. H. Studier, J. L. Weeks, and M. H. Zirin (1962). "Fluorine Compounds of Xenon and Radon". Science. 138 (3537): 136–138. Bibcode:1962Sci...138..136C. doi:10.1126/science.138.3537.136. PMID 17818399.
- ^ Thomas H. Brown, E. B. Whipple, and Peter H. Verdier (1963). "Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum". Science. 140 (3563): 178. Bibcode:1963Sci...140..178B. doi:10.1126/science.140.3563.178. PMID 17819836.
- ^ James A. Ibers and Walter C. Hamilton (1963). "Xenon Tetrafluoride: Crystal Structure". Science. 139 (3550): 106–107. Bibcode:1963Sci...139..106I. doi:10.1126/science.139.3550.106. PMID 17798707.
- ^ Burns, John H.; Agron, P. A.; Levy, Henri A (1963). "Xenon Tetrafluoride Molecule and Its Thermal Motion: A Neutron Diffraction Study". Science. 139 (3560): 1208–1209. Bibcode:1963Sci...139.1208B. doi:10.1126/science.139.3560.1208. PMID 17757912.