Kompleks dinitrogen logam transisi

Kompleks dinitrogen logam transisi adalah senyawa koordinasi yang mengandung dinitrogen (N2) sebagai ligannya. Dalam area kimia koordinasi, bentuk atomik dan diatomik nitrogen dibedakan, walaupun "nitrogen" dirujuk sebagai N2.
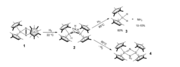
Kompleks N2 logam telah dipelajari sejak 1965 ketika kompleks pertama dilaporkan oleh Allen dan Senoff.[1] Kompleks ini, [Ru(NH3)5(N2)]2+ disintesis dari hidrazin hidrat dan rutenium triklorida dan terdiri dari pusat 16e− [Ru(NH3)5]2+ yang menempel pada salah satu ujung N2.[2][3] Minat pada kompleks semacam itu muncul karena N2 terdiri dari sebagian besar atmosfer dan karena banyak senyawa bermanfaat mengandung atom nitrogen. Fiksasi nitrogen biologis mungkin terjadi melalui pengikatan N2 ke pusat logam di dalam enzim nitrogenase, diikuti oleh serangkaian langkah yang melibatkan transfer elektron dan protonasi. Hidrogenasi N2 hanya bersifat eksotermik lemah, maka hidrogenasi industri nitrogen melalui Proses Haber-Bosch menggunakan tekanan dan suhu yang tinggi.[4]
Modus pengikatan
[sunting | sunting sumber]
Dalam hal pengikatannya dengan logam transisi, N2 berhubungan dengan CO dan asetilena karena ketiga spesi memiliki ikatan rangkap. Berbagai modus ikatan telah dicirikan.
Ujung (End-on)
[sunting | sunting sumber]Sebagai suatu ligan, N2 biadanya terikat pada logam sebagai suatu ligan ujung ("end-on"), seperti diilustrasikan oleh kompleks Allen dan Senoff. Kompleks semacam itu biasanya analog dengan derivatif CO terkait. Contoh bagus dari hubungan ini adalah kompleks IrCl(CO)(PPh3)2 dan IrCl(N2)(PPh3)2.[5] Beberapa kompleks mengandung lebih dari satu ligan N2, dan tidak ada contoh yang menampilkan ketiganya (berbeda dengannya, logam heksakarbonil adalah umum). Ligan dinitrogen dalam W(N2)2(Ph2PCH2CH2PPh2)2 dapat direduksi untuk memproduksi amonia.[6]
Suatu kompleks end-on yang juga mengandung ligan hidrida adalah [FeH(N2)(dmpe)2)]+. Kation ini mengalami deprotonasi untuk membentuk Fe(N2)(dmpe)2 yang bereaksi dengan hidrogen klorida untuk memberikan amonium.
Penjembatan, ujung (Bridging, end-on)
[sunting | sunting sumber]N2 juga berfungsi sebagai ligan penjembatan, seperti yang diilustrasikan oleh {[Ru(NH3)5]2(μ-N2)}4+.
Sebuah studi pada tahun 2006 mengenai kompleks besi-dinitrogen menunjukkan bahwa ikatan N–N secara signifikan melemah pada kompleksasi dengan atom besi dengan bilangan koordinasi rendah. Kompleks ini melibatkan ligan kargo bidentat yang menempel pada atom besi pada inti Fe–N–N–Fe, di mana N2 bertindak sebagai ligan penjembatan antara atom besi. Meningkatkan jumlah koordinasi besi dengan memodifikasi ligan pengkhelat dan menambahkan ligan lain per atom besi menunjukkan peningkatan kekuatan ikatan N–N dalam kompleks yang dihasilkan. Dengan demikian diduga bahwa Fe dalam lingkungan koordinasi rendah merupakan faktor kunci untuk fiksasi nitrogen oleh enzim nitrogenase, karena kofaktor Fe–Mo juga menampilkan Fe dengan bilangan koordinasi rendah.[7]
Sisi, penjembatan (Side-on, bridging)
[sunting | sunting sumber]Dalam modus penjembatan kedua, kompleks bimetalik diketahui dimana vektor N-N tegak lurus dengan vektor M-M. Salah satu contohnya adalah [(η5-C5Me4H)2Zr]2(μ2,η2,η2-N2).[8] Kompleks dimetalik {(C5HMe4)2Zr}2{μ-η2-N2} bereaksi dengan H2.[9]
Suatu kompleks ditantalum tetrahidrida terkait juga mereduksi N2[10].
Reaktivitas
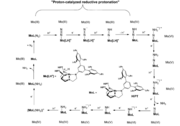
[sunting | sunting sumber]Beberapa kompleks logam-dinitrogen mengkatalisis hidrogenasi N2 menjadi amonia. Salah satunya adalah Mo(III) triamidoaminokompleks Mo[(HIPTN)3N].[11] Sistem ini mempergunakan reduktan seperti Cp*2Cr dan pereaksi protonasi seperti garam 2,6-lutidinium.[12] Reduktan yang setara dan proton ditambahkan secara bertahap. Siklus dimulai dengan N2 berkoordinasi dengan Mo dalam modus akhir. Keadaan oksidasi molibdenum tetap tidak berubah sampai tahap terakhir ketika dioksidasi dari Mo(III) menjadi Mo(IV). Selama sisa siklus, dinitrogen terikat pada Mo melalui ikatan rangkap dua atau tiga disertai dengan perubahan keadaan oksidasi Mo dari +4 sampai +5 dan pelepasan 2 ekivalen gas amonia. Sistem katalitik homogen lainnya berdasarkan molibdenum[13] Prakatalisnya adalah kompleks dimolibdenum dijembatani-dinitrogen yang terhubung dengan ligan PNP(2,6-bis(di-tert-butil fosfinometil) piridin). Menambahkan asam ke prakatalis menyebabkan pemisahan kompleks dimolibdenum dijembatani-dinitrogen dan menghasilkan kation hidrida molibdenum yang tidak aktif dan aditif nitrogen molibdenum aktif.(MoPNP(N2)). MoPNP(N2) kemudian dapat menjalani siklus katalitik penuh dengan proton dan penambahan elektron untuk membentuk amonia. Namun sistem katalitik ini membutuhkan kelebihan kobaltosena yang sangat besar (72 ekiv) dan [LutH]OTf (96 ekiv).
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Senoff, Caesar V. (1990). "The discovery of [Ru(NH3)5N2]2+: A case of serendipity and the scientific method". Journal of Chemical Education. 67 (5): 368. doi:10.1021/ed067p368.
- ^ A. D. Allen; C. V. Senoff (1965). "Nitrogenopentammineruthenium(II) complexes". Journal of the Chemical Society, Chemical Communications (24): 621. doi:10.1039/C19650000621.
- ^ Fryzuk, Michael D. (2013). "N2 coordination". Chem. Commun. 49: 4866–4868. doi:10.1039/C3CC42001A.
- ^ Fryzuk, M. D.: Johnson, S. A (2000). "The continuing story of dinitrogen activation". Coordination Chemistry Reviews. 200–202: 379–409. doi:10.1016/S0010-8545(00)00264-2.
- ^ Collman, J. P.; Hoffman, N. W.; Hosking, J. W. (2000). "trans-Chloro(nitrogen)bis(triphenylphosphine)iridium (I)". Inorganic Syntheses. 12: 8–11. doi:10.1002/9780470132432.ch2. ISBN 978-0-470-13171-8.
- ^ Modern Coordination Chemistry: The Legacy of Joseph Chatt" G. J. Leigh (Editor), N. W. Winterton (Editor) Springer Verlag (2002). ISBN 0-85404-469-8
- ^ Smith, J.; Sadique, A.; Cundari, T.; Rodgers, K.; Lukat-Rodgers, G.; Lachicotte, R.; Flaschenriem, C.; Vela, J.; Holland, P. (2006). "Studies of low-coordinate iron dinitrogen complexes". Journal of the American Chemical Society. 128 (3): 756–769. doi:10.1021/ja052707x. PMID 16417365.
- ^ Bernskoetter, W. H.; Lobkovsky, E.; Chirik, P. J. (2005). "Kinetics and Mechanism of N2 Hydrogenation in Bis(cyclopentadienyl) Zirconium Complexes and Dinitrogen Functionalization by 1,2-Addition of a Saturated C-H Bond". Journal of the American Chemical Society. 127 (40): 14051–14061. doi:10.1021/ja0538841. PMID 16201827.
- ^ Pool, Jaime A.; Lobkovsky, Emil; Chirik, Paul J. "Hydrogenation and cleavage of dinitrogen to ammonia with a zirconium complex". Nature. 427 (6974): 527–530. doi:10.1038/nature02274. PMID 14765191.
- ^ Fryzuk, Michael D. (2008-09-20). "Side-on End-on Bound Dinitrogen: An Activated Bonding Mode That Facilitates Functionalizing Molecular Nitrogen". Accounts of Chemical Research (dalam bahasa Inggris). 42 (1): 127–133. doi:10.1021/ar800061g.
- ^ Yandulov, Dmitry V.; Schrock, Richard R. (2003-07-04). "Catalytic Reduction of Dinitrogen to Ammonia at a Single Molybdenum Center". Science (dalam bahasa Inggris). 301 (5629): 76–78. doi:10.1126/science.1085326. ISSN 0036-8075. PMID 12843387.
- ^ Ballmann, Joachim; Munhá, Rui F.; Fryzuk, Michael D. "The hydride route to the preparation of dinitrogen complexes". Chemical Communications (dalam bahasa Inggris). 46 (7): 1013. doi:10.1039/b922853e.
- ^ Arashiba, Kazuya; Miyake, Yoshihiro; Nishibayashi, Yoshiaki. "A molybdenum complex bearing PNP-type pincer ligands leads to the catalytic reduction of dinitrogen into ammonia". Nature Chemistry. 3 (2): 120–125. doi:10.1038/nchem.906.