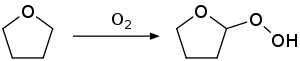Tetrahidrofuran
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Oksasiklopentana
| |||
| Nama lain
THF, tetrahidrofuran, 1,4-epoksibutana, butilena oksida, siklotetrametilena oksida, dietilena oksida, oksolana, furanidina, hidrofuran, tetra-metilena oksida
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Nomor EC | |||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| Sifat | |||
| C4H8O | |||
| Massa molar | 72,11 g/mol | ||
| Penampilan | cairan tak berwarna | ||
| Densitas | 0,8892 g/cm3 @ 20 °C, cair | ||
| Titik lebur | -108,4 °C (164,75 K) | ||
| Titik didih | 66 °C (339,15 K) | ||
| tercampur penuh | |||
| Viskositas | 0,48 cP pada 25 °C | ||
| Struktur | |||
| sampul | |||
| 1,63 D (gas) | |||
| Bahaya | |||
Klasifikasi UE (DSD) (usang)
|
Mudah terbakar (F) Iritan (Xi) | ||
| Frasa-R | R11, R19, Templat:R36/37 | ||
| Frasa-S | S16, S29, S33 | ||
| Titik nyala | -14 °C | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Tetrahidrofuran atau dikenal sebagai THF, adalah senyawa organik heterosiklik dengan rumus kimia (CH2)4O). Ia berupa cairan berviskositas rendah dan memiliki aroma seperti dietil eter. Ia termasuk dalam molekul eter yang paling polar. THF adalah analog yang terhidrogenasi dari senyawa aromatik furan.
Sifat-sifat pelarut
[sunting | sunting sumber]THF adalah pelarut aprotik dengan tetapan dielektrik 7,6. Ia memiliki kepolaran yang sedang dan melarutkan berbagai macam senyawa nonpolar maupun polar.
Dietil eter sering digantikan oleh THF ketika diperlukan pelarut bertitik didih lebih tinggi. Oleh karena itu, seperti dietil eter, ia sering digunakan dalam hidroborasi untuk sintesis alkohol primer. Kedua eter tersebut memiliki atom oksigen yang dapat berkoordinasi dengan atom boron yang kekurangan elektron membentuk aduk. Selain itu, THF dan dietil eter juga sering digunakan sebagai pelarut reagen Grignard karena atom oksigen pelarut dapat berkoordinasi dengan ion magnesium dari reagen Grignard. Atom oksigen pada THF dan dietil eter juga tidak memiliki hidrogen asam yang dapat mengalami reaksi asam-basa dengan reagen Grignard. 2-metiltetrahidrofuran merupakan alternatif THF yang populer, ia memiliki sifat yang sama dengan THF, namun memiliki titik leleh yang lebih rendah (digunakan untuk reaksi bertemperatur rendah) dan titik didih yang lebih tinggi (digunakan untuk retensi pelarut pada refluks).
THF sering digunakan dalam ilmu polimer. Ia dapat digunakan untuk melarutkan karet sebelum dilakukan penentuan massa molekul menggunakan kromatografi permeasi gel. THF juga melarutkan PVC.
THF dapat dipolimerisasikan menggunakan asam kuat, menghasilkan polimer linear yang disebut poli(tetrametilena eter) glikol (PTMEG), Nomor Registrasi CAS [25190-06-1], juga dikenal sebagai PTMO, politetrametilena oksida. Kegunaan utama dari polimer ini adalah untuk membuat serat poliuretana elastomerik seperti Spandex.[1]
Pembuatan
[sunting | sunting sumber]THF dapat disintesis dari hidrogenasi katalitik furan.[2]
Proses pembuatan THF dalam industri menggunakan dehidrasi 1,4-butanadiol dengan katalis asam.[3] Du Pont mengembangkan proses produksi THF dengan mengoksidasi n-butana menjadi maleat anhidrida kasar, diikuti dengan hidrogenasi maleat anhidrida menjadi THF.[3][4]
Wewanti
[sunting | sunting sumber]THF cenderung membentuk peroksida jika disimpan dalam udara. Oleh karena itu THF tidak boleh didistilasi sampai kering, yang dapat meninggalkan residu peroksida yang mudaj meledak. THF komersial sering memakai BHT untuk mencegah pembentukan peroksida.
Lihat pula
[sunting | sunting sumber]- Campuran Trapp yang memperluas jangkauan temperatur THF sebagai pelarut.
Referensi
[sunting | sunting sumber]- ^ "Polyethers, Tetrahydrofuran and Oxetane Polymers by Gerfried Pruckmayr, P. Dreyfuss, M. P. Dreyfuss". Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. 1996.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson: Organic Chemistry, 2nd ed., Allyn and Bacon 1972, p 569
- ^ a b "Ethers, by Lawrence Karas and W. J. Piel". Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. 2004.
- ^ Merck Index of Chemicals and Drugs, 9th ed. monograph 8929
- Loudon, G. Mark. Organic Chemistry 4th ed. New York: Oxford University Press. 2002. pg 318.
Pranala luar
[sunting | sunting sumber]- THF usage on Organic Syntheses
- THF info Diarsipkan 2005-04-20 di Wayback Machine.
- U.S. OSHA info Diarsipkan 2005-05-11 di Wayback Machine.
- "2-Methyltetrahydrofuran, An alternative to Tetrahydrofuran and Dichloromethane". Sigma-Aldrich. Diakses tanggal 2007-05-23.
- "Tetrahydrafuran (THF) Storage and Handling" (PDF). BASF. Diarsipkan dari versi asli (PDF) tanggal 2008-03-09. Diakses tanggal 2007-05-24.