Absorpsi (kimia): Perbedaan antara revisi
Add 1 book for Wikipedia:Pemastian (20210209)) #IABot (v2.0.8) (GreenC bot |
Tidak ada ringkasan suntingan Tag: Suntingan perangkat seluler Suntingan peramban seluler |
||
| (9 revisi perantara oleh 5 pengguna tidak ditampilkan) | |||
| Baris 2: | Baris 2: | ||
{{for|penyerapan cahaya|absorbansi}} |
{{for|penyerapan cahaya|absorbansi}} |
||
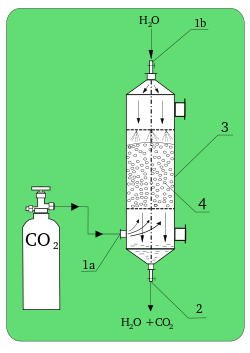
[[Berkas:Absorber.svg|jmpl|250px|Penjerap laboratorium. '''1a)''': CO<sub>2</sub> inlet; '''1b)''': H<sub>2</sub>O inlet; '''2)''': outlet '''3)''': kolom absorpsi; '''4)''': kemasan.]] |
[[Berkas:Absorber.svg|jmpl|250px|Penjerap laboratorium. '''1a)''': CO<sub>2</sub> inlet; '''1b)''': H<sub>2</sub>O inlet; '''2)''': outlet '''3)''': kolom absorpsi; '''4)''': kemasan.]] |
||
[[Berkas:Absorpsi.png|jmpl|1. Tangki Penampung 2. Kran pengatur debit air 3. Tangki overflow 4. Saluran overflow 5. Floatmeter 6. Menara bahan isian 7. Kompresor 8. Botol penampung umpan 9. Manometer gas 10. Erlenmeyer 250 mL 11. Larutan H2SO4 penyerap]] |
|||
Dalam ilmu [[kimia]], '''absorpsi''' atau '''penyerapan''' adalah [[fenomena]] fisika atau kimia atau suatu [[Metode ilmiah|proses]] di mana [[atom]], [[molekul]] atau [[ion]] memasuki fase ruah – bahan [[cairan|cair]] atau [[padat]]. Absorpsi berbeda dengan |
Dalam ilmu [[kimia]], '''absorpsi''' atau '''penyerapan'''<ref>{{kamus|penyerapan}}</ref> adalah [[fenomena]] fisika atau kimia atau suatu [[Metode ilmiah|proses]] di mana [[atom]], [[molekul]] atau [[ion]] memasuki fase ruah – bahan [[cairan|cair]] atau [[padat]]. Absorpsi (penyerapan) berbeda dengan [[adsorpsi]] (penjerapan), karena molekul-molekul yang mengalami absorpsi memasuki volume, tidak hanya di permukaan saja (seperti yang terjadi pada adsorpsi). Istilah yang lebih umum adalah [[sorpsi]] (pengerapan) ({{lang-en|[[sorption]]}}), yang meliputi absorpsi, [[adsorpsi]], dan [[pertukaran ion]]. Absorpsi adalah suatu kondisi di mana sesuatu memasuki zat lain.<ref name=Organic-chemistry/> |
||
Dalam banyak proses teknologi penting, absorpsi kimia digunakan untuk proses fisika, misalnya absorpsi [[karbon dioksida]] oleh [[natrium hidroksida]] – semacam proses asam-basa yang tidak mematuhi hukum partisi Nernst. |
Dalam banyak proses teknologi penting, absorpsi kimia digunakan untuk proses fisika, misalnya absorpsi [[karbon dioksida]] oleh [[natrium hidroksida]] – semacam proses asam-basa yang tidak mematuhi hukum partisi Nernst. |
||
| Baris 14: | Baris 15: | ||
Proses absorpsi berarti bahwa zat menangkap dan memindahkan energi. ''Absorben'' mendistribusikan bahan yang ditangkapnya secara menyeluruh, sementara ''adsorben'' hanya mendistribusikannya di permukaan saja. |
Proses absorpsi berarti bahwa zat menangkap dan memindahkan energi. ''Absorben'' mendistribusikan bahan yang ditangkapnya secara menyeluruh, sementara ''adsorben'' hanya mendistribusikannya di permukaan saja. |
||
Proses gas atau cair yang menembus ke dalam badan adsorben secara umum dikenal sebagai absorpsi.<ref>{{cite book|last=Nasmi HS., Suteja, Syarif H.|first=|date=2021|url=https://www.google.co.id/books/edition/Pengantar_Inhibitor_Korosi_Alami/J5koEAAAQBAJ?hl=en&gbpv=1&dq=Absorpsi+kimia+atau+absorpsi+reaktif+adalah+reaksi+kimia+antara+bahan+yang+diabsorpsi+dan+yang+mengabsorbsi.&pg=PA121&printsec=frontcover|title=Pengantar Inhibitor Korosi Alami|place=|publisher=Deepublish|isbn=9786230226618|edition=|pages=120|language=|coauthors=}}</ref> |
|||
Proses gas atau cair yang menembus ke dalam badan adsorben secara umum dikenal sebagai absorpsi. |
|||
{{Quote box |
{{Quote box |
||
| Baris 25: | Baris 26: | ||
:: <math>\frac{[x]_{1}}{[x]_{2}} = \text{constant} = K_{N(x,12)}</math> |
:: <math>\frac{[x]_{1}}{[x]_{2}} = \text{constant} = K_{N(x,12)}</math> |
||
Nilai konstanta K<sub>N</sub> bergantung pada suhu dan disebut '''[[koefisien partisi]]'''. Persamaan ini valid jika konsentrasi tidak terlalu besar dan jika spesies "x" tidak berubah bentuk dalam kedua fase. Jika molekul semacam ini mengalami asosiasi atau [[Disosiasi (kimia)|disosiasi]], maka persamaan ini tetap dapat menjelaskan kesetimbangan antara "x" dalam kedua fase, tetapi hanya untuk bentuk yang sama – konsentrasi seluruh bentuk yang tersisa harus dikalkulasi dengan melibatkan kesetimbangan secara keseluruhan.<ref name=Organic-chemistry/> |
Nilai konstanta K<sub>N</sub> bergantung pada suhu dan disebut '''[[koefisien partisi]]'''.<ref name=":0"/> Persamaan ini valid jika konsentrasi tidak terlalu besar dan jika spesies "x" tidak berubah bentuk dalam kedua fase. Jika molekul semacam ini mengalami asosiasi atau [[Disosiasi (kimia)|disosiasi]], maka persamaan ini tetap dapat menjelaskan kesetimbangan antara "x" dalam kedua fase, tetapi hanya untuk bentuk yang sama – konsentrasi seluruh bentuk yang tersisa harus dikalkulasi dengan melibatkan kesetimbangan secara keseluruhan.<ref name=Organic-chemistry/> |
||
Dalam kasus absorpsi gas, perhitungan konsentrasi dapat dilakukan dengan menggunakan, misalnya [[Hukum gas ideal]], c = p/RT. Cara lainnya, dapat digunakan [[tekanan parsial]] untuk menggantikan konsentrasi. |
Dalam kasus absorpsi gas, perhitungan konsentrasi dapat dilakukan dengan menggunakan, misalnya [[Hukum gas ideal]], c = p/RT.<ref>{{cite book|last=|first=|date=2002|url=https://www.google.co.id/books/edition/Dasar_2_Fenomena_Transport_3/9RxpahwG2a4C?hl=en&gbpv=1&dq=Hukum+gas+ideal,+c+%3D+p/RT.&pg=PA4&printsec=frontcover|title=Dasar-2 Fenomena Transport/3|place=|publisher=Erlangga|isbn=9789797410193|edition=|pages=4|language=|coauthors=}}</ref> Cara lainnya, dapat digunakan [[tekanan parsial]] untuk menggantikan konsentrasi. |
||
== Jenis-jenis absorpsi == |
== Jenis-jenis absorpsi == |
||
Absorpsi adalah suatu proses yang dapat berupa kimia (reaktif) maupun fisika (tak-reaktif). |
Absorpsi adalah suatu proses yang dapat berupa kimia (reaktif) maupun fisika (tak-reaktif).<ref name=":0" /> |
||
=== Absorpsi kimia === |
=== Absorpsi kimia === |
||
Absorpsi kimia atau absorpsi reaktif adalah reaksi kimia antara bahan yang diabsorpsi dan yang mengabsorbsi. Kadang-kadang, ia merupakan kombinasi dengan absorpsi fisika. Absorpsi jenis ini bergantung pada [[stoikiometri]] reaksi dan konsentrasi reaktannya.<ref>{{cite journal|last=Leiviskä|first=Tiina|author2=Gehör, Seppo|author3=Eijärvi, Erkki|author4=Sarpola, Arja|author5=Tanskanen, Juha|title=Characteristics and potential applications of coarse clay fractions from Puolanka, Finland |journal=Central European Journal of Engineering|date=10 April 2012|volume=2|issue=2|pages=239–247|doi=10.2478/s13531-011-0067-9|bibcode=2012CEJE....2..239L}}</ref> |
Absorpsi kimia atau absorpsi reaktif adalah reaksi kimia antara bahan yang diabsorpsi dan yang mengabsorbsi.<ref name=":0">{{cite book|last=Nasmi HS., Suteja, Syarif H.|first=|date=2021|url=https://www.google.co.id/books/edition/Pengantar_Inhibitor_Korosi_Alami/J5koEAAAQBAJ?hl=en&gbpv=1&dq=Absorpsi+kimia+atau+absorpsi+reaktif+adalah+reaksi+kimia+antara+bahan+yang+diabsorpsi+dan+yang+mengabsorbsi.&pg=PA121&printsec=frontcover|title=Pengantar Inhibitor Korosi Alami|place=|publisher=Deepublish|isbn=9786230226618|edition=|pages=121|language=|coauthors=}}</ref> Kadang-kadang, ia merupakan kombinasi dengan absorpsi fisika. Absorpsi jenis ini bergantung pada [[stoikiometri]] reaksi dan konsentrasi reaktannya.<ref>{{cite journal|last=Leiviskä|first=Tiina|author2=Gehör, Seppo|author3=Eijärvi, Erkki|author4=Sarpola, Arja|author5=Tanskanen, Juha|title=Characteristics and potential applications of coarse clay fractions from Puolanka, Finland |journal=Central European Journal of Engineering|date=10 April 2012|volume=2|issue=2|pages=239–247|doi=10.2478/s13531-011-0067-9|bibcode=2012CEJE....2..239L}}</ref> |
||
== Referensi == |
== Referensi == |
||
Revisi terkini sejak 8 Februari 2024 22.10

Dalam ilmu kimia, absorpsi atau penyerapan[1] adalah fenomena fisika atau kimia atau suatu proses di mana atom, molekul atau ion memasuki fase ruah – bahan cair atau padat. Absorpsi (penyerapan) berbeda dengan adsorpsi (penjerapan), karena molekul-molekul yang mengalami absorpsi memasuki volume, tidak hanya di permukaan saja (seperti yang terjadi pada adsorpsi). Istilah yang lebih umum adalah sorpsi (pengerapan) (bahasa Inggris: sorption), yang meliputi absorpsi, adsorpsi, dan pertukaran ion. Absorpsi adalah suatu kondisi di mana sesuatu memasuki zat lain.[2]
Dalam banyak proses teknologi penting, absorpsi kimia digunakan untuk proses fisika, misalnya absorpsi karbon dioksida oleh natrium hidroksida – semacam proses asam-basa yang tidak mematuhi hukum partisi Nernst.
Beberapa contoh efek ini dapat dilihat pada artikel ekstraksi cair-cair. Adalah hal yang mungkin untuk mengekstraksi suatu zat terlarut (solut) dari sastu fase cair ke fase cair lainnya tanpa reaksi kimia. Contoh solut semacam ini adalah gas mulia dan osmium tetroksida.[2]
Proses absorpsi berarti bahwa zat menangkap dan memindahkan energi. Absorben mendistribusikan bahan yang ditangkapnya secara menyeluruh, sementara adsorben hanya mendistribusikannya di permukaan saja.
Proses gas atau cair yang menembus ke dalam badan adsorben secara umum dikenal sebagai absorpsi.[3]
Absorpsi: Proses suatu bahan (absorbat) diretensi oleh bahan lain (absorben); ini dapat berupa larutan fisik gas, cairan, atau padatan dalam cairan, pengikatan molekul suatu gas, uap, cairan, atau pelarutan bahan pada permukaan padatan melalui gaya fisika, dll. Dalam spektrofotometri, absorpsi cahaya pada panjang gelombang tertentu digunakan untuk mengidentifikasi sifat kimia suatu molekul, atom atau ion dan untuk mengukur konsentrasi spesies-spesies ini.
Persamaan
[sunting | sunting sumber]Jika absorpsi adalah suatu proses fisika yang tidak berhubungan dengan proses fisika atau kimia, biasanya ia memenuhi hukum distribusi Nernst:
- "perbandingan konsentrasi beberapa spesies zat terlarut dalam dua fase ruah yang saling kontak pada kesetimbangan adalah konstan untuk zat terlarut dan fase ruah terentu":
Nilai konstanta KN bergantung pada suhu dan disebut koefisien partisi.[4] Persamaan ini valid jika konsentrasi tidak terlalu besar dan jika spesies "x" tidak berubah bentuk dalam kedua fase. Jika molekul semacam ini mengalami asosiasi atau disosiasi, maka persamaan ini tetap dapat menjelaskan kesetimbangan antara "x" dalam kedua fase, tetapi hanya untuk bentuk yang sama – konsentrasi seluruh bentuk yang tersisa harus dikalkulasi dengan melibatkan kesetimbangan secara keseluruhan.[2]
Dalam kasus absorpsi gas, perhitungan konsentrasi dapat dilakukan dengan menggunakan, misalnya Hukum gas ideal, c = p/RT.[5] Cara lainnya, dapat digunakan tekanan parsial untuk menggantikan konsentrasi.
Jenis-jenis absorpsi
[sunting | sunting sumber]Absorpsi adalah suatu proses yang dapat berupa kimia (reaktif) maupun fisika (tak-reaktif).[4]
Absorpsi kimia
[sunting | sunting sumber]Absorpsi kimia atau absorpsi reaktif adalah reaksi kimia antara bahan yang diabsorpsi dan yang mengabsorbsi.[4] Kadang-kadang, ia merupakan kombinasi dengan absorpsi fisika. Absorpsi jenis ini bergantung pada stoikiometri reaksi dan konsentrasi reaktannya.[6]
Referensi
[sunting | sunting sumber]- ^ (Indonesia) Arti kata penyerapan dalam situs web Kamus Besar Bahasa Indonesia oleh Badan Pengembangan dan Pembinaan Bahasa, Kementerian Pendidikan, Kebudayaan, Riset, dan Teknologi Republik Indonesia.
- ^ a b c McMurry, John (2003). Fundamentals of Organic Chemistry (edisi ke-Fifth). Agnus McDonald. hlm. 409. ISBN 0-534-39573-2.
- ^ Nasmi HS., Suteja, Syarif H. (2021). Pengantar Inhibitor Korosi Alami. Deepublish. hlm. 120. ISBN 9786230226618.
- ^ a b c Nasmi HS., Suteja, Syarif H. (2021). Pengantar Inhibitor Korosi Alami. Deepublish. hlm. 121. ISBN 9786230226618.
- ^ Dasar-2 Fenomena Transport/3. Erlangga. 2002. hlm. 4. ISBN 9789797410193.
- ^ Leiviskä, Tiina; Gehör, Seppo; Eijärvi, Erkki; Sarpola, Arja; Tanskanen, Juha (10 April 2012). "Characteristics and potential applications of coarse clay fractions from Puolanka, Finland". Central European Journal of Engineering. 2 (2): 239–247. Bibcode:2012CEJE....2..239L. doi:10.2478/s13531-011-0067-9.

![{\displaystyle {\frac {[x]_{1}}{[x]_{2}}}={\text{constant}}=K_{N(x,12)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0ec1ce71d0ce27734b33e4d1dfae04be91ecf13)