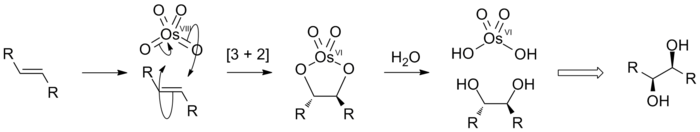Osmium tetroksida
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Osmium tetraoxide | |||
| Nama IUPAC (sistematis)
Tetraoksoosmium | |||
| Nama lain
Osmium(VIII) oksida
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| MeSH | Osmium+tetroxide | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| Nomor UN | UN 2471 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| OsO4 | |||
| Massa molar | 254,23 g/mol | ||
| Penampilan | padatan putih volatil | ||
| Bau | tajam, seperti klorin | ||
| Densitas | 4,9 g/cm3[1] | ||
| Titik lebur | 4.025 °C (4.298 K) | ||
| Titik didih | 1.297 °C (1.570 K) | ||
| 5,70 g/100 mL (10 °C) 6.23 g/100 mL (25 °C) | |||
| Kelarutan | 375 g/100 mL (CCl4) larut dalam sebagian besar pelarut organik, amonium hidroksida, fosfor oksiklorida | ||
| Tekanan uap | 7 mmHg (20 °C)[2] | ||
| Struktur | |||
| Monoklinik, mS20 | |||
| C2/c; a = 0.4515 nm, b = 0.52046 nm, c = 0.80838 nm, α = 77.677°, β = 73.784°, γ = 64.294°[3] | |||
| Bahaya | |||
| Lembar data keselamatan | ICSC 0528 | ||
Klasifikasi UE (DSD) (usang)
|
|||
| Frasa-R | R26/27/28, R34 | ||
| Frasa-S | (S1/2), S7/9, S26, S45 | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LCLo (terendah tercatat)
|
1316 mg/m3 (kelinci, 30 min) 423 mg/m3 (tikus, 4 hr) 423 mg/m3 (mencit, 4 hr)[4] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 0,002 mg/m3[2] | ||
REL (yang direkomendasikan)
|
TWA 0,002 mg/m3 (0,0002 ppm) ST 0,006 mg/m3 (0,0006 ppm)[2] | ||
IDLH (langsung berbahaya)
|
1 mg/m3[2] | ||
| Senyawa terkait | |||
Kation lainnya
|
Rutenium tetroksida | ||
| Osmium(IV) oksida | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Osmium tetroksida (disebut juga osmium(VIII) oksida) adalah senyawa kimia dengan rumus OsO4. Senyawa ini patut dicatat karena banyak kegunannya, meskipun beracun dan osmium tergolong langka. Ia juga memiliki sejumlah sifat yang menarik, salah satunya adalah padatan ini bersifat volatil. Senyawa ini tak berwarna, tetapi sebagian besar sampel berpenampilan kuning.[5] Hal ini sangat mungkin disebabkan oleh adanya ketakmurnian OsO2, yang berwarna kuning-coklat.[6]
Sifat fisika
[sunting | sunting sumber]
Osmium(VIII) oksida membentuk kristal monoklinik.[3][7] Ia memiliki ciri khas bau yang tajam seperti klorin. Nama unsur osmium diturunkan dari bahasa Yunani: osme yang berarti bau. OsO4 bersifat volatil: ia menyublim pada suhu ruang. Ia larut dalam berbagai pelarut organik. Ia juga agak mudah larut dalam air, disertai reaksi reversibel untuk membentuk asam osmat (lihat di bawah).[8] Osmium(VIII) oksida murni mungkin tidak berwarna[9] dan telah diketahui bahwa rona kuning adalah akibat ketakmurnian osmium dioksida (OsO2).[10] Molekul osmium tetroksida adalah tetrahedral, dan oleh karena itu non-polar. Kenonpolaran ini membantu OsO4 menembus membran sel bermuatan. Kelarutan OsO4 dalam karbon tetraklorida adalah 518 kali kelarutannya dalam air.
Struktur dan konfigurasi elektron
[sunting | sunting sumber]Osmium pada OsO4 mempunyai bilangan oksidasi VIII, namun logam tersebut tidak memiliki muatan 8+ yang sesuai karena ikatan dalam senyawa tersebut bersifat kovalen (energi ionisasi yang diperlukan untuk menghasilkan muatan 8+ formal juga melebihi energi yang tersedia dalam reaksi kimia normal). Atom osmium memiliki delapan elektron valensi (6s2, 5d6) dengan ikatan rangkap ke ke empat ligan oksida menghasilkan suatu kompleks 16 elektron. Hal ini isoelektronik dengan ion permanganat dan kromat.
Sintesis
[sunting | sunting sumber]OsO4 terbentuk perlahan ketika serbuk osmium bereaksi dengan O2 pada suhu ambien. Reaksi padatan yang banyak memerlukan pemanasan hingga 400 °C.[11]
Reaksi
[sunting | sunting sumber]Oksidasi alkena
[sunting | sunting sumber]Alkena ditambahkan kepada OsO4 untuk menghasilkan spesies diolat yang terhidrolisis menjadi cis-diol. Proses bersihnya disebut dihidroksilasi. Proses ini melalui reaksi [3 + 2] sikloadisi antara OsO4 dan alkena untuk membentuk intermediat ester osmat yang cepat terhidrolisis menghasilkan visinal diol. Karena atom oksigen ditambahkan dalam langkah terpadu, stereokimia yang dihasilkan adalah cis.
OsO4 mahal dan sangat beracun, menjadikannya pereaksi yang tidak menarik untuk digunakan dalam jumlah stoikiometri. Namun, reaksinya dibuat katalitik dengan menambahkan pereaksi untuk mereoksidasi produk samping Os(VI) kembali menjadi Os(VIII). Pereaksi yang umum digunakan antara lain H (hidroksilasi Milas), N-metilmorfolin N-oksida (dihidroksilasi Upjohn) dan K, karena ketiganya tidak bereaksi dengan alkena. Senyawa osmium lain dapat digunakan sebagai katalis, termasuk garam osmat(VI) ([OsO''";, dan osmium triklorida hidrat (OsCl3·xH2O). Spesies ini dioksidasi menjadi osmium(VIII) dengan adanya oksidator-oksidator tersebut.[12]
Basa Lewis seperti amina tersier dan piridin meingkatkan laju dihidroksilasi. "Akselerasi-ligan" ini muncul melalui pembentukan aduk (bahasa Inggris: adduct) OsO4L, yang bertambah semakin cepat pada alkena. Jika aminanya khiral, maka dihidroksilasi dapat berlangsung secara enansioselektif (lihat dihidroksilasi asimetri Sharpless).[13] OsO4 tidak bereaksi dengan sebagian besar karbohidrat.[14]
Proses tersebut dapat dilanjutkan untuk menghasilkan aldehida dalam oksidasi Lemieux–Johnson, yang menggunakan periodat untuk mencapai pembelahan diol dan untuk meregenerasi pemuatan katalitik OsO4. Proses ini ekivalen dengan ozonolisis.
Kimia koordinasi
[sunting | sunting sumber]OsO4 adalah asam Lewis dan oksidator lemah. Ia bereaksi dengan larutan basa membentuk anion perosmat OsO.[15] Spesies ini mudah direduksi menjadi anion osmat, OsO.
Jika basa Lewis adalah amina, maka terbentuk pula aduk (adduct). Sehingga OsO4 dapat disimpan dalam bentuk osmeth, yaitu OsO4 dikompleksasi dengan heksamin. Osmeth dapat dilarutkan dalam tetrahidrofuran (THF) dan diencerkan dalam larutan dapar untuk membuat larutan kerja encer (0,25%) OsO4.[16]
Dengan tert-BuNH2, terbentuk derivat imido:
- OsO4 + Me → OsO + H
Demikian pula dengan NH3 akan terbentuk kompleks nitrido:
- OsO4 + NH3 + KOH → K[Os(N)O''"; + 2 H
Anion [Os(N)O3]− bersifat isoelektrik dan isostruktural dengan OsO4.
OsO4 sangat mudah larut dalam tert-butil alkohol. Dalam larutan, ia mudah direduksi oleh hidrogen menjadi logam osmium. Logam osmium yang tersuspensi dapat digunakan untuk mengkatalisis hidrogenasi dari beragam bahan kimia organik yang mengandung ikatan rangkap dua atau tiga.
- OsO4 + 4 H2 → Os + 4 H
OsO4 mengalami "karbonilasi reduktif" dengan karbon monoksida dalam metanol pada suhu 400 K dan tekanan 200 bar, menghasilkan cluster triangular Os:
- 3 OsO4 + 24 CO → Os + 12 CO2[11]
Oksofluorida
[sunting | sunting sumber]Osmium membentuk beberapa oksofluorida, yang semuanya sangat peka terhadap kelembaban. cis-OsO terbentuk pada 77 K dalam larutan HF anhidrat:[17]
- OsO4 + 2 KrF2 → cis-OsO2F4 + 2 Kr + O2
OsO4 juga bereaksi dengan F2 membentuk OsO yang berwarna kuning:[18]
- 2 OsO4 + 2 F2 → 2 OsO3F2 + O2
OsO4 bereaksi dengan satu ekivalen [Me4N]F pada 298 K dan 2 ekivalen pada 253 K:[11]
- OsO4 + [Me4N]F → [Me4N][OsO4F]
- OsO4 + 2 [Me4N]F → [Me4N]2[cis-OsO4F2]
Kegunaan
[sunting | sunting sumber]Sintesis organik
[sunting | sunting sumber]Dalam sintesis organik, OsO4 banyak digunakan untuk mengoksidasi alkena menjadi visinal diol, penambahan gugus hidroksil pada sisi yang sama (adisi syn). Lihat reaksi dan mekanisme di atas. Reaksi ini telah dilakukan baik katalitik (dihidroksilasi Upjohn) dan asimetris (dihidroksilasi asimetris Sharpless).
Osmium(VIII) oksida juga digunakan dalam jumlah katalitik dalam oksiaminasi Sharpless untuk menghasilkan amino-alkohol visinal.
Dalam kombinasi dengan natrium periodat, OsO4 digunakan untuk pembelahan oksidatif alkena (oksidasi Lemieux-Johnson) bila periodate berfungsi baik untuk membelah diol yang dibentuk oleh dihidroksilasi, maupun untuk mengoksidasi kembali OsO3 ke OsO4. Transformasi bersih identik dengan yang dihasilkan oleh ozonolisis. Berikut contoh dari total sintesis Isosteviol.[19]
Pewarnaan biologis
[sunting | sunting sumber]OsO4 adalah zat pewarnaan yang banyak digunakan dalam mikroskopi elektron transmisi (transmission electron microscopy, TEM) untuk memberikan kontras pada citra.[20] Sebagai pewarna lipida, ia juga berguna dalam mikroskopi elektron payaran (scanning electron microscopy, SEM) sebagai alternatif penyalutan bersit. Ini menyematkan logam berat langsung ke membran sel, menciptakan tingkat hamburan elektron yang tinggi tanpa perlu menyalut membran dengan lapisan logam, yang dapat mengaburkan rincian membran sel. Dalam pewarnaan membran plasma, osmium(VIII) oksida mengikat fosfolipid di daerah kepala, sehingga menimbulkan kontras dengan protoplasma (sitoplasma) yang bertetangga. Selain itu, osmium(VIII) oksida, bersama-sama dengan HgCl2, juga digunakan untuk memperbaiki sampel biologis. Kemampuan bunuhnya yang cepat digunakan untuk membunuh spesimen hidup seperti protozoa. OsO4 menstabilkan banyak protein dengan mengubahnya menjadi gel tanpa menghancurkan fitur struktural. Protein jaringan yang distabilkan oleh OsO4 tidak digumpalkan oleh alkohol selama dehidrasi.[14] Osmium(VIII) oksida juga digunakan sebagai pewarna lipida dalam mikroskop optik.[21] OsO4 juga mewarnai kornea manusia (lihat pertimbangan keamanan).

Pewarnaan polimer
[sunting | sunting sumber]OsO4 juga digunakan untuk mewarnai kopolimer secara istimewa, contoh yang paling dikenal adalah kopolimer blok dimana satu fasa dapat diwarnai sehingga dapat menunjukkan struktur mikro material tersebut. Sebagai contoh, kopolimer blok stirena-butadiena memiliki rantai utama polibutadiena dengan terminal polistirena. Bila diberi perlakuan dengan OsO4, matriks butadiena bereaksi secara spesifik dan menyerap oksida. Adanya logam berat cukup untuk memblokir berkas elektron, sehingga domain polistirena terlihat jelas pada film tipis di TEM.
Pemurnian bijih osmium
[sunting | sunting sumber]OsO4 adalah zat antara dalam ekstraksi osmium dari bijihnya. Residu yang mengandung osmium diolah dengan natrium peroksida (Na) membentuk Na, yang dapat larut. Saat terkena klorin, garam ini membentuk OsO4. Pada tahap akhir pemurnian, OsO4 mentah dilarutkan dalam larutan NaOH alkoholik membentuk Na2[OsO2(OH)4], yang, jika diolah dengan NH4Cl, menghasilkan (NH4)4[OsO2Cl2]. Garam ini direduksi di bawah kondisi hidrogen untuk menghasilkan osmium.[8]
Aduk nuckminsterfullerene
[sunting | sunting sumber]OsO4 memungkinkan konfirmasi model bola sepak buckminsterfulerena, sebuah alotropi karbon 60 atom. Aduk ini, yang terbentuk dari derivat OsO4, adalah C60(OsO4)(4-tert-butilpiridin)2. Aduk ini memecah simetri fulerena yang memungkinkan kristalisasi dan konfirmasi struktur C60 melalui kristalografi sinar-X.[22]
Pertimbangan keamanan
[sunting | sunting sumber]
OsO4 sangat beracun, bahkan pada tingkat paparan rendah, dan harus ditangani dengan tindakan pencegahan yang tepat. Khususnya, menghirup pada konsentrasi jauh di bawah bau yang bisa dirasakan dapat menyebabkan edema paru dan berlanjut pada kematian. Gejala yang dapat terlihat bisa baru muncul berjam-jam setelah terpapar.
OsO4 juga menodai kornea manusia, yang dapat menyebabkan kebutaan jika tidak memperhatikan tindakan keselamatan yang tepat. Batas paparan yang diizinkan untuk osmium(VIII) oksida (rata-rata tertimbang 8 jam) adalah 200 µg/m3.[7] Osmium(VIII) oksida dapat menembus plastik dan oleh karena itu harus disimpan dalam wadah kaca di dalam lemari pendingin.[14]
Pada tanggal 6 April 2004 sumber intelijen Inggris meyakimi bahwa mereka telah menggagalkan rencana peledakan bom yang melibatkan OsO4.[23] Para pakar yang diwawancarai oleh New Scientist menegaskan toksisitas osmium(VIII) oksida, meskipun beberapa menyoroti kendala penggunaannya dalam sebuah senjata: osmium(VIII) oksida sangat mahal. Osmium(VIII) oksida dapat dihancurkan oleh ledakan; asap beracun yang tersisa mungkin juga terdispersi oleh ledakan tersebut.[24]
Referensi
[sunting | sunting sumber]- ^ "Osmium tetroxide ICSC: 0528". InChem.
- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0473". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Krebs, B.; Hasse, K. D. (1976). "Refinements of the Crystal Structures of KTcO4, KReO4 and OsO4. The Bond Lengths in Tetrahedral Oxo-Anions and Oxides of d0 Transition Metals". Acta Crystallographica B. 32 (5): 1334–1337. doi:10.1107/S056774087600530X.
- ^ "Osmium tetroxide (as Os)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Girolami, Gregory (2012). "Osmium weighs". Nature Chemistry. 4: 954. doi:10.1038/nchem.1479.
- ^ Cotton and Wilkinson, Advanced Inorganic Chemistry, hlm. 1002
- ^ a b "Osmium tetroxide (as Os)". Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs). Centers for Disease Control.
- ^ a b Thompson, M. "Osmium tetroxide (OsO4)". Bristol University. Diakses tanggal 2012-04-07.
- ^ Butler, I. S.; Harrod, J. F. (1989). Inorganic Chemistry: Principles and Applications. Benjamin / Cummings. hlm. 343. ISBN 978-0-8053-0247-9. Diakses tanggal 2012-04-07.
- ^ Cotton, F. A. (2007). Advanced Inorganic Chemistry (edisi ke-6th). New Delhi, India: J. Wiley. hlm. 1002. ISBN 978-81-265-1338-3.
- ^ a b c Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (edisi ke-2nd). Prentice Hall. hlm. 671–673, 710. ISBN 978-0130399137.
- ^ Ogino, Y.; Chen, H.; Kwong, H.-L.; Sharpless, K. B. (1991). "On the timing of hydrolysis / reoxidation in the osmium-catalyzed asymmetric dihydroxylation of olefins using potassium ferricyanide as the reoxidant". Tetrahedron Letters. 32 (32): 3965–3968. doi:10.1016/0040-4039(91)80601-2.
- ^ Berrisford, D. J.; Bolm, C.; Sharpless, K. B. (1995). "Ligand-Accelerated Catalysis". Angewandte Chemie International Edition. 34 (10): 1059–1070. doi:10.1002/anie.199510591.
- ^ a b c Hayat, M. A. (2000). Principles and Techniques of Electron Microscopy: Biological Applications. Cambridge University Press. hlm. 45–61. ISBN 0-521-63287-0.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Kiernan, J. A. "Re: "Disposal" of Osmium Tetroxide "Waste"". Department of Anatomy & Cell Biology, The University of Western Ontario.
- ^ Christe, K. O.; Dixon, D. A.; Mack, H. G.; Oberhammer, H.; Pagelot, A.; Sanders, J. C. P.; Schrobilgen, G. J. (1993). "Osmium tetrafluoride dioxide, cis-OsO2F4". Journal of the American Chemical Society. 115 (24): 11279–11284. doi:10.1021/ja00077a029.
- ^ Cotton, S. A. (1997). Chemistry of Precious Metals. London: Chapman and Hall. ISBN 0-7514-0413-6.
- ^ Snider, B. B.; Kiselgof, J. Y.; Foxman, B. M. (1998). "Total Syntheses of (±)-Isosteviol and (±)-Beyer-15-ene-3β,19-diol by Manganese(III)-Based Oxidative Quadruple Free-Radical Cyclization". Journal of Organic Chemistry. 63 (22): 7945–7952. doi:10.1021/jo981238x.
- ^ Bozzola, J. J.; Russell, L. D. (1999). "Specimen Preparation for Transmission Electron Microscopy". Electron Microscopy : Principles and Techniques for Biologists. Sudbury, MA: Jones and Bartlett. hlm. 21–31. ISBN 978-0-7637-0192-5.
- ^ Di Scipio, F.; Raimondo, S.; Tos, P.; Geuna, S. (2008). "A simple protocol for paraffin-embedded myelin sheath staining with osmium(VIII) oxide for light microscope observation". Microscopy Research and Technique. 71 (7): 497–502. doi:10.1002/jemt.20577. PMID 18320578.
- ^ Hawkins, J. M.; Meyer, A.; Lewis, T. A.; Loren, S.; Hollander, F. J. (1991). "Crystal Structure of Osmylated C60: Confirmation of the Soccer Ball Framework". Science. 252 (5003): 312–313. doi:10.1126/science.252.5003.312. PMID 17769278.
- ^ "Chemical 'bomb plot' in UK foiled". BBC News. 2004-04-06.
- ^ Bhattacharya, S. (2004-04-07). "Experts divided over poison bomb claim". New Scientist. Diarsipkan dari versi asli tanggal 2008-09-21. Diakses tanggal 2017-05-29.
Pranala luar
[sunting | sunting sumber]- (Inggris) International Chemical Safety Card 0528
- (Inggris) NIOSH Pocket Guide to Chemical Hazards
- (Inggris) CDC - Osmium Tetroxide - NIOSH Workplace Safety and Health Topic
- (Inggris) BBC report on bomb plot
- (Inggris) BBC What is Osmium tetroxide article
- (Inggris) Osmium Tetroxide: Molecule of the Month
- (Inggris) Chemical Reactions


![{\displaystyle {\ce {Os + 2O2 ->[\Delta T] OsO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d2c2ac06e64cd164869ed5506f13c3cfa320d70)