Struktur Lewis: Perbedaan antara revisi
k Bot: Perubahan kosmetika |
Ibuperiwiki (bicara | kontrib) Fitur saranan suntingan: 3 pranala ditambahkan. |
||
| (11 revisi perantara oleh 8 pengguna tidak ditampilkan) | |||
| Baris 17: | Baris 17: | ||
Struktur Lewis untuk ion poliatomik dapat digambar dengan metode yang sama. Saat menghitung elektron, ion negatif harus memiliki elektron ekstra yang ditempatkan dalam struktur Lewis mereka; ion positif harus memiliki elektron yang lebih sedikit daripada molekul yang tidak bermuatan. |
Struktur Lewis untuk ion poliatomik dapat digambar dengan metode yang sama. Saat menghitung elektron, ion negatif harus memiliki elektron ekstra yang ditempatkan dalam struktur Lewis mereka; ion positif harus memiliki elektron yang lebih sedikit daripada molekul yang tidak bermuatan. |
||
[[Berkas:Hypochlorite Lewis Structures V1.svg| |
[[Berkas:Hypochlorite Lewis Structures V1.svg|jmpl|ka|Contoh penulisan struktur Lewis untuk ion [[hipoklorit]].]] |
||
Ketika menulis struktur Lewis sebuah ion, keseluruhan struktur ditempatkan dalam tanda kurung, dan muatannya ditulis sebagai superskrip di kanan atas, di luar tanda kurung. |
Ketika menulis struktur Lewis sebuah ion, keseluruhan struktur ditempatkan dalam tanda kurung, dan muatannya ditulis sebagai superskrip di kanan atas, di luar tanda kurung. |
||
| Baris 28: | Baris 28: | ||
== Muatan formal == |
== Muatan formal == |
||
{{Main article|Muatan formal}} |
{{Main article|Muatan formal}} |
||
Dalam hal struktur Lewis, [[muatan formal]] digunakan dalam deskripsi, perbandingan, dan penilaian struktur [[topologi]] dan [[resonansi (kimia)|resonansi]] yang mungkin terjadi<ref name="miessler_1">{{cite|last1=Miessler|first1=G.L.|last2=Tarr|first2=D.A.|title=Inorganic Chemistry|edition=2nd|publisher=Prentice Hall|year=1998|ISBN=0-13-841891-8|pages=49-53|chapter=Explanation of formal charge usage}}</ref> dengan menentukan muatan elektron semu dari masing-masing atom, berdasarkan struktur titik elektronnya, dengan asumsi kovalensi eksklusif atau ikatan non-polar. Muatan formal telah digunakan dalam menentukan rekonfigurasi elektron yang mungkin ketika mengacu pada [[mekanisme reaksi]], dan |
Dalam hal struktur Lewis, [[muatan formal]] digunakan dalam deskripsi, perbandingan, dan penilaian struktur [[topologi]] dan [[resonansi (kimia)|resonansi]] yang mungkin terjadi<ref name="miessler_1">{{cite|last1=Miessler|first1=G.L.|last2=Tarr|first2=D.A.|title=Inorganic Chemistry|edition=2nd|publisher=Prentice Hall|year=1998|ISBN=0-13-841891-8|pages=49-53|chapter=Explanation of formal charge usage}}</ref> dengan menentukan muatan elektron semu dari masing-masing atom, berdasarkan struktur titik elektronnya, dengan asumsi kovalensi eksklusif atau ikatan non-polar. Muatan formal telah digunakan dalam menentukan rekonfigurasi elektron yang mungkin ketika mengacu pada [[mekanisme reaksi]], dan sering kali menghasilkan tanda yang sama dengan [[muatan parsial]] atom, dengan pengecualian. Secara umum, muatan formal sebuah atom dapat dihitung dengan menggunakan rumus berikut, dengan asumsi definisi non-standar untuk tanda yang digunakan: |
||
:<math>C_f = N_v - U_e - \frac {B_n}{2}</math> |
:<math>C_f = N_v - U_e - \frac {B_n}{2}</math> |
||
| Baris 41: | Baris 41: | ||
== Resonansi == |
== Resonansi == |
||
{{Main article|Struktur resonansi}} |
{{Main article|Struktur resonansi}} |
||
[[Berkas:BF resonance lewis structures.svg| |
[[Berkas:BF resonance lewis structures.svg|jmpl|kiri|Struktur resonansi Lewis untuk BF]] |
||
Untuk beberapa molekul dan ion, sulit untuk menentukan pasangan sunyi mana yang harus dipindahkan untuk membentuk ikatan ganda atau rangkap tiga, dan dua atau lebih struktur ''resonansi'' yang berbeda dapat ditulis untuk molekul atau ion yang sama. Dalam kasus seperti merupakan hal biasa untuk menuliskan semuanya dengan panah dua arah di antara kedua struktur resonansi yang digambar (lihat Contoh di bawah). Hal ini kadang terjadi ketika beberapa atom dengan jenis yang sama mengelilingi atom pusat, dan terutama umum untuk ion poliatomik. |
Untuk beberapa molekul dan ion, sulit untuk menentukan pasangan sunyi mana yang harus dipindahkan untuk membentuk ikatan ganda atau rangkap tiga, dan dua atau lebih struktur ''resonansi'' yang berbeda dapat ditulis untuk molekul atau ion yang sama. Dalam kasus seperti merupakan hal biasa untuk menuliskan semuanya dengan panah dua arah di antara kedua struktur resonansi yang digambar (lihat Contoh di bawah). Hal ini kadang terjadi ketika beberapa atom dengan jenis yang sama mengelilingi atom pusat, dan terutama umum untuk ion poliatomik. |
||
Ketika situasi ini terjadi, struktur Lewis molekul dikatakan sebagai [[resonansi (kimia)|struktur resonansi]], dan molekulnya berada sebagai hibrida resonansi. Masing-masing kemungkinan yang berbeda bertindihan pada yang lain, dan molekul tersebut dianggap memiliki struktur Lewis yang setara dengan beberapa kombinasi dari keadaan ini. |
Ketika situasi ini terjadi, struktur Lewis molekul dikatakan sebagai [[resonansi (kimia)|struktur resonansi]], dan molekulnya berada sebagai hibrida resonansi. Masing-masing kemungkinan yang berbeda bertindihan pada yang lain, dan molekul tersebut dianggap memiliki struktur Lewis yang setara dengan beberapa kombinasi dari keadaan ini. |
||
[[Berkas:Nitrate Lewis dot structure.jpg| |
[[Berkas:Nitrate Lewis dot structure.jpg|jmpl|kiri|Struktur Lewis ion nitrat]] |
||
Ion nitrat ({{chem|NO|3|−}}), misalnya, harus membentuk ikatan rangkap antara nitrogen dan salah satu oksigen untuk memenuhi aturan oktet pada nitrogen. Namun, karena molekulnya simetris, tidak masalah oksigen ''yang mana'' yang membentuk ikatan rangkap. Dalam kasus ini, ada tiga struktur resonansi yang mungkin. Mengekspresikan resonansi saat menggambar struktur Lewis dapat dilakukan dengan menggambar setiap bentuk resonansi yang mungkin dan menempatkan panah dua arah di antara keduanya atau dengan menggunakan garis putus-putus untuk mewakili ikatan parsial (yang terakhir adalah representasi hibrida resonansi yang baik meskipun bukan struktur Lewis formal). |
Ion nitrat ({{chem|NO|3|−}}), misalnya, harus membentuk ikatan rangkap antara nitrogen dan salah satu oksigen untuk memenuhi aturan oktet pada nitrogen. Namun, karena molekulnya simetris, tidak masalah oksigen ''yang mana'' yang membentuk ikatan rangkap. Dalam kasus ini, ada tiga struktur resonansi yang mungkin. Mengekspresikan resonansi saat menggambar struktur Lewis dapat dilakukan dengan menggambar setiap bentuk resonansi yang mungkin dan menempatkan panah dua arah di antara keduanya atau dengan menggunakan garis putus-putus untuk mewakili ikatan parsial (yang terakhir adalah representasi hibrida resonansi yang baik meskipun bukan struktur Lewis formal). |
||
Ketika membandingkan struktur resonansi untuk molekul yang sama, biasanya yang memiliki muatan formal paling sedikit adalah yang berkontribusi lebih banyak terhadap hibrida resonansi keseluruhan. Bila muatan formal diperlukan, lebih disukai struktur resonansi yang memiliki muatan negatif pada unsur yang lebih elektronegatif dan muatan positif pada unsur yang kurang elektronegatif. |
Ketika membandingkan struktur resonansi untuk molekul yang sama, biasanya yang memiliki muatan formal paling sedikit adalah yang berkontribusi lebih banyak terhadap hibrida resonansi keseluruhan. Bila muatan formal diperlukan, lebih disukai struktur resonansi yang memiliki muatan negatif pada unsur yang lebih elektronegatif dan muatan positif pada unsur yang kurang elektronegatif. |
||
[[Berkas:Hexa sulf.png| |
[[Berkas:Hexa sulf.png|jmpl|ka|Struktur resonansi belerang heksafluorida.]] |
||
Ikatan tunggal juga dapat dipindahkan dengan cara yang sama untuk menciptakan struktur resonansi untuk [[molekul hipervalen]] seperti [[belerang heksafluorida]], yang merupakan deskripsi yang benar menurut perhitungan kimia kuantum, bukan model oktet umum yang diperluas. |
Ikatan tunggal juga dapat dipindahkan dengan cara yang sama untuk menciptakan struktur resonansi untuk [[molekul hipervalen]] seperti [[belerang heksafluorida]], yang merupakan deskripsi yang benar menurut perhitungan [[kimia kuantum]], bukan model oktet umum yang diperluas. |
||
Struktur resonansi tidak boleh ditafsirkan untuk menunjukkan bahwa molekul tersebut beralih antar bentuk, namun molekul tersebut bertindak sebagai rata-rata berbagai bentuk. |
Struktur resonansi tidak boleh ditafsirkan untuk menunjukkan bahwa molekul tersebut beralih antar bentuk, namun molekul tersebut bertindak sebagai rata-rata berbagai bentuk. |
||
| Baris 66: | Baris 66: | ||
# Ikat ujung yang longgar. Dua struktur Lewis harus digambar: Setiap struktur memiliki salah satu dari dua atom oksigen yang berikatan ganda dengan atom nitrogen. Atom oksigen kedua di setiap struktur akan berikatan tunggal dengan atom nitrogen. Tempatkan tanda kurung di sekitar masing-masing struktur, dan tambahkan muatan (−) pada kanan atas di luar tanda kurung. Gambarlah panah dua arah di antara dua bentuk resonansi. |
# Ikat ujung yang longgar. Dua struktur Lewis harus digambar: Setiap struktur memiliki salah satu dari dua atom oksigen yang berikatan ganda dengan atom nitrogen. Atom oksigen kedua di setiap struktur akan berikatan tunggal dengan atom nitrogen. Tempatkan tanda kurung di sekitar masing-masing struktur, dan tambahkan muatan (−) pada kanan atas di luar tanda kurung. Gambarlah panah dua arah di antara dua bentuk resonansi. |
||
[[Berkas:Nitrite-ion-lewis-canonical. |
[[Berkas:Nitrite-ion-lewis-canonical.svg|pus|500px]] |
||
== Format alternatif == |
== Format alternatif == |
||
| Baris 74: | Baris 74: | ||
\ce{CH3CH2CH2CH3} |
\ce{CH3CH2CH2CH3} |
||
\end{matrix}</math>}} |
\end{matrix}</math>}} |
||
[[Berkas:Butane-skeletal.png| |
[[Berkas:Butane-skeletal.png|jmpl|ka|200px|Skema kerangka [[butana]].]] |
||
Struktur kimia dapat ditulis dalam bentuk yang lebih kompak, terutama bila menunjukkan [[senyawa organik|molekul organik]]. Dalam rumus struktur ringkas, banyak atau bahkan semua ikatan kovalen mungkin ditinggalkan, dengan subskrip yang menunjukkan jumlah gugus identik yang terikat pada atom tertentu. Diagram struktur ringkas lainnya adalah [[rumus kerangka]] (juga dikenal sebagai rumus garis-ikatan atau diagram kerangka karbon). Dalam rumus kerangka, atom karbon tidak ditandai oleh simbol C tetapi oleh [[verteks (teori grafis)|simpul]]<!--vertex (graph theory)--> garis. Atom hidrogen yang terikat pada karbon tidak diperlihatkan—mereka dapat disimpulkan dengan menghitung jumlah ikatan pada atom karbon tertentu—masing-masing karbon diasumsikan memiliki total empat ikatan, sehingga setiap ikatan yang tidak ditunjukkan adalah atom hidrogen. |
[[Struktur kimia]] dapat ditulis dalam bentuk yang lebih kompak, terutama bila menunjukkan [[senyawa organik|molekul organik]]. Dalam rumus struktur ringkas, banyak atau bahkan semua ikatan kovalen mungkin ditinggalkan, dengan subskrip yang menunjukkan jumlah gugus identik yang terikat pada atom tertentu. Diagram struktur ringkas lainnya adalah [[rumus kerangka]] (juga dikenal sebagai rumus garis-ikatan atau diagram kerangka karbon). Dalam rumus kerangka, atom karbon tidak ditandai oleh simbol C tetapi oleh [[verteks (teori grafis)|simpul]]<!--vertex (graph theory)--> garis. Atom hidrogen yang terikat pada karbon tidak diperlihatkan—mereka dapat disimpulkan dengan menghitung jumlah ikatan pada atom karbon tertentu—masing-masing karbon diasumsikan memiliki total empat ikatan, sehingga setiap ikatan yang tidak ditunjukkan adalah [[atom hidrogen]]. |
||
Diagram lain mungkin lebih kompleks daripada struktur Lewis, menunjukkan ikatan dalam 3D menggunakan berbagai bentuk seperti {{ill|model ruang terisi|en|Space-filling model}}. |
Diagram lain mungkin lebih kompleks daripada struktur Lewis, menunjukkan ikatan dalam 3D menggunakan berbagai bentuk seperti {{ill|model ruang terisi|en|Space-filling model}}. |
||
== Penulisan == |
|||
'''Penulisan struktur Lewis''' adalah salah satu cara penulisan [[senyawa kimia]]. Walaupun aturan oktet dan struktur lewis tidak dapat menggambarkan ikatan kovalen secara lengkap, keduanya sangat membantu untuk menjelaskan bentuk ikatan dalam beberapa senyawa dan menjelaskan sifat-sifatnya dan reaksi molekulnya.<ref name=":1">Chang, raymond.2003.''Kimia dasar: konsep-konsep inti jilid 1/edisi ketiga.''Jakarta:Erlangga</ref> Rumus lewis untuk beberapa molekul kovalen dan ion sangat berguna, antara lain untuk mempelajari geometri suatu molekul.<ref>Bakri, mustafal.2008.''SPM kimia SMA dan MA.''Jakarta:ESIS</ref> |
|||
=== Tahapan === |
|||
Penulisan struktur lewis mengikuti tahap-tahap sebagai berikut:<ref name=":1" /> |
|||
# Tulislah kerangka struktur dari senyawa bersangkutan, yang teridiri dari lambang kimia atom-atom yang terlibat dan menempatkan atom-atom yang berikatan secara berdekatan satu sama lain. Tahap ini cukup mudah dikerjakan untuk senyawa yang sederhana, tetapi untuk senyawa yang lebih rumit harus ada informasi yang sudah diketahui atau dengan membuat kerangka yang paling mungkin. Secara umum, atom dengan keelektronegatifan terkecil menempati posisi di tengah (pusat). Hidrogen dan fluorin biasanya menempati posisi ujung pada struktur lewis. |
|||
# Hitunglah jumlah total elektron valensi dari semua atom yang terlibat. Untuk anion poliatomik, tambahkan juga perlu muatan negatifnya ke dalam jumlah elektron valensi. (misalnya, untuk ion CO<sub>3</sub><sup>2- </sup>kita tambahkan2 elektron karena muatan 2- menunjukan bahwa terdapat dua elektron tambahan daripada yang diberikan oleh atom netral). Untuk kation poliatomik jumlah elektron valensi dikurangi jumlah muatan positifnya. (misalnya, untuk kation NH<sub>4</sub><sup>+</sup> jumalh elektron valensi dikurangi satu karena muatan 1+ menandakan lepasnya satu elektron dari atom netral). |
|||
# Gambarlah ikatan kovalen tunggal antara atom pusat dengan semua atom di sekitarnya. Lengkapi oktet dari semua atom yang terikat pada atom pusat. (ingat bahwa kulit valensi atom hidrogen maksimum ditempati hanya oleh dua elektron.) elektron dari atom pusat atau atom sekitar harus dituliskan sebagai pasangan elektron bebas jika elektron tersebut tidak terlibat dalam pembentukaan ikatan. Jumlah total elektron yang digunakan untuk ikatan adalah jumlah yang telah dihitung pada tahap 2 di atas. |
|||
# Jika aturan oktet belum tercapai pada atom pusat, gunakan pasangan elektron bebas dari atom-atom di sekitarnya untuk menambahkan ikatan rangkap dua atau rangkap tiga di antara atom pusat dan atom di sekitarnya sampai aturan terpenuhi |
|||
== Lihat juga == |
== Lihat juga == |
||
Revisi terkini sejak 18 November 2023 14.36
Struktur Lewis (juga dikenal sebagai diagram titik Lewis, rumus titik Lewis, struktur titik Lewis, dan struktur titik elektron) adalah diagram yang menunjukkan ikatan antara atom-atom suatu molekul dengan pasangan elektron sunyi yang mungkin ada dalam molekul.[1][2][3] Struktur Lewis dapat digambar untuk setiap molekul berikatan kovalen, serta senyawa koordinasi. Struktur Lewis dinamai menurut Gilbert N. Lewis, yang memperkenalkan dalam artikel 1916-nya The Atom and the Molecule..[4] Struktur Lewis memperluas konsep diagram titik elektron dengan menambahkan garis di antara atom untuk mewakili pasangan bersama dalam ikatan kimia.
Struktur Lewis menunjukkan masing-masing atom dan posisinya dalam struktur molekul menggunakan simbol kimianya. Garis digambar di antara atom yang saling terikat satu sama lain (pasang titik bisa digunakan sebagai pengganti garis). Kelebihan elektron yang membentuk pasangan sunyi diwakili sebagai pasang titik, dan ditempatkan di sebelah atom.
Meskipun unsur golongan utama dari periode kedua dan seterusnya biasanya bereaksi dengan mendapatkan, kehilangan, atau berbagi elektron sampai mereka mencapai konfigurasi kelopak elektron valensi dengan oktet penuh (8) elektron, unsur lain mematuhi peraturan yang berbeda. Hidrogen (H) hanya dapat membentuk ikatan yang hanya memiliki dua elektron, sedangkan logam transisi sering sesuai dengan aturan duodektet (12)[5] (misalnya, senyawa seperti ion permanganat).
Membuat struktur
[sunting | sunting sumber]Menghitung elektron
[sunting | sunting sumber]Jumlah elektron yang terwakili dalam struktur Lewis sama dengan jumlah elektron valensi pada masing-masing atom. Elektron non-valensi tidak terwakili dalam struktur Lewis.
Setelah jumlah elektron yang tersedia telah ditentukan, elektron harus ditempatkan ke dalam struktur. Pada awalnya mereka harus ditempatkan sebagai pasangan sunyi: sepasang titik untuk setiap pasang elektron yang tersedia. Pasangan sunyi awalnya harus ditempatkan pada atom terluar (selain hidrogen) sampai masing-masing atom terluar memiliki delapan elektron pada pasangan ikatan dan pasangan sunyi; pasangan sunyi yang tersisa kemudian bisa ditempatkan di atom pusat. Bila ragu, pasangan sunyi harus ditempatkan pada atom yang lebih elektronegatif terlebih dahulu.
Begitu semua pasangan elektron sunyi ditempatkan, atom—terutama atom pusat—mungkin tidak memiliki oktet elektron. Dalam hal ini, atom harus membentuk ikatan rangkap; satu pasang elektron sunyi dipindahkan untuk membentuk ikatan kedua antara kedua atom. Oleh karena pasangan ikatan dibagi antara dua atom, atom yang semula memiliki pasangan sunyi masih memiliki oktet; atom lainnya sekarang memiliki dua elektron lagi di dalam kelopak valensinya.
Struktur Lewis untuk ion poliatomik dapat digambar dengan metode yang sama. Saat menghitung elektron, ion negatif harus memiliki elektron ekstra yang ditempatkan dalam struktur Lewis mereka; ion positif harus memiliki elektron yang lebih sedikit daripada molekul yang tidak bermuatan.

Ketika menulis struktur Lewis sebuah ion, keseluruhan struktur ditempatkan dalam tanda kurung, dan muatannya ditulis sebagai superskrip di kanan atas, di luar tanda kurung.
Metode yang lebih sederhana telah diusulkan untuk menyusun struktur Lewis, sehingga menghilangkan kebutuhan untuk mencacah elektron: atom yang digambar menunjukkan elektron valensi; ikatan kemudian dibentuk dengan memasangkan elektron valensi atom yang terlibat dalam proses pembuatan ikatan, dan anion dan kation dibentuk dengan menambahkan atau melepaskan elektron ke/dari atom yang sesuai.[6]
Sebuah trik adalah menghitung elektron valensi, kemudian menghitung jumlah elektron yang dibutuhkan untuk menyelesaikan aturan oktet (atau hanya 2 elektron untuk hidrogen), maka selisih dua angka ini adalah jumlah elektron yang membentuk ikatan. Elektron yang tersisa pergi untuk mengisi oktet atom lainnya.
Telah diusulkan prosedur sederhana dan umum lainnya untuk menulis struktur Lewis dan bentuk resonansinya.[7]
Muatan formal
[sunting | sunting sumber]Dalam hal struktur Lewis, muatan formal digunakan dalam deskripsi, perbandingan, dan penilaian struktur topologi dan resonansi yang mungkin terjadi[8] dengan menentukan muatan elektron semu dari masing-masing atom, berdasarkan struktur titik elektronnya, dengan asumsi kovalensi eksklusif atau ikatan non-polar. Muatan formal telah digunakan dalam menentukan rekonfigurasi elektron yang mungkin ketika mengacu pada mekanisme reaksi, dan sering kali menghasilkan tanda yang sama dengan muatan parsial atom, dengan pengecualian. Secara umum, muatan formal sebuah atom dapat dihitung dengan menggunakan rumus berikut, dengan asumsi definisi non-standar untuk tanda yang digunakan:
dengan:
- adalah muatan formal.
- mewakili jumlah elektron valensi dalam atom bebas dari unsur tersebut.
- mewakili jumlah elektron yang tak berbagi pada atom.
- mewakili jumlah elektron dalam ikatan yang dimiliki bersama oleh atom-atom yang berikatan.
Muatan formal sebuah atom dihitung sebagai perbedaan antara jumlah elektron valensi yang dimiliki atom netral dan jumlah elektron yang termasuk dalam struktur Lewis. Elektron dalam ikatan kovalen dibagi rata antara atom yang terlibat dalam ikatan. Total muatan formal pada ion harus sama dengan muatan ion, dan total muatan formal pada molekul netral harus sama dengan nol.
Resonansi
[sunting | sunting sumber]
Untuk beberapa molekul dan ion, sulit untuk menentukan pasangan sunyi mana yang harus dipindahkan untuk membentuk ikatan ganda atau rangkap tiga, dan dua atau lebih struktur resonansi yang berbeda dapat ditulis untuk molekul atau ion yang sama. Dalam kasus seperti merupakan hal biasa untuk menuliskan semuanya dengan panah dua arah di antara kedua struktur resonansi yang digambar (lihat Contoh di bawah). Hal ini kadang terjadi ketika beberapa atom dengan jenis yang sama mengelilingi atom pusat, dan terutama umum untuk ion poliatomik.
Ketika situasi ini terjadi, struktur Lewis molekul dikatakan sebagai struktur resonansi, dan molekulnya berada sebagai hibrida resonansi. Masing-masing kemungkinan yang berbeda bertindihan pada yang lain, dan molekul tersebut dianggap memiliki struktur Lewis yang setara dengan beberapa kombinasi dari keadaan ini.

Ion nitrat (NO−3), misalnya, harus membentuk ikatan rangkap antara nitrogen dan salah satu oksigen untuk memenuhi aturan oktet pada nitrogen. Namun, karena molekulnya simetris, tidak masalah oksigen yang mana yang membentuk ikatan rangkap. Dalam kasus ini, ada tiga struktur resonansi yang mungkin. Mengekspresikan resonansi saat menggambar struktur Lewis dapat dilakukan dengan menggambar setiap bentuk resonansi yang mungkin dan menempatkan panah dua arah di antara keduanya atau dengan menggunakan garis putus-putus untuk mewakili ikatan parsial (yang terakhir adalah representasi hibrida resonansi yang baik meskipun bukan struktur Lewis formal).
Ketika membandingkan struktur resonansi untuk molekul yang sama, biasanya yang memiliki muatan formal paling sedikit adalah yang berkontribusi lebih banyak terhadap hibrida resonansi keseluruhan. Bila muatan formal diperlukan, lebih disukai struktur resonansi yang memiliki muatan negatif pada unsur yang lebih elektronegatif dan muatan positif pada unsur yang kurang elektronegatif.

Ikatan tunggal juga dapat dipindahkan dengan cara yang sama untuk menciptakan struktur resonansi untuk molekul hipervalen seperti belerang heksafluorida, yang merupakan deskripsi yang benar menurut perhitungan kimia kuantum, bukan model oktet umum yang diperluas.
Struktur resonansi tidak boleh ditafsirkan untuk menunjukkan bahwa molekul tersebut beralih antar bentuk, namun molekul tersebut bertindak sebagai rata-rata berbagai bentuk.
Contoh
[sunting | sunting sumber]Rumus ion nitrit adalah NO−2.
- Nitrogen adalah atom yang kurang elektronegatif di antara keduanya, jadi ia adalah atom sentral berdasarkan beberapa kriteria.
- Hitunglah elektron valensi. Nitrogen memiliki 5 elektron valensi; masing-masing oksigen memiliki 6, sehingga total elektron valensi adalah (6 × 2) + 5 = 17. Ion nitrit memiliki muatan −1, yang mengindikasikan ada elektron ekstra, sehingga jumlah elektron adalah 18.
- Tempatkan pasangan elektron sunyi. Setiap oksigen harus terikat pada nitrogen, yang menggunakan empat elektron—dua di setiap ikatan. Empat belas elektron yang tersisa awalnya harus ditempatkan sebagai 7 pasangan sunyi. Setiap oksigen dapat mengambil maksimal 3 pasangan sunyi, masing-masing memberikan 8 elektron kepada oksigen termasuk pasangan ikatan. Pasangan sunyi ketujuh harus ditempatkan pada atom nitrogen.
- Melengkapi aturan oktet. Kedua atom oksigen saat ini memiliki 8 elektron yang ditugaskan untuk mereka. Atom nitrogen hanya memiliki 6 elektron yang ditugaskan untuk itu. Salah satu pasangan sunyi pada atom oksigen harus membentuk ikatan rangkap, namun atom keduanya juga sama saja. Oleh karena itu, ada struktur resonansi.
- Ikat ujung yang longgar. Dua struktur Lewis harus digambar: Setiap struktur memiliki salah satu dari dua atom oksigen yang berikatan ganda dengan atom nitrogen. Atom oksigen kedua di setiap struktur akan berikatan tunggal dengan atom nitrogen. Tempatkan tanda kurung di sekitar masing-masing struktur, dan tambahkan muatan (−) pada kanan atas di luar tanda kurung. Gambarlah panah dua arah di antara dua bentuk resonansi.
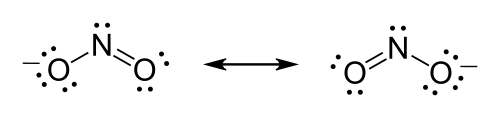
Format alternatif
[sunting | sunting sumber]
Struktur kimia dapat ditulis dalam bentuk yang lebih kompak, terutama bila menunjukkan molekul organik. Dalam rumus struktur ringkas, banyak atau bahkan semua ikatan kovalen mungkin ditinggalkan, dengan subskrip yang menunjukkan jumlah gugus identik yang terikat pada atom tertentu. Diagram struktur ringkas lainnya adalah rumus kerangka (juga dikenal sebagai rumus garis-ikatan atau diagram kerangka karbon). Dalam rumus kerangka, atom karbon tidak ditandai oleh simbol C tetapi oleh simpul garis. Atom hidrogen yang terikat pada karbon tidak diperlihatkan—mereka dapat disimpulkan dengan menghitung jumlah ikatan pada atom karbon tertentu—masing-masing karbon diasumsikan memiliki total empat ikatan, sehingga setiap ikatan yang tidak ditunjukkan adalah atom hidrogen.
Diagram lain mungkin lebih kompleks daripada struktur Lewis, menunjukkan ikatan dalam 3D menggunakan berbagai bentuk seperti model ruang terisi.
Penulisan
[sunting | sunting sumber]Penulisan struktur Lewis adalah salah satu cara penulisan senyawa kimia. Walaupun aturan oktet dan struktur lewis tidak dapat menggambarkan ikatan kovalen secara lengkap, keduanya sangat membantu untuk menjelaskan bentuk ikatan dalam beberapa senyawa dan menjelaskan sifat-sifatnya dan reaksi molekulnya.[9] Rumus lewis untuk beberapa molekul kovalen dan ion sangat berguna, antara lain untuk mempelajari geometri suatu molekul.[10]
Tahapan
[sunting | sunting sumber]Penulisan struktur lewis mengikuti tahap-tahap sebagai berikut:[9]
- Tulislah kerangka struktur dari senyawa bersangkutan, yang teridiri dari lambang kimia atom-atom yang terlibat dan menempatkan atom-atom yang berikatan secara berdekatan satu sama lain. Tahap ini cukup mudah dikerjakan untuk senyawa yang sederhana, tetapi untuk senyawa yang lebih rumit harus ada informasi yang sudah diketahui atau dengan membuat kerangka yang paling mungkin. Secara umum, atom dengan keelektronegatifan terkecil menempati posisi di tengah (pusat). Hidrogen dan fluorin biasanya menempati posisi ujung pada struktur lewis.
- Hitunglah jumlah total elektron valensi dari semua atom yang terlibat. Untuk anion poliatomik, tambahkan juga perlu muatan negatifnya ke dalam jumlah elektron valensi. (misalnya, untuk ion CO32- kita tambahkan2 elektron karena muatan 2- menunjukan bahwa terdapat dua elektron tambahan daripada yang diberikan oleh atom netral). Untuk kation poliatomik jumlah elektron valensi dikurangi jumlah muatan positifnya. (misalnya, untuk kation NH4+ jumalh elektron valensi dikurangi satu karena muatan 1+ menandakan lepasnya satu elektron dari atom netral).
- Gambarlah ikatan kovalen tunggal antara atom pusat dengan semua atom di sekitarnya. Lengkapi oktet dari semua atom yang terikat pada atom pusat. (ingat bahwa kulit valensi atom hidrogen maksimum ditempati hanya oleh dua elektron.) elektron dari atom pusat atau atom sekitar harus dituliskan sebagai pasangan elektron bebas jika elektron tersebut tidak terlibat dalam pembentukaan ikatan. Jumlah total elektron yang digunakan untuk ikatan adalah jumlah yang telah dihitung pada tahap 2 di atas.
- Jika aturan oktet belum tercapai pada atom pusat, gunakan pasangan elektron bebas dari atom-atom di sekitarnya untuk menambahkan ikatan rangkap dua atau rangkap tiga di antara atom pusat dan atom di sekitarnya sampai aturan terpenuhi
Lihat juga
[sunting | sunting sumber]- Teori VSEPR (Valence shell electron pair repulsion)
- Geometri molekul
- Rumus struktur
- Orbital ikatan alami
Referensi
[sunting | sunting sumber]- ^ IUPAC definition of Lewis formula
- ^ Zumdahl, S. (2005), Chemical Principles, Houghton-Mifflin, ISBN 0-618-37206-7
- ^ G.L. Miessler; D.A. Tar (2003), Inorganic Chemistry (edisi ke-2nd), Pearson Prentice–Hall, ISBN 0-13-035471-6
- ^ Lewis, G. N. (1916), "The Atom and the Molecule", J. Am. Chem. Soc., 38 (4): 762–85, doi:10.1021/ja02261a002
- ^ Weinhold, Frank; Landis, Clark R. (2005). Valency and bonding: A Natural Bond Orbital Donor-Acceptor Perspective. Cambridge: Cambridge University Press. hlm. 367. ISBN 0-521-83128-8.
- ^ Miburo, Barnabe B. (1993), "Simplified Lewis Structure Drawing for Non-science Majors", J. Chem. Educ., 75 (3): 317, Bibcode:1998JChEd..75..317M, doi:10.1021/ed075p317
- ^ Lever, A. B. P. (1972), "Lewis Structures and the Octet Rule", J. Chem. Educ., 49 (12): 819, Bibcode:1972JChEd..49..819L, doi:10.1021/ed049p819
- ^ Miessler, G.L.; Tarr, D.A. (1998), "Explanation of formal charge usage", Inorganic Chemistry (edisi ke-2nd), Prentice Hall, hlm. 49–53, ISBN 0-13-841891-8
- ^ a b Chang, raymond.2003.Kimia dasar: konsep-konsep inti jilid 1/edisi ketiga.Jakarta:Erlangga
- ^ Bakri, mustafal.2008.SPM kimia SMA dan MA.Jakarta:ESIS






