Lakmus: Perbedaan antara revisi
Membalikkan revisi 8229436 oleh 114.124.25.56 (bicara) Tulisan copas dari alatkimia.com |
|||
| (15 revisi perantara oleh 9 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
[[Berkas:Lackmus.jpg|ka|jmpl|Bubuk lakmus]] |
|||
{{rapikan}} |
|||
'''Lakmus''' adalah campuran [[zat]] [[pewarna]] berbeda yang larut dalam air yang diekstrak dari [[lumut]]. Campuran ini sering diserap ke dalam [[kertas saring]] untuk menghasilkan salah satu bentuk tertua dari [[Indikator asam-basa|indikator pH]], yaitu kertas lakmus, yang digunakan untuk menguji kadar keasaman bahan. |
|||
| ⚫ | |||
| ⚫ | |||
== Bahan kimia == |
|||
[[Berkas:7-hydroxyphenoxazone.svg|ka|jmpl|Struktur kimia 7-hidroksifenoksazon, komponen [[kromofor]] pada lakmus]] |
|||
Campuran lakmus memiliki [[nomor CAS]] 1393-92-6 dan mengandung 10 hingga 15 zat warna yang berbeda. Komponen kimia yang paling sering digunakan dalam lakmus hampir serupa dengan campuran yang dikenal sebagai [[orsein]], tetapi dengan proporsi yang berbeda. Berbeda dengan orsein, konstituen utama lakmus memiliki massa molekul rata-rata 3300.<ref>{{cite journal |author=Beecken, H. |author2=E-M. Gottschalk |author3=U. v Gizycki |author4=H. Krämer |author5=D. Maassen |author6=H-G. Matthies |author7=H. Musso |author8=C. Rathjen |author9=Ul. Zdhorszky |title=Orcein and Litmus |journal=Biotechnic & Histochemistry |year=2003 |volume=78 |issue=6 |pages=289–302 |doi=10.1080/10520290410001671362}}</ref> Indikator asam-basa pada lakmus memiliki sifat seperti kromofor 7-hidroksifenoksazon.<ref>{{cite journal |author=H. Musso, C. Rathjen |title=Orcein dyes. X. Light absorption and chromophore of litmus |journal=Chem. Ber. |volume=92 |pages=751–3|issue=3|year=1959|doi=10.1002/cber.19590920331}}</ref> Beberapa fraksi lakmus diberi nama yang khas termasuk [[eritrolitmin]] (atau eritrolein), azolitmin, spaniolitmin, leukoorsein, dan leukazolitmin. Azolitmin menunjukkan efek yang hampir sama dengan lakmus.<ref>E.T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht '''1846''', Verlag E. Anton (Germany)</ref> |
|||
== Penggunaan == |
|||
[[Berkas:Litmus paper.JPG|jmpl|Kertas lakmus yang telah digunakan]] |
|||
Semua [[asam]] dan [[basa]] mempunyai sifat sifat tertentu, tidak semua [[asam]] mempunyai sifat yang sama demikian juga pada [[basa]]. Kita juga sudah mengenal bahwa [[asam]] terbagi menjadi dua yaitu '''asam lemah''' dan '''asam kuat''', demikian juga basa, ada '''basa kuat''' dan '''basa lemah'''. Kekuatan [[asam]] atau [[basa]] tergantung dari bagaimana suatu senyawa diuraikan dalam pembentukan ion-ion jika senyawa tersebut dalam air. |
Semua [[asam]] dan [[basa]] mempunyai sifat sifat tertentu, tidak semua [[asam]] mempunyai sifat yang sama demikian juga pada [[basa]]. Kita juga sudah mengenal bahwa [[asam]] terbagi menjadi dua yaitu '''asam lemah''' dan '''asam kuat''', demikian juga basa, ada '''basa kuat''' dan '''basa lemah'''. Kekuatan [[asam]] atau [[basa]] tergantung dari bagaimana suatu senyawa diuraikan dalam pembentukan ion-ion jika senyawa tersebut dalam air. |
||
[[Asam]] atau [[basa]] juga bersifat [[elektrolit]], daya hantar larutan [[elektrolit]] bergantung pada konsentrasi ion-ion dalam larutan. [[Elektrolit]] kuat jika dapat terionisasi secara sempurna sehingga konsentrasi ion relatif besar, [[elektrolit]] lemah jika hanya sebagian kecil saja yang dapat terionisasi, sehingga konsentrasi ion relatif sedikit. Untuk mengetahui suatu larutan termasuk [[elektrolit]] atau bukan dapat menggunakan [[alat penguji elektrolit]] atau juga dapat menggunakan alat '''pH meter''', dan '''indikator universal''' untuk mengetahui [[pH]] suatu larutan secara langsung sehingga dapat diketahui apakah larutan tersebut termasuk [[asam]], [[basa]] atau [[garam]]. Nilai [[pH]] ditunjukkan dengan skala, secara sistematis dengan nomor 0-14. |
|||
Warna kertas lakmus dalam larutan [[asam]], larutan [[basa]], dan larutan bersifat netral berbeda. Ada dua macam kertas lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing kertas lakmus tersebut sebagai berikut. |
Warna kertas lakmus dalam larutan [[asam]], larutan [[basa]], dan larutan bersifat netral berbeda. Ada dua macam kertas lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing kertas lakmus tersebut sebagai berikut. |
||
# Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru dan dalam larutan netral berwarna merah. |
# Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru dan dalam larutan netral berwarna merah. |
||
# Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru dan dalam larutan netral berwarna biru. |
# Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru dan dalam larutan netral berwarna biru. |
||
# [[Metil merah]] dalam larutan asam berwarna merah dan dalam larutan basa berwarna kuning dan dalam larutan netral berwarna kuning. |
|||
# [[Metil Jingga]] dalam larutan asam berwarna merah dan dalam larutan basa berwarna kuning dan dalam larutan netral berwarna kuning. |
|||
# [[Fenolftalin]] dalam larutan asam akan tidak berwarna dan dalam larutan basa berwarna merah ungu dan dalam larutan netral akan tidak berwarna. |
|||
Kertas lakmus biru berubah warna menjadi merah di bawah kondisi asam dan kertas lakmus merah menjadi biru di bawah kondisi basa atau alkali, dengan perubahan warna yang terjadi di atas rentang [[pH]] 4.5–8.3 pada {{convert|25|C}}. Kertas lakmus pada keadaan [[PH|netral]] berwarna ungu.<ref name="roempp">Manfred Neupert: ''Lackmus'' dalam ''Römpp Lexikon Chemie (Bahasa Jerman)'', 31 Januari 2013.</ref> |
|||
| ⚫ | |||
Reaksi kimia selain asam-basa dapat pula menghasilkan perubahan warna pada kertas lakmus. Misalnya, gas [[klorin]] mengubah kertas lakmus biru menjadi putih,<ref>[http://www.ucc.ie/academic/chem/dolchem/html/elem/elem017.html UCC - Chlorine]</ref> karena kehadiran ion [[hipoklorit]]. Reaksi ini tidak bolak-balik, sehingga lakmus tidak berperan sebagai indikator dalam situasi tersebut. |
|||
== Lihat pula == |
|||
{{portal|kimia}} |
|||
* [[Indikator asam-basa]] |
|||
** [[Fenolftalein]] |
|||
** [[Bromotimol biru]] |
|||
* [[Indikator universal]] |
|||
* [[pH meter]], alat yang dapat menentukan nilai [[pH]] asam-basa secara presisi |
|||
* [[Senyawa azo]], senyawa yang berperan penting pada indikator [[metil jingga]] dan [[metil merah]] |
|||
== Referensi == |
|||
{{reflist|30em}} |
|||
== Pranala luar == |
|||
{{Wiktionary}} |
|||
{{peralatan lab}} |
|||
{{Authority control}} |
|||
[[Kategori:Kimia]] |
[[Kategori:Kimia]] |
||
[[Kategori:Indikator pH]] |
|||
[[Kategori:Peralatan laboratorium]] |
|||
| ⚫ | |||
Revisi terkini sejak 22 November 2022 16.09

Lakmus adalah campuran zat pewarna berbeda yang larut dalam air yang diekstrak dari lumut. Campuran ini sering diserap ke dalam kertas saring untuk menghasilkan salah satu bentuk tertua dari indikator pH, yaitu kertas lakmus, yang digunakan untuk menguji kadar keasaman bahan.
Kertas yang mengandung campuran tersebut (disebut sebagai kertas lakmus) adalah suatu kertas dari bahan kimia yang akan berubah warna jika dicelupkan kedalam larutan asam atau basa. Warna yang dihasilkan sangat dipengaruhi oleh kadar pH dalam larutan yang ada.
Bahan kimia
[sunting | sunting sumber]
Campuran lakmus memiliki nomor CAS 1393-92-6 dan mengandung 10 hingga 15 zat warna yang berbeda. Komponen kimia yang paling sering digunakan dalam lakmus hampir serupa dengan campuran yang dikenal sebagai orsein, tetapi dengan proporsi yang berbeda. Berbeda dengan orsein, konstituen utama lakmus memiliki massa molekul rata-rata 3300.[1] Indikator asam-basa pada lakmus memiliki sifat seperti kromofor 7-hidroksifenoksazon.[2] Beberapa fraksi lakmus diberi nama yang khas termasuk eritrolitmin (atau eritrolein), azolitmin, spaniolitmin, leukoorsein, dan leukazolitmin. Azolitmin menunjukkan efek yang hampir sama dengan lakmus.[3]
Penggunaan
[sunting | sunting sumber]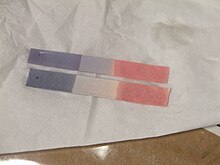
Semua asam dan basa mempunyai sifat sifat tertentu, tidak semua asam mempunyai sifat yang sama demikian juga pada basa. Kita juga sudah mengenal bahwa asam terbagi menjadi dua yaitu asam lemah dan asam kuat, demikian juga basa, ada basa kuat dan basa lemah. Kekuatan asam atau basa tergantung dari bagaimana suatu senyawa diuraikan dalam pembentukan ion-ion jika senyawa tersebut dalam air.
Warna kertas lakmus dalam larutan asam, larutan basa, dan larutan bersifat netral berbeda. Ada dua macam kertas lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing kertas lakmus tersebut sebagai berikut.
- Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru dan dalam larutan netral berwarna merah.
- Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru dan dalam larutan netral berwarna biru.
Kertas lakmus biru berubah warna menjadi merah di bawah kondisi asam dan kertas lakmus merah menjadi biru di bawah kondisi basa atau alkali, dengan perubahan warna yang terjadi di atas rentang pH 4.5–8.3 pada 25 °C (77 °F). Kertas lakmus pada keadaan netral berwarna ungu.[4]
Reaksi kimia selain asam-basa dapat pula menghasilkan perubahan warna pada kertas lakmus. Misalnya, gas klorin mengubah kertas lakmus biru menjadi putih,[5] karena kehadiran ion hipoklorit. Reaksi ini tidak bolak-balik, sehingga lakmus tidak berperan sebagai indikator dalam situasi tersebut.
Lihat pula
[sunting | sunting sumber]- Indikator asam-basa
- Indikator universal
- pH meter, alat yang dapat menentukan nilai pH asam-basa secara presisi
- Senyawa azo, senyawa yang berperan penting pada indikator metil jingga dan metil merah
Referensi
[sunting | sunting sumber]- ^ Beecken, H.; E-M. Gottschalk; U. v Gizycki; H. Krämer; D. Maassen; H-G. Matthies; H. Musso; C. Rathjen; Ul. Zdhorszky (2003). "Orcein and Litmus". Biotechnic & Histochemistry. 78 (6): 289–302. doi:10.1080/10520290410001671362.
- ^ H. Musso, C. Rathjen (1959). "Orcein dyes. X. Light absorption and chromophore of litmus". Chem. Ber. 92 (3): 751–3. doi:10.1002/cber.19590920331.
- ^ E.T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht 1846, Verlag E. Anton (Germany)
- ^ Manfred Neupert: Lackmus dalam Römpp Lexikon Chemie (Bahasa Jerman), 31 Januari 2013.
- ^ UCC - Chlorine
Pranala luar
[sunting | sunting sumber]
