Resonansi (kimia): Perbedaan antara revisi
←Membuat halaman berisi '=== Pengertian Resonansi === Struktur resonansi adalah ''salah satu dari dua atau lebih struktur Leweis untuk satu molekul yang tidak dapat dinyatakan secara tepat d...' |
Add 1 book for Wikipedia:Pemastian (20231010)) #IABot (v2.0.9.5) (GreenC bot |
||
| (11 revisi perantara oleh 8 pengguna tidak ditampilkan) | |||
| Baris 1: | Baris 1: | ||
{{Other uses2|Resonansi}} |
|||
[[Berkas:Nitric-acid-resonance-B.png|jmpl|300px|Dua struktur yang berkontribusi pada [[asam nitrat]]]] |
|||
Struktur resonansi adalah ''salah |
|||
satu dari dua atau lebih struktur Leweis untuk satu molekul yang tidak |
|||
dapat dinyatakan secara tepat dengan hanya menggunakan satu struktur |
|||
Lewis''. Tanda panah dua arah menyatakan bahwa struktur-struktur yang diberikan merupakan struktur resonansi.<ref name=":0">Chang, R. 2004. Kimia Dasar: Konsep-konsep Inti Jilid 1 / Edisi Ketiga. Jakarta: Penerbit Erlangga. Hal. 274</ref> |
|||
Dalam [[kimia]], '''resonansi''' atau '''mesomerisme'''<ref name="mesomerism">{{GoldBookRef|title=Mesomerism|file=M03845}}</ref> merupakan penggunaan dua atau lebih [[struktur Lewis]] untuk menggambarkan molekul tertentu. Struktur resonansi adalah salah satu dari dua atau lebih struktur Lewis untuk satu molekul yang tidak dapat dinyatakan secara tepat dengan hanya menggunakan satu struktur |
|||
Lewis. Tanda panah dua arah menyatakan bahwa struktur-struktur yang diberikan merupakan struktur resonansi.<ref name=":0">Chang, R. 2004. Kimia Dasar: Konsep-konsep Inti Jilid 1 / Edisi Ketiga. Jakarta: Penerbit Erlangga. Hal. 274</ref> |
|||
seorang Eropa pada abad pertengahan yang melakukan perjalanan ke |
|||
Afrika, yang menjelaskan bahwa badak adalah hasil persilangan antara ''griffin ''dan ''unicorn,'' |
|||
<nowiki> </nowiki>dua binatang yang terkenal tetapi hanya khayalan, kita menggambarkan |
|||
ozon yang merupakan molekul nyata, dalam dua struktur yang terkenal |
|||
tetapi tidak nyata.<ref name=":0" /> |
|||
Masing-masing struktur resonan dapat melambangkan struktur Lewis, dengan hanya satu [[ikatan kovalen]] antara masing-masing pasangan atom. Beberapa struktur Lewis digunakan bersama-sama untuk menjelaskan struktur [[molekul]]. Namun struktur tersebut tidak tetap, melainkan ada sebuah [[osilasi]] antara [[ikatan pi|ikatan rangkap]] dengan [[elektron]], saling berbolak-balik. Maka dari itu disebut dengan resonansi. Struktur yang sebenarnya mungkin saja adalah peralihan dari dua struktur resonan. Bentuk peralihan (intermediet) dari struktur resonan disebut dengan hibrida resonan.<ref name=":1">Ilmu Kimia. http://www.ilmukimia.org/2013/05/resonansi.html</ref> |
|||
Masing-masing |
|||
struktur resonan dapat melambangkan struktur Lewis, dengan hanya satu |
|||
ikatan kovalen antara masing-masing pasangan atom. Beberapa struktur |
|||
Lewis digunakan bersama-sama untuk menjelaskan struktur molekul. Namun |
|||
struktur tersebut tidak tetap, melainkan ada sebuah osilasi antara |
|||
ikatan rangkap dengan elektron, saling berbolak-balik. Maka dari itu |
|||
disebut dengan resonansi. Struktur yang sebenarnya mungkin saja adalah |
|||
peralihan dari dua struktur resonan. Bentuk peralihan (intermediet) dari |
|||
<nowiki> </nowiki>struktur resonan disebut dengan hibrida resonan.<ref name=":1">Ilmu Kimia. http://www.ilmukimia.org/2013/05/resonansi.html</ref> |
|||
== Sifat == |
|||
Molekul atau ion yang dapat beresonansi mempunyai sifat-sifat berikut: |
Molekul atau ion yang dapat beresonansi mempunyai sifat-sifat berikut: |
||
[[Berkas:Iminium Mesomerie-Seite001.svg|jmpl|300px|Struktur yang berkontribusi dalam ion iminium]] |
|||
# Dapat dituliskan dalam beberapa struktur Lewis yang disebut dengan |
|||
struktur resonan. Tetapi tidak satupun struktur tersebut melambangkan |
|||
bentuk asli molekul yang bersangkutan. |
# Dapat dituliskan dalam beberapa struktur Lewis yang disebut dengan struktur resonan. Tetapi tidak satupun struktur tersebut melambangkan bentuk asli molekul yang bersangkutan. |
||
# |
# Di antara struktur yang saling beresonansi bukanlah [[isomer]]. |
||
# Masing-masing struktur struktur Lewis harus mempunyai jumlah elektron valensi dan elektron tak berpasangan yang sama. |
# Masing-masing struktur struktur Lewis harus mempunyai jumlah elektron valensi dan elektron tak berpasangan yang sama.<ref>{{citation|first=Linus|last=Pauling|url=http://osulibrary.oregonstate.edu/specialcollections/coll/pauling/bond/notes/1946a.3-ts-13-large.html|title=Resonance|type=Manuscript for publication in Encyclopædia Britannica|page=13|date=July 29, 1946}}</ref> |
||
# Ikatan yang mempunyai orde ikatan yang berbeda pada masing-masing struktur tidak mempunyai panjang ikatan yang khas. |
# Ikatan yang mempunyai [[orde ikatan]] yang berbeda pada masing-masing struktur tidak mempunyai panjang ikatan yang khas. |
||
# Struktur yang sebenarnya mempunyai energi yang lebih rendah dibandingkan energi masing-masing struktur resonan.<ref name=":1" /> |
# Struktur yang sebenarnya mempunyai energi yang lebih rendah dibandingkan energi masing-masing struktur resonan.<ref name=":1" /> |
||
== Struktur resonansi == |
|||
Posisi [[elektron]] dapat diubah-ubah untuk menghasilkan struktur resonansi yang lain, tanpa mengubah posisi atom-atomnya. Dengan kata lain, atom-atom yang saling [[ikatan kimia|berikatan]] harus tetap dalam semua struktur resonansi untuk satu spesi tertentu. Akhirnya, perhatikan bahwa walaupun suatu [[ion]] atau [[senyawa]] dapat digambarkan secara lebih akurat dengan menyertakan dengan menyertakan semua struktur resonansinya, tetapi supaya sederhana biasanya hanya satu struktur Lewis saja yang dipergunakan.<ref name=":0" /> |
|||
Posisi elektron |
|||
dapat diubah-ubah untuk menghasilkan struktur resonansi yang lain, tanpa |
|||
== Panjang ikatan == |
|||
<nowiki> </nowiki>mengubah posisi atom-atomnya. Dengan kata lain, atom-atom yang saling |
|||
[[Berkas:Benzene delocalization2.svg|jmpl|480px|ka|Struktur resonansi [[benzena]]]] |
|||
berikatan harus tetap dalam semua struktur resonansi untuk satu spesi |
|||
tertentu. Akhirnya, perhatikan bahwa walaupun suatu ion atau senyawa |
|||
Membandingkan dua struktur yang memberikan kontribusi pada [[benzena]], seluruh ikatan tunggal dan rangkap dua saling dipertukarkan. [[Panjang ikatan]] dapat diukur, misalnya menggunakan [[difraksi sinar-X]]. Rata-rata panjang dari suatu ikatan tunggal C–C adalah 154 [[pikometer|pm]]; ikatan rangkap dua C=C adalah 133 pm. Dalam sikloheksatriena terlokalisasi, ikatan karbon–karbon seharusnya berada pada panjang 154 dan 133 pm. Namun, seluruh ikatan karbon–karbon dalam benzena ditemukan sekitar 139 pm, suatu panjang ikatan intermediet antara ikatan tunggal dan rangkap dua. Karakter campuran pada ikatan tunggal dan rangkap dua (atau ikatan rangkap tiga) adalah khas untuk semua molekul di mana ikatan memiliki orde ikatan yang berbeda dalam struktur berkontribusi yang berbeda. panjang ikatan dapat dibandingkan menggunakan orde ikatan. Misalnya, dalam sikloheksana orde ikatannya adalah 1 sedangkan dalam benzena adalah 1 + (3 ÷ 6) = {{frac|1|1|2}}. Akibatnya, benzena memiliki lebih banyak karakter ikatan rangkap dan karenanya memiliki panjang ikatan lebih pendek dari sikloheksana. |
|||
dapat digambarkan secara lebih akurat dengan menyertakan dengan |
|||
{{clear}} |
|||
menyertakan semua struktur resonansinya, tetapi supaya sederhana |
|||
biasanya hanya satu struktur Lewis saja yang dipergunakan.<ref name=":0" /> |
|||
== Delokalisasi muatan == |
|||
[[Berkas:Carboxylate-resonance-2D-skeletal.png|jmpl|400px|Struktur yang berkontribusi dalam gugus karboksilat]] |
|||
Dalam kasus ion adalah hal biasa untuk berbicara mengenai muatan terdelokalisasi (delokalisasi muatan). Contoh muatan terdelokalisasi dalam ion dapat ditemukan pada gugus [[asam alkanoat|karboksilat]], dimana muatan negatif berpusat merata pada dua atom oksigen. Delokalisasi muatan dalam anion merupakan faktor penting yang menentukan reaktivitasnya (umumnya: semakin tinggi tingkat delokalisasi, semakin rendah reaktivitasnya) dan, khususnya, kekuatan asam pada asam konjugat mereka. Sebagai aturan umum, semakin baik muatan terdelokalisasi dalam anion, semakin kuat [[asam]] konjugasinya. Misalnya, muatan negatif dalam anion [[perklorat]] ({{chem|ClO|4|−}}) didistribusikan secara merata di antara atom oksigen yang berorientasi simetris (dan sebagian darinya juga disimpan oleh atom klor pusat). Delokalisasi muatan yang sangat baik ini dikombinasikan dengan tingginya jumlah atom oksigen (empat) dan tingginya [[elektronegativitas]] pada atom klor pusat yang menyebabkan [[asam perklorat]] menjadi salah satu asam terkuat yang diketahui dengan nilai p''K''<sub>a</sub> sebesar −10.<ref name="CRC Press">{{cite book |
|||
| title = Perchlorate: Environmental problems and solutions |
|||
| url = https://archive.org/details/perchlorateenvir0000unse |
|||
| first1 = Kathleen |last1=Sellers |
|||
| first2 = Katherine |last2=Weeks |
|||
| first3 = William R. |last3=Alsop |
|||
| first4 = Stephen R. |last4=Clough |
|||
| first5 = Marilyn |last5=Hoyt |
|||
| first6 = Barbara |last6=Pugh |
|||
| publisher = CRC Press |
|||
| year = 2006 |
|||
| isbn = 0-8493-8081-2 |
|||
| page = [https://archive.org/details/perchlorateenvir0000unse/page/16 16] |
|||
}}</ref> |
|||
Besarnya delokalisasi muatan dalam anion dapat secara kuantitatif dinyatakan melalui parameter WAPS (rata-rata sigma positif tertimbang)<ref name="Kaupmees">{{cite journal |author1=Kaupmees|first1= K. |author2=Kaljurand|first2= I. |author3=Leito|first3= I. | title = Influence of Water Content on the Acidities in Acetonitrile. Quantifying Charge Delocalization in Anions | journal = J. Phys. Chem. A | year = 2010 | volume = 114 | pages = 11788–11793 | doi = 10.1021/jp105670t }}</ref> dan parameter analog WANS (rata-rata sigma negatif tertimbang)<ref name="Kaupmees_JSC">{{cite journal |author1=Kaupmees |first1=K. |author2=Kaljurand|first2= I. |author3=Leito|first3= I. | title = Influence of Water Content on Basicities in Acetonitrile | journal = J. Sol. Chem. | year = 2014 | volume = 43 | pages = 1270–1281 | doi = 10.1007/s10953-014-0201-4 }}</ref><ref name="Kaupmees_CCA">{{cite journal |author1=Kaupmees|first1= K. |author2=Trummal, |first2=A. |author3=Leito|first3= I. | title = Basicities of Strong Bases in Water: A Computational Study | journal = Croat. Chem. Acta | year = 2014 | volume = 87 | pages = 385–395 | doi = 10.5562/cca2472 }}</ref> yang digunakan pada kation. |
|||
{| border="1" class="wikitable" |
|||
|+ Nilai WAPS pada anion dalam asam yang umum dan nilai WANS untuk kation basa yang umum |
|||
|- |
|||
!Senyawa |
|||
!WAPS × 10<sup>5</sup> |
|||
!Senyawa |
|||
!WANS × 10<sup>5</sup> |
|||
|- |
|||
|(C<sub>2</sub>F<sub>5</sub>SO<sub>2</sub>)<sub>2</sub>NH |
|||
|2.0<ref name="Raamat">{{cite journal |author1=Raamat |first1=E. |author2=Kaupmees |first2=K. |author3=Ovsjannikov |first3=G. |author4=Trummal |first4=A. |author5=Kütt |first5=A. |author6=Saame |first6=J. |author7=Koppel |first7=I. |author8=Kaljurand |first8=I. |author9=Lipping |first9=L. |author10=Rodima |first10=T. |author11=Pihl |first11=V. |author12=Koppel |first12=I. A. |author13=Leito |first13=I. | title = Acidities of strong neutral Brønsted acids in different media | journal = J. Phys. Org. Chem. | year = 2013 | volume = 26 | pages = 162–170 | doi = 10.1002/poc.2946 }}</ref> |
|||
|[[Trifenilfosfin]] |
|||
|2.1<ref name="Kaupmees_JSC"/> |
|||
|- |
|||
|(CF<sub>3</sub>)<sub>3</sub>COH |
|||
|3.6<ref name="Raamat"/> |
|||
|Fenil tetrametilguanidin |
|||
|2.5<ref name="Kaupmees_JSC"/> |
|||
|- |
|||
|[[Asam pikrat]] |
|||
|4.3<ref name="Kaupmees"/> |
|||
|Tripropilamina |
|||
|2.6<ref name="Kaupmees_JSC"/> |
|||
|- |
|||
|[[2,4-Dinitrofenol]] |
|||
|4.9<ref name="Kaupmees"/> |
|||
|MTBD (7-Metil-triazabisiklodekena) |
|||
|2.9<ref name="Kaupmees_CCA"/> |
|||
|- |
|||
|[[Asam benzoat]] |
|||
|7.1<ref name="Kaupmees"/> |
|||
|DBU (1,8-Diazabisikloundek-7-ena) |
|||
|3.0<ref name="Kaupmees_CCA"/> |
|||
|- |
|||
|[[Fenol]] |
|||
|8.8<ref name="Raamat"/> |
|||
|TBD (Triazabisiklodekena) |
|||
|3.5<ref name="Kaupmees_CCA"/> |
|||
|- |
|||
|[[Asam asetat]] |
|||
|16.1<ref name="Kaupmees"/> |
|||
|''N'',''N''-Dimetilanilina |
|||
|4.7<ref name="Kaupmees_JSC"/> |
|||
|- |
|||
|[[Asam iodida|HI]] |
|||
|21.9<ref name="Raamat"/> |
|||
|[[Piridina]] |
|||
|7.2<ref name="Kaupmees_JSC"/> |
|||
|- |
|||
|[[Asam bromida|HBr]] |
|||
|29.1<ref name="Raamat"/> |
|||
|[[Anilina]] |
|||
|8.2<ref name="Kaupmees_JSC"/> |
|||
|- |
|||
|[[Asam klorida|HCl]] |
|||
|35.9<ref name="Kaupmees"/> |
|||
|Propilamina |
|||
|8.9<ref name="Kaupmees_JSC"/> |
|||
|} |
|||
Nilai WAPS dan WANS dinyatakan dalam [[muatan listrik partikel|e]]/[[Ångström|Å]]<sup>4</sup>. Nilai yang lebih besar mengindikasikan muatan lebih terlokalisasi dalam ion tersebut. |
|||
== Lihat pula == |
|||
{{Commons category|Mesomerism|Mesomerisme}} |
|||
* [[Aromatisitas]] |
|||
* [[Sistem konjugasi]] |
|||
* [[Pengikatan balik π]] |
|||
* [[Hiperkonjugasi]] |
|||
* [[Gaya van der Waals]] |
|||
== Referensi == |
|||
{{Reflist|30em}} |
|||
== Pranala luar == |
|||
* {{cite web |
|||
| url = http://www.hulis.free.fr |
|||
| title = HuLiS : Java Applet − Simple Hückel Theory and Mesomery − program logiciel software |
|||
|first1=N. |last1=Goudard |first2=Y. |last2=Carissan |first3=D. |last3=Hagebaum-Reignier |first4=S. |last4=Humbel | year = 2008 |
|||
| accessdate = 29 Oktober 2010 |
|||
|language=fr}} |
|||
* [http://www.ilmukimia.org/2013/05/resonansi.html Resonansi] dalam ''Ilmukimia.org'' |
|||
{{Ikatan kimia}} |
|||
{{Authority control}} |
|||
[[Kategori:Ikatan kimia]] |
|||
Revisi terkini sejak 12 Oktober 2023 11.54

Dalam kimia, resonansi atau mesomerisme[1] merupakan penggunaan dua atau lebih struktur Lewis untuk menggambarkan molekul tertentu. Struktur resonansi adalah salah satu dari dua atau lebih struktur Lewis untuk satu molekul yang tidak dapat dinyatakan secara tepat dengan hanya menggunakan satu struktur Lewis. Tanda panah dua arah menyatakan bahwa struktur-struktur yang diberikan merupakan struktur resonansi.[2]
Masing-masing struktur resonan dapat melambangkan struktur Lewis, dengan hanya satu ikatan kovalen antara masing-masing pasangan atom. Beberapa struktur Lewis digunakan bersama-sama untuk menjelaskan struktur molekul. Namun struktur tersebut tidak tetap, melainkan ada sebuah osilasi antara ikatan rangkap dengan elektron, saling berbolak-balik. Maka dari itu disebut dengan resonansi. Struktur yang sebenarnya mungkin saja adalah peralihan dari dua struktur resonan. Bentuk peralihan (intermediet) dari struktur resonan disebut dengan hibrida resonan.[3]
Sifat
[sunting | sunting sumber]Molekul atau ion yang dapat beresonansi mempunyai sifat-sifat berikut:

- Dapat dituliskan dalam beberapa struktur Lewis yang disebut dengan struktur resonan. Tetapi tidak satupun struktur tersebut melambangkan bentuk asli molekul yang bersangkutan.
- Di antara struktur yang saling beresonansi bukanlah isomer.
- Masing-masing struktur struktur Lewis harus mempunyai jumlah elektron valensi dan elektron tak berpasangan yang sama.[4]
- Ikatan yang mempunyai orde ikatan yang berbeda pada masing-masing struktur tidak mempunyai panjang ikatan yang khas.
- Struktur yang sebenarnya mempunyai energi yang lebih rendah dibandingkan energi masing-masing struktur resonan.[3]
Struktur resonansi
[sunting | sunting sumber]Posisi elektron dapat diubah-ubah untuk menghasilkan struktur resonansi yang lain, tanpa mengubah posisi atom-atomnya. Dengan kata lain, atom-atom yang saling berikatan harus tetap dalam semua struktur resonansi untuk satu spesi tertentu. Akhirnya, perhatikan bahwa walaupun suatu ion atau senyawa dapat digambarkan secara lebih akurat dengan menyertakan dengan menyertakan semua struktur resonansinya, tetapi supaya sederhana biasanya hanya satu struktur Lewis saja yang dipergunakan.[2]
Panjang ikatan
[sunting | sunting sumber]
Membandingkan dua struktur yang memberikan kontribusi pada benzena, seluruh ikatan tunggal dan rangkap dua saling dipertukarkan. Panjang ikatan dapat diukur, misalnya menggunakan difraksi sinar-X. Rata-rata panjang dari suatu ikatan tunggal C–C adalah 154 pm; ikatan rangkap dua C=C adalah 133 pm. Dalam sikloheksatriena terlokalisasi, ikatan karbon–karbon seharusnya berada pada panjang 154 dan 133 pm. Namun, seluruh ikatan karbon–karbon dalam benzena ditemukan sekitar 139 pm, suatu panjang ikatan intermediet antara ikatan tunggal dan rangkap dua. Karakter campuran pada ikatan tunggal dan rangkap dua (atau ikatan rangkap tiga) adalah khas untuk semua molekul di mana ikatan memiliki orde ikatan yang berbeda dalam struktur berkontribusi yang berbeda. panjang ikatan dapat dibandingkan menggunakan orde ikatan. Misalnya, dalam sikloheksana orde ikatannya adalah 1 sedangkan dalam benzena adalah 1 + (3 ÷ 6) = 1 ½. Akibatnya, benzena memiliki lebih banyak karakter ikatan rangkap dan karenanya memiliki panjang ikatan lebih pendek dari sikloheksana.
Delokalisasi muatan
[sunting | sunting sumber]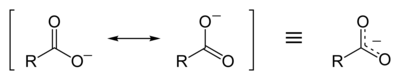
Dalam kasus ion adalah hal biasa untuk berbicara mengenai muatan terdelokalisasi (delokalisasi muatan). Contoh muatan terdelokalisasi dalam ion dapat ditemukan pada gugus karboksilat, dimana muatan negatif berpusat merata pada dua atom oksigen. Delokalisasi muatan dalam anion merupakan faktor penting yang menentukan reaktivitasnya (umumnya: semakin tinggi tingkat delokalisasi, semakin rendah reaktivitasnya) dan, khususnya, kekuatan asam pada asam konjugat mereka. Sebagai aturan umum, semakin baik muatan terdelokalisasi dalam anion, semakin kuat asam konjugasinya. Misalnya, muatan negatif dalam anion perklorat (ClO−4) didistribusikan secara merata di antara atom oksigen yang berorientasi simetris (dan sebagian darinya juga disimpan oleh atom klor pusat). Delokalisasi muatan yang sangat baik ini dikombinasikan dengan tingginya jumlah atom oksigen (empat) dan tingginya elektronegativitas pada atom klor pusat yang menyebabkan asam perklorat menjadi salah satu asam terkuat yang diketahui dengan nilai pKa sebesar −10.[5] Besarnya delokalisasi muatan dalam anion dapat secara kuantitatif dinyatakan melalui parameter WAPS (rata-rata sigma positif tertimbang)[6] dan parameter analog WANS (rata-rata sigma negatif tertimbang)[7][8] yang digunakan pada kation.
| Senyawa | WAPS × 105 | Senyawa | WANS × 105 |
|---|---|---|---|
| (C2F5SO2)2NH | 2.0[9] | Trifenilfosfin | 2.1[7] |
| (CF3)3COH | 3.6[9] | Fenil tetrametilguanidin | 2.5[7] |
| Asam pikrat | 4.3[6] | Tripropilamina | 2.6[7] |
| 2,4-Dinitrofenol | 4.9[6] | MTBD (7-Metil-triazabisiklodekena) | 2.9[8] |
| Asam benzoat | 7.1[6] | DBU (1,8-Diazabisikloundek-7-ena) | 3.0[8] |
| Fenol | 8.8[9] | TBD (Triazabisiklodekena) | 3.5[8] |
| Asam asetat | 16.1[6] | N,N-Dimetilanilina | 4.7[7] |
| HI | 21.9[9] | Piridina | 7.2[7] |
| HBr | 29.1[9] | Anilina | 8.2[7] |
| HCl | 35.9[6] | Propilamina | 8.9[7] |
Nilai WAPS dan WANS dinyatakan dalam e/Å4. Nilai yang lebih besar mengindikasikan muatan lebih terlokalisasi dalam ion tersebut.
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "Mesomerism".
- ^ a b Chang, R. 2004. Kimia Dasar: Konsep-konsep Inti Jilid 1 / Edisi Ketiga. Jakarta: Penerbit Erlangga. Hal. 274
- ^ a b Ilmu Kimia. http://www.ilmukimia.org/2013/05/resonansi.html
- ^ Pauling, Linus (July 29, 1946), Resonance (Manuscript for publication in Encyclopædia Britannica), hlm. 13
- ^ Sellers, Kathleen; Weeks, Katherine; Alsop, William R.; Clough, Stephen R.; Hoyt, Marilyn; Pugh, Barbara (2006). Perchlorate: Environmental problems and solutions. CRC Press. hlm. 16. ISBN 0-8493-8081-2.
- ^ a b c d e f Kaupmees, K.; Kaljurand, I.; Leito, I. (2010). "Influence of Water Content on the Acidities in Acetonitrile. Quantifying Charge Delocalization in Anions". J. Phys. Chem. A. 114: 11788–11793. doi:10.1021/jp105670t.
- ^ a b c d e f g h Kaupmees, K.; Kaljurand, I.; Leito, I. (2014). "Influence of Water Content on Basicities in Acetonitrile". J. Sol. Chem. 43: 1270–1281. doi:10.1007/s10953-014-0201-4.
- ^ a b c d Kaupmees, K.; Trummal,, A.; Leito, I. (2014). "Basicities of Strong Bases in Water: A Computational Study". Croat. Chem. Acta. 87: 385–395. doi:10.5562/cca2472.
- ^ a b c d e Raamat, E.; Kaupmees, K.; Ovsjannikov, G.; Trummal, A.; Kütt, A.; Saame, J.; Koppel, I.; Kaljurand, I.; Lipping, L.; Rodima, T.; Pihl, V.; Koppel, I. A.; Leito, I. (2013). "Acidities of strong neutral Brønsted acids in different media". J. Phys. Org. Chem. 26: 162–170. doi:10.1002/poc.2946.
Pranala luar
[sunting | sunting sumber]- Goudard, N.; Carissan, Y.; Hagebaum-Reignier, D.; Humbel, S. (2008). "HuLiS : Java Applet − Simple Hückel Theory and Mesomery − program logiciel software" (dalam bahasa Prancis). Diakses tanggal 29 Oktober 2010.
- Resonansi dalam Ilmukimia.org
