Benzena
| |||
 Model ruang terisi
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Benzena[1] | |||
| Nama lain
Benzol (sejarah/Jerman)
Sikloheksa-1,3,5-triena; 1,3,5-Sikloheksatriena [6]Anulena (tidak dianjurkan[1]) | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C6H6 | |||
| Massa molar | 78,11 g·mol−1 | ||
| Penampilan | Cairan tak berwarna | ||
| Bau | Aromatik, seperti bensin | ||
| Densitas | 0,8765(20) g/cm3[2] | ||
| Titik lebur | 5,53 °C (41,95 °F; 278,68 K) | ||
| Titik didih | 80,1 °C (176,2 °F; 353,2 K) | ||
| 1,53 g/L (0 °C) 1,81 g/L (9 °C) 1.79 g/L (15 °C)[3][4][5] 1,84 g/L (30 °C) 2,26 g/L (61 °C) 3,94 g/L (100 °C) 21,7 g/kg (200 °C, 6,5 MPa) 17,8 g/kg (200 °C, 40 MPa)[6] | |||
| Kelarutan | Larut dalam alkohol, CHCl3, CCl4, dietil eter, aseton, asam asetat[6] | ||
| Kelarutan dalam etanadiol | 5,83 g/100 g (20 °C) 6,61 g/100 g (40 °C) 7,61 g/100 g (60 °C)[6] | ||
| Kelarutan dalam etanol | 20 °C, larutan dalam air: 1,2 mL/L (20% v/v)[7] | ||
| Kelarutan dalam aseton | 20 °C, larutan dalam air: 7,69 mL/L (38,46% v/v) 49,4 mL/L (62,5% v/v)[7] | ||
| Kelarutan dalam dietilen glikol | 52 g/100 g (20 °C)[6] | ||
| log P | 2,13 | ||
| Tekanan uap | 12,7 kPa (25 °C) 24,4 kPa (40 °C) 181 kPa (100 °C)[8] | ||
| Asam konjugat | Benzenium | ||
| λmaks | 255 nm | ||
| −54,8·10−6 cm3/mol | |||
| Indeks bias (nD) | 1,5011 (20 °C) 1,4948 (30 °C)[6] | ||
| Viskositas | 0,7528 cP (10 °C) 0,6076 cP (25 °C) 0,4965 cP (40 °C) 0,3075 cP (80 °C) | ||
| Struktur | |||
| Trigonal planar | |||
| 0 D | |||
| Termokimia | |||
| Kapasitas kalor (C) | 134,8 J/mol·K | ||
| Entropi molar standar (S |
173,26 J/mol·K[8] | ||
| Entalpi pembentukan standar (ΔfH |
48,7 kJ/mol | ||
| Entalpi pembakaran standar ΔcH |
3.267,6 kJ/mol[8] | ||
| Bahaya | |||
| Bahaya utama | berpotensi karsinogen, mudah terbakar | ||
| Lembar data keselamatan | HMDB | ||
| Piktogram GHS |      [9] [9]
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H225, H304, H315, H319, H340, H350, H372, H410[9] | |||
| P201, P210, P301+310, P305+351+338, P308+313, P331[9] | |||
| Titik nyala | −1.163 °C (−2.061 °F; −890 K) | ||
| 49.778 °C (89.632 °F; 50.051 K) | |||
| Ambang ledakan | 1.2–7.8% | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
930 mg/kg (tikus, oral) | ||
LCLo (terendah tercatat)
|
44,000 ppm (kelinci, 30 min) 44,923 ppm (anjing) 52,308 ppm (kucing) 20,000 ppm (manusia, 5 min)[11] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 1 ppm, ST 5 ppm[10] | ||
REL (yang direkomendasikan)
|
Ca TWA 0.1 ppm ST 1 ppm[10] | ||
IDLH (langsung berbahaya)
|
500 ppm[10] | ||
| Senyawa terkait | |||
Senyawa terkait
|
Toluena Borazina | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Benzena adalah suatu senyawa organik dengan rumus kimia C6H6. Molekul benzena tersusun atas enam atom karbon yang berikatan dalam suatu cincin, dengan satu atom hidrogen yang terikat pada masing-masing atom karbon. Oleh karena benzena hanya mengandung atom karbon dan hidrogen, benzena dikelompokkan sebagai hidrokarbon.
Benzena adalah kandungan alami minyak mentah dan salah satu petrokimia esensial. Oleh karena cincinnya memiliki ikatan pi kontinu antar atom karbon, benzena diklasifikasikan sebagai hidrokarbon aromatik, [n]-anulena ([6]-anulena). Benzena kadang-kadang disingkat sebagai PhH. Benzena adalah cairan tak berwarna, sangat mudah terbakar dan berbau harum. Keberadaannya memberi aroma khas di SPBU. Penggunaan utamanya adalah sebagai prekursor pabrikasi bahan kimia dengan struktur yang lebih kompleks, seperti etilbenzena dan kumena, yang setiap tahunnya diproduksi milyaran kilogram. Karena benzena memiliki bilangan oktan yang tinggi, bensin (bbm) mengandung turunan aromatiknya seperti xilena dan toluena hingga mencapai 25%. Benzena sendiri telah dibatasi hingga kurang dari 1% dalam bensin karena diketahui sebagai karsinogen pada manusia. Aplikasi non-industrialnya telah dibatasi dengan alasan yang sama.
Sejarah
[sunting | sunting sumber]Penemuan
[sunting | sunting sumber]Nama "benzena" diturunkan dari "gom benzoin" (resin benzoin), suatu resin aromatik yang dikenal oleh apoteker dan pengrajin parfum Eropa sejak abad ke-16 sebagai produk Asia tenggara.[12] Suatu bahan yang bersifat asam diturunkan dari benzoin melalui sublimasi, dan diberi nama "bunga benzoin", atau asam benzoat. Hidrokarbon yang diturunkan dari asam benzoat kemudian diberi nama benzin, benzol, atau benzena.[13] Michael Faraday pertama kali mengisolasi dan mengidentifikasi benzena pada 1825 dari residu minyak yang diturunkan dari produksi gas penerangan, dan diberi nama bikarburet hidrogen.[14][15] Pada tahun 1833, Eilhard Mitscherlich membuatnya melalui distilasi asam benzoat (dari gom benzoin) dan tawas. Ia memberi nama senyawa tersebut benzin.[16] Pada tahun 1836, kimiawan Perancis Auguste Laurent memberi nama senyawa tersebut "phène";[17] istilah ini menjadi akar dari istilah bahasa Inggris "fenol", yang merupakan benzena terhidroksilasi, dan "fenil", radikal yang terbentuk karena hilangnya satu atom hidrogen (radikal bebas H•) dari benzena.
Pada tahun 1845, Charles Mansfield, yang bekerja di bawah August Wilhelm von Hofmann, mengisolasi benzena dari tar batu bara.[18] Empat tahun kemudian, Mansfield memulai produksi benzena skala industri pertama, berdasarkan metode tar-batu bara.[19][20] Perlahan-lahan, muncul firasat di kalangan kimiawan bahwa sejumlah zat secara kimiawi terkait dengan benzena, yang terdiri dari beragam keluarga bahan kimia. Pada 1855, Hofmann menggunakan kata "aromatik" untuk menunjukkan hubungan keluarga ini, setelah banyak sifat karakteristik anggotanya.[21] Pada 1997, benzena terdeteksi di luar angkasa.[22]
Formula cincin
[sunting | sunting sumber]
Rumus empiris benzena telah lama diketahui, tetapi penentuan strukturnya merupakan tantangan tersendiri karena senyawa ini dipenuhi oleh ketakjenuhan ikatan kovalen, dan masing-masing atom karbon hanya mengikat satu atom hidrogen. Archibald Scott Couper pada 1858 dan Joseph Loschmidt pada 1861[29] menyarankan kemungkinan struktur yang mengandung banyak ikatan rangkap atau banyak cincin, tetapi bukti-buktinya yang tersedia terlalu sedikit untuk membantu kimiawan menentukan struktur tertentu.
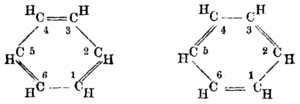
Pada tahun 1865, kimiawan Jerman Friedrich August Kekulé menerbitkan sebuah makalah dalam bahasa Prancis (karena saat itu ia mengajar di Francophone Belgia) yang menyarankan bahwa strukturnya mengandung cincin enam atom karbon dengan ikatan tunggal dan ganda berselang-seling. Tahun berikutnya ia menerbitkan makalah yang jauh lebih panjang dalam bahasa Jerman tentang hal yang sama.[30][31] Kekulé menggunakan bukti yang telah terkumpul pada tahun-tahun berikutnya — yaitu, bahwa selalu tampak hanya ada satu isomer dari monoderivatif benzena, dan bahwa selalu ada tiga isomer dari setiap turunan dwisubstitusinya—sekarang dipahami sesuai dengan pola orto, meta, dan para pada substitusi arena—sebagai argumentasi yang mendukung struktur usulannya.[32] Cincin simetris Kekulé dapat menjelaskan fakta-fakta unik ini, serta rasio karbon-hidrogen 1:1 pada benzena.
Pemahaman baru tentang benzena, dan juga semua senyawa aromatik, terbukti sangat penting untuk kimia murni dan terapan, sehingga pada tahun 1890 Perhimpunan Kimia Jerman mengorganisir apresiasi untuk menghormati Kekulé, merayakan peringatan dua puluh lima makalah benzena pertamanya. Di sini Kekulé berbicara tentang penciptaan teori. Dia mengatakan bahwa dia telah menemukan bentuk cincin molekul benzena setelah memiliki lamunan atau mimpi siang bolong tentang ular yang menangkap ekornya sendiri (ini adalah simbol umum dalam banyak budaya kuno yang dikenal sebagai Ouroboros atau simpul tanpa ujung).[33] Visi ini, katanya, datang kepadanya setelah bertahun-tahun mempelajari sifat ikatan karbon-karbon. Ini adalah 7 tahun setelah dia memecahkan masalah tentang bagaimana atom karbon dapat berikatan dengan hingga empat atom lainnya pada saat yang bersamaan. Anehnya, penggambaran benzena yang serupa dan lucu muncul pada tahun 1886 dalam sebuah pamflet berjudul Berichte der Durstigen Chemischen Gesellschaft (Jurnal Masyarakat Kimia Haus), suatu parodi dari Berichte der Deutschen Chemischen Gesellschaft (Jurnal Masyarakat Kimia Jerman), hanya parodi monyet yang saling berebut dalam lingkaran, bukannya ular seperti dalam anekdot Kekulé.[34] Beberapa sejarawan telah menyarankan bahwa parodi itu adalah kritik dari anekdot ular, mungkin sudah dikenal melalui kisah lisan bahkan sebelum muncul di media cetak.[13] Pidato Kekulé pada tahun 1890[35] yang memunculkan anekdot ini telah diterjemahkan ke dalam bahasa Inggris.[36] Jika anekdot adalah ingatan dari peristiwa nyata, keadaan yang disebutkan dalam cerita menunjukkan bahwa itu pasti terjadi pada awal 1862.[37]
Sifat siklik benzena akhirnya dikonfirmasi oleh ahli kristalografi Kathleen Lonsdale pada tahun 1929.[38][39]
Tata nama
[sunting | sunting sumber]Kimiawan Jerman Wilhelm Körner menyarankan awalan orto-, meta-, para- untuk membedakan turunan benzena yang terdwisubstitusi pada tahun 1867; namun, ia tidak menggunakan awalan tersebut untuk membedakan posisi relatif substituen pada cincin benzena.[40] Karl Gräbe, kimiawan Jerman, pada tahun 1869, adalah yang pertama kali menggunakan awalan orto-, meta-, para- untuk menunjukkan lokasi relatif spesifik substituen pada cincin aromatik terdwisubstitusi (yaitu, naftalena).[41] Pada tahun 1870, kimiawan Jerman Viktor Meyer yang pertama kali menerapkan tata nama Gräbe untuk benzena.[42]
Aplikasi awal
[sunting | sunting sumber]Pada abad ke-19 dan awal abad ke-20, benzena digunakan sebagai losion setelah bercukur karena baunya yang sedap. Sebelum 1920-an, benzena sering digunakan sebagai pelarut industri, terutama untuk pengawagemokkan logam. Ketika toksisitasnya semakin jelas, benzena digantikan oleh pelarut lain, terutama toluena (metilbenzena), yang memiliki sifat fisik yang mirip tetapi tidak bersifat karsinogenik.
Pada tahun 1903, Ludwig Roselius mempopulerkan penggunaan benzena untuk mendekafeinasi kopi. Penemuan ini memicu produksi Sanka. Proses ini kemudian dihentikan. Benzena secara historis digunakan sebagai komponen penting dalam banyak produk konsumen seperti Liquid Wrench, beberapa pengelupas cat, semen karet, penghilang noda, dan produk lainnya. Pembuatan beberapa formulasi yang mengandung benzena berakhir pada sekitar tahun 1950, meskipun Liquid Wrench terus mengandung benzena dalam jumlah besar hingga akhir tahun 1970-an.[43]
Keterjadian
[sunting | sunting sumber]Benzena ditemukan dalam minyak bumi dan batubara dalam jumlah renik. Ini adalah produk sampingan dari pembakaran tak sempurna sebagian besar material. Untuk penggunaan komersial, sampai Perang Dunia II, sebagian besar benzena diperoleh sebagai produk sampingan dari produksi kokas untuk industri baja. Namun, pada 1950-an, saat terjadi peningkatan permintaan benzena, terutama dari industri polimer yang bertumbuh, mengharuskan produksi benzena dari minyak bumi. Saat ini, sebagian besar benzena berasal dari industri petrokimia, dengan hanya sebagian kecil yang dihasilkan dari batubara.[44]
Struktur
[sunting | sunting sumber]
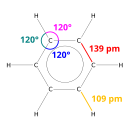
Difraksi sinar-X menunjukkan bahwa keenam ikatan karbon-karbon dalam benzena memiliki panjang yang sama, yaitu 140 (pm).[45] Panjang ikatan C–C (pada benzena) lebih panjang daripada ikatan rangkapnya (135 pm) tetapi lebih pendek daripada ikatan tunggal (147 pm). Jarak antara ini konsisten dengan delokalisasi elektron: elektron untuk ikatan C–C didistribusikan secara merata di antara masing-masing enam atom karbon. Benzena memiliki 6 atom hidrogen – lebih sedikit daripada alkana induknya, heksana. Molekul benzena berbentuk planar.[46] Deskripsi orbital molekul melibatkan pembentukan tiga orbital π terdelokalisasi yang mencakup semua enam atom karbon, sedangkan deskripsi ikatan valensi melibatkan superposisi struktur resonansi.[47][48][49][50] Sangat mungkin bahwa kestabilan ini berkontribusi pada sifat-sifat molekul dan kimia khusus yang dikenal sebagai aromatisitas. Untuk mencerminkan sifat ikatan secara akurat, benzena sering digambarkan dengan lingkaran di dalam susunan atom karbon heksagonal.
Turunan benzena cukup sering terjadi sebagai komponen molekul organik yang telah dialokasikan oleh Unicode Consortium sebagai simbol di blok Miscellaneous Technical dengan kode U+232C (⌬) untuk mewakili yang memiliki tiga ikatan rangkap,[51] dan U+23E3 (⏣) untuk versi yang terdelokalisasi.[52]
Turunan benzena
[sunting | sunting sumber]Banyak bahan kimia penting yang diturunkan dari benzena dengan mengganti satu atau lebih atom hidrogennya dengan gugus fungsi lainnya. Contoh turunan benzena sederhana adalah fenol, toluena, dan anilin, yang masing-masing disingkat PhOH, PhMe, dan PhNH2. Menghubungkan dua cincin benzena menghasilkan bifenil, C6H6–C6H6. Kehilangan hidrogen lebih lanjut menghasilkan fusi hidrokarbon aromatik, seperti naftalena, antracena, fenantrena, dan pirena. Batas proses fusi adalah alotrop karbon bebas hidrogen, grafit.
Dalam heterosiklis, atom karbon dalam cincin benzena diganti dengan unsur lain. Variasi yang paling penting mengandung nitrogen. Penggantian satu CH dengan N menghasilkan senyawa piridina, C5H5N. Meskipun benzena dan piridina secara struktural berhubungan, benzena tidak bisa diubah menjadi piridina. Penggantian ikatan CH kedua dengan N menghasilkan piridazina, pirimidina, atau pirazina, tergantung posisi N kedua.[53]
Produksi
[sunting | sunting sumber]Empat proses kimia yang digunakan untuk produksi benzena industri: pembentukan ulang berkatalis, hidrodealkilasi toluena, disproporsionasi toluena, dan perengkahan kukus. Menurut ATSDR Profil Toksikologi benzena, antara tahun 1978 dan 1981, porsi pembentukan ulang berkatalis adalah 44–50% dari total produksi benzena Amerika Serikat.[44]
Pembentukan ulang berkatalis (Catalytic reforming)
[sunting | sunting sumber]Dalam pembentukan ulang berkatalis, campuran hidrokarbon dengan titik didih antara 60–200 °C dicampur dengan gas hidrogen dan kemudian dipapar dengan katalis dwifungsi platinum klorida atau renium klorida pada suhu 500–525 °C dan tekanan pada rentang 8–50 atm. Di bawah kondisi ini, hidrokarbon alifatik membentuk cincin dan kehilangan hidrogennya membentuk hidrokarbon aromatik. Produk aromatik dari reaksi ini kemudian dipsiahkan dari campuran reaksinya (atau reformat) dengan cara ekstraksi menggunakan satu dari sejumlah pelarut, di antaranya dietilena glikol atau sulfolana, dan benzena kemudian dipisahkan dari aromatik lainnya melalui distilasi. Tahap ekstraksi aromatik dari reformat dirancang untuk menghasilkan aromatik dengan komponen non-aromatik paling rendah. Untuk mendapatkan aromatik tersebut, umumnya dirujuk sebagai BTX (benzena, toluena dan isomer xilena), melibatkan sejumlah tahapan ekstraksi dan distilasi. Terdapat banyak proses berlisensi yang tersedia untuk ekstraksi aromatik.
Dengan cara yang mirip pembentukan ulang berkatalis, UOP dan BP memperkenalkan metode dari LPG (terutama propana dan butana) untuk membuat aromatik.
Hidrodealkilasi toluena
[sunting | sunting sumber]Hidrodealkilasi toluena mengubah toluena menjadi benzena. Dalam proses intensif hidrogen ini, toluena dicampur dengan hidrogen, kemudian dilewatkan melalui katalis kromium, molibdenum, atau platinum oksida pada suhu 500–600 °C dan tekanan 40–60 atm. Kadang-kadang, digunakan suhu yang lebih tinggi dan bukannya katalis (pada kondisi reaksi yang sama). Pada kondisi ini, toluena mengalami dealkilasi menjadi benzena dan metana:
Reaksi ireversibel ini disertai oleh reaksi samping kesetimbangan yang menghasilkan bifenil (alias difenil) pada suhu yang lebih tinggi:
Jika aliran bahan baku mengandung banyak komponen non aromatik (parafin atau naftena), mereka akan terdekomposisi menjadi hidrokarbon yang lebih sederhana seperti metana, yang meningkatkan konsumsi hidrogen.
Hasil reaksi ini melebihi 95%. Kadang-kadang, xilena dan aromatik yang lebih berat digunakan sebagai pengganti toluena, dengan efisiensi yang sama.
Ini sering disebut metodologi "on-purpose" untuk menghasilkan benzena, dibandingkan dengan proses ekstraksi BTX (benzena-toluena-xilena) konvensional.
Disproporsionasi toluena
[sunting | sunting sumber]Jika kompleks kimia memiliki permintaan yang sama untuk benzena dan xilena, maka disproporsionasi toluena (toluene disproportionation, TDP) dapat menjadi alternatif yang menarik untuk hidrodealkilasi toluena. Dalam arti luas, dua molekul toluena direaksikan dan gugus metil ditata ulang dari satu molekul toluena ke molekul lainnya, menghasilkan satu molekul benzena dan satu molekul xilena.
Mengingat bahwa permintaan untuk para-xilena (p-xilena) secara substansial melebihi permintaan untuk isomer xilena lainnya, dapat digunakan penyempurnaan proses TDP yang disebut TDP Selektif (Selective TDP, STDP). Dalam proses ini, aliran xilena yang keluar dari unit TDP adalah sekitar 90% p-xilena. Dalam beberapa sistem katalitik saat ini, bahkan rasio benzena terhadap xilena berkurang (lebih banyak xilena) ketika permintaan xilena lebih tinggi.
Perengkahan kukus
[sunting | sunting sumber]Perengkahan kukus adalah proses pembuatan etilena dan alkena lainnya dari hidrokarbon alifatik. Bergantung pada bahan baku yang digunakan untuk memproduksi olefin, perengkahan kukus dapat menghasilkan cairan yang kaya akan benzena yang disebut bensin pirolisis. Bensin pirolisis dapat dicampur dengan hidrokarbon lain sebagai aditif bensin, atau dialihkan melalui proses ekstraksi untuk memulihkan aromatik BTX (benzena, toluena, dan xilena).
Metode lain
[sunting | sunting sumber]Meskipun tidak memiliki arti komersial, banyak cara lain membuat benzene. Fenol dan halobenzena dapat direduksi dengan logam. Asam benzoat dan garamnya mengalami dekarboksilasi menjadi benzena. Melalui reaksi senyawa diazonium dengan asam hipofosfit, anilina menghasilkan benzena. Trimerisasi asetilena menghasilkan benzena.
Penggunaan
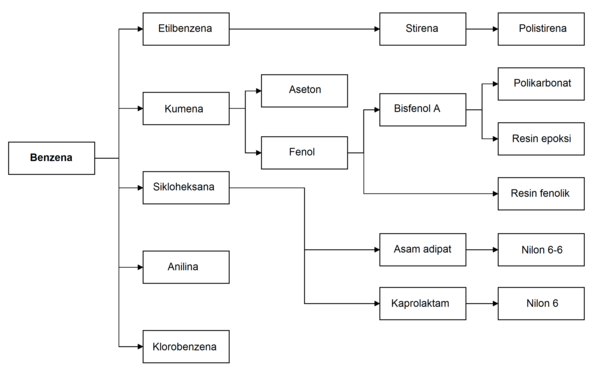
[sunting | sunting sumber]Penggunaan utama benzena adalah sebagai intermediat untuk membuat bahan kimia lain, utamanya etilbenzena, kumena, sikloheksana, nitrobenzena, dan alkilbenzena. Lebih dari setengah dari produksi benzena diolah menjadi etilbenzena, prekursor untuk stirena, yang digunakan untuk membuat polimer dan plastik seperti polistirena dan EPS. Beberapa 20% produksi benzena digunakan untuk membuat kumena, yang diperlukan pada produksi fenol dan aseton untuk resin dan lem. Sikloheksana memakan sekitar 10% dari produksi benzena dunia; terutama digunakan dalam pabrikasi serat nilon, yang diproses menjadi tekstil dan plastik teknik. Sejumlah kecil benzena digunakan untuk membuat beberapa jenis karet, pelumas, pewarna, detergen, obat, bahan peledak, dan pestisida. Pada tahun 2013, negara konsumen benzena terbesar adalah Tiongkok, diikuti oleh Amerika Serikat. Produksi benzena saat ini berkembang di Timur Tengah dan Afrika, sementara kapasitas produksi di Eropa Barat dan Amerika Utara adalah stagnan.[54]
Toluena saat ini sering digunakan sebagai pengganti benzena, misalnya sebagai aditif bahan bakar. Sifat melarutkan keduanya mirip, tetapi toluena kurang beracun dan memiliki rentang fase cair yang lebih lebar. Toluena juga diproses menjadi benzena.[55]
Komponen bensin
[sunting | sunting sumber]Sebagai aditif bensin, benzena meningkatkan bilangan oktan dan mengurangi nglitik pada mesin. Sebagai konsekuensinya, bensin sering mengandung beberapa persen benzena sebelum tahun 1950an, ketika tetra etil timbal menggantikannya sebagai aditif anti nglitik. Seiring dihapuskannya bensin bertimbal, benzena kembali digunakan sebagai aditif bensin di beberapa negara. Di Amerika Serikat, kekhawatiran akan dampak negatifnya terhadap kesehatan dan kemungkinan benzena memasuki air tanah telah menyebabkan regulasi yang ketat terhadap kandungan benzena, dengan batasan sekitar 1%.[56] Spesifikasi bensin Eropa sekarang mengandung batas yang sama 1% benzena. Badan Perlindungan Lingkungan Amerika Serikat memperkenalkan peraturan baru pada 2011 yang menurunkan kandungan benzena dalam bensin menjadi 0,62%.[57] Dalam banyak bahasa Eropa, kata untuk minyak atau bensin adalah kata yang persis sama dengan "benzena".
Reaksi
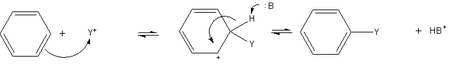
[sunting | sunting sumber]Reaksi benzena yang paling umum melibatkan substitusi proton oleh gugus lain.[58] Substitusi aromatik elektrofilik adalah metode umum membuat turunan benzena. Benzena cukup nukleofilik sehingga mengalami substitusi oleh ion asilium dan karbokation alkil untuk menghasilkan turunan tersubstitusi.
Contoh reaksi ini yang paling banyak dipraktikkan adalah etilasi benzena.
Sekitar 24.700.000 ton diproduksi pada tahun 1999.[59] Sangat instruktif tetapi secara industri tidak signifikan adalah alkilasi Friedel-Crafts benzena (dan banyak cincin aromatik lainnya) menggunakan alkil halida dengan adanya katalis asam kuat Lewis. Demikian pula, asilasi Friedel-Crafts adalah contoh terkait substitusi aromatik elektrofilik. Reaksinya melibatkan asilasi benzena (atau banyak cincin aromatik lainnya) dengan asil klorida menggunakan katalis asam Lewis kuat seperti aluminium klorida atau besi(III) klorida.
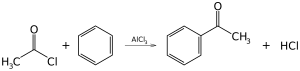
Sulfonasi, klorinasi, nitrasi
[sunting | sunting sumber]Banyak gugus fungsional yang bisa dimasukkan ke dalan kerangka benzena menggunakan substitusi aromatik elektrofilik. Sulfonasi benzena melibatkan penggunaan oleum, suatu campuran asam sulfat dengan belerang trioksida. Turunan benzena tersulfonasi merupakan detergen yang sangat berguna. Dalam nitrasi, benzena bereaksi dengan ion nitronium (NO+2), yang merupakan elektrofil kuat yang dihasilkan dari reaksi antara asam sulfat dan asam nitrat. Nitrobenzena adalah prekursor anilina. Klorinasi dicapai menggunakan klorin menghasilkan klorobenzena dengan adanya katalis seperti aluminium triklorida.
Hidrogenasi
[sunting | sunting sumber]Benzena dan turunannya diubah menjadi sikloheksana dan turunannya melalui hidrogenasi. Reaksi ini dicapai menggunakan hidrogen bertekanan tinggi dengan adanya katalis heterogen, seperti serbuk nikel. Sementara alkena dapat dihidrogenasi di sekitar suhu ruang, benzena dan senyawa terkaitnya adalah substrat yang lebih susah, memerlukan suhu >100 °C. Reaksi ini dilakukan pada skala industri besar. Tanpa adanya katalis, benzena tidak bereaksi dengan hidrogen. Hidrogenasi tidak dapat dihentikan untuk menghasilkan sikloheksena atau sikloheksadiena, karena keduanya adalah substrat yang lebih unggul. Sebaliknya, reduksi Birch, suatu proses non katalitik, secara selektif dapat menghidrogenasi benzena menjadi diena.
Kompleks logam
[sunting | sunting sumber]Benzena adalah ligan yang sangat baik dalam kimia organologam untuk logam-logam bervalensi rendah. Contoh penting meliputi kompleks sandwich dan setengah-sandwich, seperti Cr(C6H6)2 dan [RuCl2(C6H6)]2.
Efek kesehatan
[sunting | sunting sumber]
Benzena diklasifikasikan sebagai karsinogen, yang meningkatkan risiko kanker dan penyakit lainnya, dan juga merupakan penyebab utama kegagalan sumsum tulang. Sejumlah besar data epidemiologis, klinis, dan laboratorium, menghubungkan benzena dengan anemia aplastik, leukemia akut, kelainan sumsum tulang, dan penyakit kardiovaskular.[60][61][62] Keganasan hematologis spesifik yang dikaitkan dengan benzena meliputi: leukemia myeloid akut (AML), anemia aplastik, sindrom mielodisplastik (MDS), leukemia limfoblastik akut (ALL), dan leukemia myeloid kronis (CML).[63]
American Petroleum Institute (API) menyatakan pada tahun 1948 bahwa "secara umum dianggap bahwa satu-satunya konsentrasi benzena yang benar-benar aman adalah nol".[64] Tidak ada tingkat paparan yang aman; bahkan jumlah kecil dapat menyebabkan kerusakan.[65] Kementerian Kesehatan dan Layanan Masyarakat AS (DHHS) mengklasifikasikan benzena sebagai karsinogen manusia. Paparan jangka panjang terhadap kadar benzena yang berlebihan di udara menyebabkan leukemia, kanker yang berpotensi fatal pada organ pembentuk darah. Secara khusus, leukemia mieloid akut atau leukemia nonlimfositik akut (AML & ANLL) tidak diragukan lagi merupakan akibat paparan benzena.[66] IARC memberi peringkat benzena sebagai "diketahui bersifat karsinogenik bagi manusia" (Grup 1).
Oleh karena benzena ada di mana-mana dalam bahan bakar bensin dan hidrokarbon yang digunakan di mana-mana, paparan manusia terhadap benzena adalah masalah kesehatan global. Benzena menyerang hati, ginjal, paru-paru, jantung dan otak dan dapat menyebabkan kerusakan untaian DNA, kerusakan kromosom, dll. Benzena menyebabkan kanker pada hewan termasuk manusia. Benzena telah terbukti menyebabkan kanker pada kedua jenis kelamin beberapa spesies hewan laboratorium yang terpapar melalui berbagai jalur.[67][68]
Paparan benzena
[sunting | sunting sumber]Menurut Agency for Toxic Substances and Disease Registry (ATSDR) (2007), benzena merupakan bahan kimia yang diproduksi secara antropogenik dan terbentuk secara alami dari proses yang meliputi: letusan gunung berapi, kebakaran liar, sintesis bahan kimia seperti fenol, produksi serat sintetis, dan pembuatan karet, pelumas, pestisida, obat-obatan, dan pewarna. Sumber utama paparan benzena adalah asap tembakau, stasiun servis mobil, knalpot kendaraan bermotor, dan emisi industri; namun, benzena juga dapat tertelan dan terserap melalui kulit karena kontak dengan air yang terkontaminasi. Benzena dimetabolisme oleh hati dan diekskresikan dalam urine. Pengukuran kadar benzena di udara dan air dilakukan melalui pengumpulan melalui tabung arang aktif, yang kemudian dianalisis dengan kromatografi gas. Pengukuran benzena pada manusia dapat dilakukan melalui tes urine, darah, dan napas; namun, semua ini memiliki keterbatasan karena benzena dimetabolisme dengan cepat dalam tubuh manusia.[69]
Paparan benzena secara progresif dapat menyebabkan anemia aplastik, leukemia, dan multiple myeloma.[70]
OSHA mengatur kadar benzena di tempat kerja.[71] Jumlah maksimum benzena yang diizinkan di udara ruang kerja selama 8 jam kerja, 40 jam seminggu adalah 1 ppm. Oleh karena benzena dapat menyebabkan kanker, NIOSH merekomendasikan bahwa semua pekerja memakai peralatan pernapasan khusus ketika mereka cenderung terpapar benzena pada tingkat yang melebihi batas pemaparan yang direkomendasikan (8 jam) sebesar 0,1 ppm.[72]
Batas paparan benzena
[sunting | sunting sumber]Badan Perlindungan Lingkungan Amerika Serikat (US EPA) menentukan tingkat kontaminasi maksimal (MCL) untuk benzena dalam air minum adalah 0,005 mg/L (5 ppb), sebagaimana diundangkan melalui Peraturan Air Minum Utama AS.[73] Peraturan ini didasarkan pada pencegahan leukemogenesis benzena. Tujuan tingkat kontaminan maksimum (MCLG), tujuan kesehatan yang tidak dapat ditegakkan yang akan memungkinkan margin keselamatan yang memadai untuk pencegahan efek samping, adalah konsentrasi nol benzena dalam air minum. EPA mengharuskan untuk melaporkan tumpahan atau pelepasan benzena secara tidak sengaja ke lingkungan minimal 10 pon (4,5 kg).
Administrasi Keselamatan dan Kesehatan Kerja AS (OSHA) telah menetapkan batas paparan yang diizinkan sebesar 1 bagian benzena per juta bagian udara (1 ppm) di tempat kerja selama 8 jam kerja per hari, 40 jam kerja per minggu. Batas paparan jangka pendek untuk benzena di udara adalah 5 ppm selama 15 menit.[74] Batasan hukum ini didasarkan pada penelitian yang menunjukkan bukti kuat risiko kesehatan bagi pekerja yang terpapar benzena. Risiko paparan 1 ppm untuk masa kerja telah diperkirakan sebagai 5 kematian leukemia berlebih per 1.000 karyawan yang terpapar. (Perkiraan ini tidak memiliki ambang batas untuk efek karsinogenik benzena.) OSHA juga telah menetapkan tingkat tindakan 0,5 ppm untuk mendorong paparan yang lebih rendah di tempat kerja.[75]
National Institute for Occupational Safety and Health AS (NIOSH) merevisi konsentrasi Immediately Dangerous to Life and Health (IDLH) untuk benzena menjadi 500 ppm. Definisi NIOSH saat ini untuk kondisi IDLH, seperti yang diberikan dalam Logika Pemilihan Respirator NIOSH, adalah salah satu yang menimbulkan ancaman paparan terhadap kontaminan di udara ketika paparan itu mungkin menyebabkan kematian atau efek kesehatan permanen yang segera atau tertunda atau mencegah keluar dari suatu lingkungan [NIOSH 2004]. Tujuan penetapan nilai IDLH adalah (1) untuk memastikan bahwa pekerja dapat melarikan diri dari lingkungan yang terkontaminasi jika terjadi kegagalan peralatan perlindungan pernafasan dan (2) dianggap sebagai level maksimum di atas yang hanya diizinkan untuk alat bantu pernapasan yang sangat andal yang memberikan perlindungan pekerja maksimal. [NIOSH 2004[76]].[77] Pada September 1995, NIOSH menerbitkan kebijakan baru untuk mengembangkan batas paparan yang direkomendasikan (recommended exposure limit, REL)untuk zat-zat, termasuk karsinogen. Oleh karena benzena dapat menyebabkan kanker, NIOSH merekomendasikan bahwa seluruh pekerja menggunakan alat bantu pernapasan khusus ketika mereka rentan terpapar benzena pada level melebihi REL (10-jam) 0,1 ppm.[78] Batas paparan jangka pendek NIOSH (STEL – 15 menit) adalah 1 ppm.
American Conference of Governmental Industrial Hygienists (ACGIH) mengadopsi Nilai Ambang Batas (TLV) untuk benzena pada 0,5 ppm TWA dan 2,5 ppm STEL.
Peraturan Menteri Kesehatan Republik Indonesia No. 70 tahun 2016 tentang Standar dan Persyaratan Kesehatan Lingkungan Kerja Industri mensyaratkan Nilai Ambang Batas (NAB) benzena sebesar 0,5 ppm TWA dan 2,5 ppm STEL.[79]
Toksikologi
[sunting | sunting sumber]Biomarker paparan
[sunting | sunting sumber]Beberapa pengujian dapat menentukan paparan benzena. Benzena dapat diukur melalui pernapasan, darah atau urine, tetapi pengujian semacam ini biasanya terbatas pada 24 jam pertama pasca paparan karena cepatnya penghilangan benzena melalui hembusan napas atau biotransformasi. Sebagian besar orang di negara maju memiliki ukuran level dasar benzena dan hidrokarbon aromatik lainnya dalam darah mereka. Di dalam tubuh, benzena diubah secara enzimatis menjadi sejumlah produk oksidasi termasuk asam mukonat, asam fenilmerkapturat, fenol, katekol, hidrokuinona dan 1,2,4-trihidroksibenzena. Sebagian besar dari metabolit ini memiliki nilai sebagai biomarker paparan pada manusia, karena mereka terakumulasi dalam urine secara proporsional terhadap durasi dan kadar paparan, selain itu, mereka juga tetap ada hingga beberapa hari setelah paparan berhenti. Batas paparan biologis menurut ACGIH untuk paparan kerja adalah 500 μg/g kreatinin untuk asam mukonat dan 25 μg/g kreatinin untuk asam fenilmerkapturat dalam spesimen urine akhir waktu (end-of-shift).[80][81][82][83]
Biotransformasi
[sunting | sunting sumber]Meskipun bukan substrat yang umum dalam metabolisme, benzena dapat dioksidasi oleh bakteri dan eukaryota. Dalam bakteri, enzim dioksigenase dapat menambahkan oksigen ke dalam cincin, dan produknya yang tidak stabil segera tereduksi (oleh NADH) menjadi diol siklik dengan dua ikatan ganda, merusak kearomatikannya. Selanjutnya, diol direduksi oleh NADH menjadi katekol. Katekol lalu dimetabolisme menjadi asetil KoA dan suksinil KoA, yang digunakan oleh organisme terutama dalam siklus Krebs untuk produksi energi.
Jalur metabolisme benzena cukup kompleks dan dimulai di dalam liver. Beberapa enzim terlibat di dalamnya. Ini mencakup sitokrom P450 2E1 (CYP2E1), kuinina oksidoreduktase (NQ01 atau DT-diaforase atau NAD(P)H dehidrogenase (kuinona 1)), GSH, dan myeloperoksidase (MPO). CYP2E1 terlibat pada banyak tahapan: konversi benzena menjadi oksepin (benzena oksida), fenol menjadi hidrokuinona, dan hidrokuinona menjadi benzenatriol dan katekol. Hidrokuinona, benzenatriol dan katekol diubah menjadi polifenol. Di dalam sumsum tulang, MPO mengubah polifenol ini menjadi benzokuinona. Zat antara dan metabolit ini menginduksi genotoksisitas melalui berbagai mekanisme termasuk menghambat topoisomerase II (yang memelihara struktur sel dan organisasi), menghasilkan radikal bebas oksigen (spesies tak stabil) yang memicu mutasi, meningkatkan tekanan oksidatif, menginduksi pemecahan untai DNA, dan menguban metilasi DNA (yang dapat mempengaruhi ekspresi gen). NQ01 dan GSH mengubah metabolisme dari toksisitas. NQ01 memetabolisme benzokuinona menjadi polifenol (menangkal efek MPO). GSH terlibat dalam pembentukan asam fenilmerkapturat.[63][84]
Polimorfisme genetik dalam enzim ini dapat menyebabkan hilangnya fungsi atau peningkatan fungsi. Sebagai contoh, mutasi pada CYP2E1 meningkatkan aktivitas dan menghasilkan peningkatan metabolit toksik. Mutasi NQ01 mengakibatkan hilangnya fungsi dan dapat menyebabkan penurunan detoksifikasi. Mutasi myeloperoksidase mengakibatkan hilangnya fungsi dan dapat menyebabkan penurunan pembentukan metabolit toksik. Mutasi atau penghapusan GSH mengakibatkan hilangnya fungsi dan mengakibatkan penurunan detoksifikasi. Gen-gen ini mungkin menjadi target penyaringan genetik untuk kerentanan terhadap toksisitas benzena.[85]
Toksikologi molekuler
[sunting | sunting sumber]Paradigma penilaian toksikologis benzena bergeser ke arah domain toksikologi molekuler karena memungkinkan pemahaman mekanisme biologis mendasar dengan cara yang lebih baik. Glutation tampaknya memainkan peran penting dengan melindungi terhadap kerusakan DNA yang diinduksi benzena dan sedang diidentifikasi sebagai biomarker baru untuk paparan dan efeknya.[86] Benzena menyebabkan penyimpangan kromosom pada leukosit darah perifer dan sumsum tulang yang menjelaskan tingginya insiden leukemia dan multiple myeloma yang disebabkan oleh paparan kronis. Penyimpangan ini dapat dipantau menggunakan hibridisasi in situ pendarfluor (FISH) dengan kuar DNA untuk menilai efek benzena bersama dengan tes hematologi sebagai penanda hematotoksisitas.[87] Metabolisme benzena melibatkan enzim yang dikode oleh gen polimorfik. Penelitian telah menunjukkan bahwa genotipe pada lokus ini dapat memengaruhi kerentanan terhadap efek toksik paparan benzena. Individu yang membawa varian NAD(P)H: kuinona oksidoreduktase 1 (NQ01), mikrosomal epoksida hidrolase (EPHX) dan penghapusan glutation S-transferase T1 (GSTT1) menunjukkan frekuensi yang lebih besar pada pemecahan untaian tunggal DNA.[88]
Oksidasi biologis dan aktivitas karsinogenik
[sunting | sunting sumber]Salah satu cara memahami efek karsinogenik benzena adalah dengan memeriksa produk-produk oksidasi biologis. Benzena murni, misalnya, teroksidasi dalam tubuh untuk menghasilkan epoksida, benzena oksida, yang tidak diekskresikan dengan mudah dan dapat berinteraksi dengan DNA menghasilkan mutasi berbahaya.
Jalur paparan
[sunting | sunting sumber]Inhalasi
[sunting | sunting sumber]Udara luar mungkin mengandung kadar benzena yang rendah dari bengkel mobil, asap kayu, asap tembakau, transfer bensin, knalpot kendaraan bermotor, dan emisi industri.[89] Sekitar 50% dari keseluruhan paparan benzena secara nasional (Amerika Serikat) berasal dari merokok tembakau atau dari paparan asap tembakau.[90] Setelah merokok 32 batang per hari, perokok akan mengonsumsi sekitar 1,8 miligram (mg) benzena. Jumlah ini sekitar 10 kali rata-rata asupan benzena harian oleh non-perokok.[91]
Benzena yang terhirup sebagian besar dikeluarkan lagi dalam bentuk aslinya melalui hembusan napas. Penelitan pada manusia menunjukkan bahwa 16,4% sampai 41,6% benzena yang tertahan akan dikeluarkan melalui paru-paru dalam waktu lima hingga tujuh jam, setelah terpapar 47 sampai 110 ppm selama dua hingga tiga jam, dan hanya 0,07% hingga 0,2% benzena yang tersisa dikeluarkan dalam bentuk aslinya melalui urine. Setelah terpapar 63 hingga 405 mg/m3 benzena selama 1 hingga 5 jam, 51% sampai 87% dikeluarkan melalui urine sebagai fenol dalam waktu 23 hingga 50 jam. Dalam penelitian lainnya, 30% benzena yang diserap melalui kulit, yang metabolisme utamanya berada pada liver, dikeluarkan sebagai fenol dalam urine.[92]
Paparan dari minuman ringan
[sunting | sunting sumber]Dalam kondisi tertentu dan dengan kehadiran bahan kimia lain, asam benzoat (suatu pengawet) dan asam askorbat (Vitamin C) dapat berinteraksi menghasilkan benzena. Pada Maret 2006, Food Standards Agency di Inggris Raya melakukan survei terhadap 150 merek minuman ringan. Ditemukan bahwa empat mengandung benzena dengan kadar di atas batas yang ditentukan oleh Organisasi Kesehatan Dunia (WHO). Lompok (bahasa Inggris: batch) yang terdampak ditarik dari peredaran. Masalah serupa dilaporkan oleh FDA di Amerika Serikat.[93]
Kontaminasi pasokan air
[sunting | sunting sumber]Pada tahun 2005, pasokan air ke kota Harbin di Tiongkok dengan populasi hampir sembilan juta orang, dihentikan karena paparan benzena dalam jumlah besar.[94] Benzena bocor ke dalam sungai Songhua, yang memasok air minum ke kota tersebut, setelah kejadian ledakan di pabrik China National Petroleum Corporation (CNPC) di kota Jilin pada 13 November 2005.
Injeksi
[sunting | sunting sumber]Nazi menggunakan benzena yang disuntikkan sebagai salah satu cara dari sekian meteode pembunuhan.[95][96]
Lihat juga
[sunting | sunting sumber]- Aromatik cincin 6 dengan satu karbon digantikan oleh gugus lain: borabenzena, benzena, silabenzena, germabenzena, stanabenzena, piridina, fosforina, arsabenzena, garam pirilium.
- BTX (Benzena, Toluena, dan isomer Xilena)
Catatan
[sunting | sunting sumber]- ^ Kritik menunjukkan masalah dengan struktur asli benzena Kekulé (1865): Kapan saja benzena mengalami substitusi pada posisi orto, seharusnya dihasilkan dua isomer yang dapat dibedakan, tergantung pada apakah ada ikatan rangkap atau ikatan tunggal di antara atom-atom karbon tempat substituen menempel; namun, tidak ada isomer yang diamati. Pada tahun 1872, Kekulé menyarankan bahwa benzena memiliki dua struktur yang saling melengkapi dan bahwa bentuk-bentuk ini saling bertukar dengan cepat, sehingga jika ada ikatan rangkap antara setiap pasangan atom karbon pada satu saat, ikatan rangkap itu akan menjadi ikatan tunggal pada saat berikutnya (dan sebaliknya). Untuk menyediakan mekanisme bagi proses konversi, Kekulé mengusulkan bahwa valensi atom ditentukan oleh frekuensi bertabrakan dengan tetangganya dalam sebuah molekul. Ketika atom karbon pada cincin benzena saling bertabrakan, setiap atom karbon akan bertabrakan dua kali dengan satu tetangga selama interval yang diberikan dan kemudian dua kali dengan tetangga lainnya selama interval berikutnya. Dengan demikian, ikatan rangkap akan ada dengan satu tetangga selama interval pertama dan dengan tetangga lain selama interval berikutnya. Oleh karena itu, di antara atom karbon benzena tidak ada ikatan tunggal atau rangkap yang tetap (konstan) dan berbeda; sebaliknya, ikatan antar atom karbon adalah identik. Lihat halaman 86–89 Auguste Kekulé (1872) "Ueber einige Condensationsprodukte des Aldehyds" (On some condensation products of aldehydes), Liebig's Annalen der Chemie und Pharmacie, 162(1): 77–124, 309–320. Dari hal. 89: "Das einfachste Mittel aller Stöße eines Kohlenstoffatoms ergiebt sich aus der Summe der Stöße der beiden ersten Zeiteinheiten, die sich dann periodisch wiederholen. … man sieht daher, daß jedes Kohlenstoffatom mit den beiden anderen, … daß diese Verschiedenheit nur eine scheinbare, aber keine wirkliche ist." (Rata-rata paling sederhana dari semua tumbukan atom karbon [dalam benzena] adalah jumlah tumbukan dari dua satuan waktu pertama, yang kemudian berulang secara berkala. ... dengan demikian kita dapat melihat bahwa setiap atom karbon bertabrakan secara merata dengan dua atom karbon yang dihadapinya, [dan] dengan demikian memiliki hubungan yang persis sama dengan kedua tetangganya. Rumus struktur benzena yang biasa hanya mengekspresikan tumbukan yang terjadi selama satu unit dalam satu waktu, sehingga selama satu fase, dan karenanya mengarah pada pandangan [bahwa] turunan [benzena] yang disubstitusi dua kali harus berbeda pada posisi 1,2 dan 1,6 [pada cincin benzena]. Jika ide [yang] baru saja disajikan — atau yang serupa — dapat dianggap benar, maka perbedaan [antara ikatan di posisi 1,2 dan 1,6] hanya sesuatu yang semu, bukan kenyataan.)
Referensi
[sunting | sunting sumber]- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. hlm. 10, 22, 204, 494, 577. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). "Solubility of Benzene in Water". Industrial & Engineering Chemistry Chemical & Engineering Data Series. 3 (2): 253–256. doi:10.1021/i460004a016.
- ^ Breslow, R.; Guo, T. (1990). "Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers". Proceedings of the National Academy of Sciences of the United States of America. 87 (1): 167–9. Bibcode:1990PNAS...87..167B. doi:10.1073/pnas.87.1.167. PMC 53221
 . PMID 2153285.
. PMID 2153285.
- ^ Coker, A. Kayode; Ludwig, Ernest E. (2007). Ludwig's Applied Process Design for Chemical And Petrochemical Plants. 1. Elsevier. hlm. 114. ISBN 978-0-7506-7766-0. Diakses tanggal 2012-05-31.
- ^ a b c d e "Benzol".
- ^ a b Atherton Seidell; William F. Linke (1952). Solubilities of Inorganic and Organic Compounds: A Compilation of Solubility Data from the Periodical Literature. Supplement. Van Nostrand.
- ^ a b c Benzene dalam Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (diakses tanggal 2014-05-29)
- ^ a b c Sigma-Aldrich Co., Benzene. Retrieved on 2014-05-29.
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0049". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Benzene". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ The word "benzoin" is derived from the Arabic expression "luban jawi", or "frankincense of Java". Morris, Edwin T. (1984). Fragrance: The Story of Perfume from Cleopatra to Chanel. Charles Scribner's Sons. hlm. 101. ISBN 978-0684181950.
- ^ a b Rocke, A. J. (1985). "Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory". Annals of Science. 42 (4): 355–81. doi:10.1080/00033798500200411.
- ^ Faraday, M. (1825). "On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat". Philosophical Transactions of the Royal Society. 115: 440–466. doi:10.1098/rstl.1825.0022
 . JSTOR 107752. Pada halaman 443–450, Faraday mendiskusikan "bikarburet hidrogen" (benzena). Pada halaman 449–450, ia menunjukkan bahwa rumus empiris benzena adalah C6H6, meskipun dia tidak menyadarinya karena ia (seperti kimiawan di zamannya), menggunakan massa atom karbon yang salah (6 bukannya 12).
. JSTOR 107752. Pada halaman 443–450, Faraday mendiskusikan "bikarburet hidrogen" (benzena). Pada halaman 449–450, ia menunjukkan bahwa rumus empiris benzena adalah C6H6, meskipun dia tidak menyadarinya karena ia (seperti kimiawan di zamannya), menggunakan massa atom karbon yang salah (6 bukannya 12).
- ^ Kaiser, R. (1968). "Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968". Angewandte Chemie International Edition in English. 7 (5): 345–350. doi:10.1002/anie.196803451.
- ^ Mitscherlich, E. (1834). "Über das Benzol und die Säuren der Oel- und Talgarten" [On benzol and oily and fatty types of acids]. Annalen der Pharmacie. 9 (1): 39–48. doi:10.1002/jlac.18340090103. Pada catatan kaki halaman 43, Liebig, editor jurnal, menyarankan perubahan nama asli Mitscherlich untuk benzena (disebut "benzin") menjadi "benzol", karena akhiran "-in" memberi kesan bahwa benzin adalah alkaloid (contoh: Chinin (quinine, bahasa Indonesia: kuinina)), padahal benzena bukan alkaloid, sementara akhiran "-ol" memberi kesan bahwa benzena berminyak, yang memang dimiliki oleh benzena. Sehingga pada halaman 44, Mitscherlich menyatakan: "Da diese Flüssigkeit aus der Benzoësäure gewonnen wird, und wahrscheinlich mit den Benzoylverbindungen im Zusammenhang steht, so gibt man ihr am besten den Namen Benzol, da der Name Benzoïn schon für die mit dem Bittermandelöl isomerische Verbindung von Liebig und Wöhler gewählt worden ist." (Oleh karena cairan ini [benzena] diperoleh dari asam benzoat dan mungkin senyawa benzoil terkait, nama terbaiknya adalah "benzol", karena nama "benzoin" telah dipilih, oleh Liebig dan Wöhler, untuk senyawa yang berisomer dengan minyak badam pahit [benzaldehida].)
- ^ Laurent, Auguste (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique," Annales de Chemie et de Physique, vol. 63, pp. 27–45, see p. 44: "Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage." (Saya memberi nama "phène" (φαινω, saya menerangi) ke radikal mendasar dari asam sebelumnya, karena benzena ditemukan dalam gas yang menerangi.)
- ^ Hofmann, A. W. (1845) "Ueber eine sichere Reaction auf Benzol" (On a reliable test for benzene), Annalen der Chemie und Pharmacie, vol. 55, pp. 200–205; pada halaman 204–205, Hofmann menemukan benzena dalam minyak tar batu bara.
- ^ Mansfield Charles Blachford (1849). "Untersuchung des Steinkohlentheers". Annalen der Chemie und Pharmacie. 69 (2): 162–180. doi:10.1002/jlac.18490690203.
- ^ Charles Mansfield filed for (November 11, 1847) and received (May 1848) a patent (no. 11,960) for the fractional distillation of coal tar.
- ^ Hoffman, Augustus W. (1856). "On insolinic acid". Proceedings of the Royal Society. 8: 1–3. doi:10.1098/rspl.1856.0002
 .
. The existence and mode of formation of insolinic acid prove that to the series of monobasic aromatic acids, Cn2Hn2-8O4, the lowest known term of which is benzoic acid, … .
[Catatan: Rumus empiris senyawa organik yang muncul dalam artikel Hofmann (p.3) berdasarkan massa atom karbon 6 (bukan 12) dan massa atom oksigen 8 (bukan 16).] - ^ Cernicharo, José; et al. (1997), "Infrared Space Observatory's Discovery of C4H2, C6H2, and Benzene in CRL 618", Astrophysical Journal Letters, 546 (2): L123–L126, Bibcode:2001ApJ...546L.123C, doi:10.1086/318871

- ^ Claus, Adolph K.L. (1867) "Theoretische Betrachtungen und deren Anwendungen zur Systematik der organischen Chemie" (Theoretical considerations and their applications to the classification scheme of organic chemistry), Berichte über die Verhandlungen der Naturforschenden Gesellschaft zu Freiburg im Breisgau (Reports of the Proceedings of the Scientific Society of Freiburg in Breisgau), 4 : 116-381. In the section Aromatischen Verbindungen (aromatic compounds), pp. 315-347, Claus presents Kekulé's hypothetical structure for benzene (p. 317), presents objections to it, presents an alternative geometry (p. 320), and concludes that his alternative is correct (p.326). See also figures on p. 354 or p. 379.
- ^ Dewar, James (1867) "On the oxidation of phenyl alcohol, and a mechanical arrangement adapted to illustrate structure in the non-saturated hydrocarbons," Proceedings of the Royal Society of Edinburgh 6: 82–86.
- ^ Ladenburg, Albert (1869) "Bemerkungen zur aromatischen Theorie" (Observations on the aromatic theory), Berichte der Deutschen Chemischen Gesellschaft 2: 140–142.
- ^ Armstrong, Henry E. (1887) "An explanation of the laws which govern substitution in the case of benzenoid compounds," Journal of the Chemical Society, 51, 258–268; see p. 264.
- ^ Thiele, Johannes (1899) "Zur Kenntnis der ungesättigten Verbindungen" (On our knowledge of unsaturated compounds), Justus Liebig’s Annalen der Chemie,306: 87–142; see: "VIII. Die aromatischen Verbindungen. Das Benzol." (VIII. The aromatic compounds. Benzene.), pp. 125–129. See further: Thiele (1901) "Zur Kenntnis der ungesättigen Verbindungen," Justus Liebig’s Annalen der Chemie, 319: 129–143.
- ^ In his 1890 paper, Armstrong represented benzene nuclei within polycyclic benzenoids by placing inside the benzene nuclei a letter "C", an abbreviation of the word "centric". Centric affinities (i.e., bonds) acted within a designated cycle of carbon atoms. From p. 102: " … benzene, according to this view, may be represented by a double ring, in fact." See:
- Armstrong, H.E. (1890). "The structure of cycloid hydrocarbons". Proceedings of the Chemical Society. 6: 101–105.
- Armit, James Wilson; Robinson, Robert (1925). "Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". Journal of the Chemical Society, Transactions. 127: 1604–1618. doi:10.1039/ct9252701604.
- Balaban, Alexandru T.; Schleyer, Paul v. R.; Rzepa, Henry S. (2005). "Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons". Chemical Reviews. 105 (10): 3436–3447. doi:10.1021/cr0300946
 . PMID 16218557.
. PMID 16218557.
- ^ J. Loschmidt, Chemische Studien (Vienna, Austria-Hungary: Carl Gerold's Sohn, 1861), pp. 30, 65.
- ^ Kekulé, F. A. (1865). "Sur la constitution des substances aromatiques". Bulletin de la Société Chimique de Paris. 3: 98–110. Pada halaman 100, Kekulé menyarankan bahwa atom karbon benzena dapat membentuk sebuah "chaîne fermée" (rantai tertutup, suatu simpal).
- ^ Kekulé, F. A. (1866). "Untersuchungen über aromatische Verbindungen (Investigations of aromatic compounds)". Liebigs Annalen der Chemie und Pharmacie. 137 (2): 129–36. doi:10.1002/jlac.18661370202.
- ^ Rocke, A. J. (2010) Image and Reality: Kekule, Kopp, and the Scientific Imagination, University of Chicago Press, pp. 186–227, ISBN 0226723356.
- ^ Read, John (1995). From alchemy to chemistry. New York: Dover Publications. hlm. 179–180. ISBN 9780486286907.
- ^ English translation Wilcox, David H.; Greenbaum, Frederick R. (1965). "Kekule's benzene ring theory: A subject for lighthearted banter". Journal of Chemical Education. 42 (5): 266–67. Bibcode:1965JChEd..42..266W. doi:10.1021/ed042p266.
- ^ Kekulé, F. A. (1890). "Benzolfest: Rede". Berichte der Deutschen Chemischen Gesellschaft. 23: 1302–11. doi:10.1002/cber.189002301204.
- ^ Benfey O. T. (1958). "August Kekulé and the Birth of the Structural Theory of Organic Chemistry in 1858". Journal of Chemical Education. 35 (1): 21–23. Bibcode:1958JChEd..35...21B. doi:10.1021/ed035p21.
- ^ Gillis Jean (1966). "Auguste Kekulé et son oeuvre, réalisée à Gand de 1858 à 1867". Mémoires de la Classe des Sciences - Académie Royale des Sciences, des Lettres et des Beaux-arts de Belgique. 37 (1): 1–40.
- ^ Lonsdale, K. (1929). "The Structure of the Benzene Ring in Hexamethylbenzene". Proceedings of the Royal Society. 123A (792): 494. doi:10.1098/rspa.1929.0081
 .
.
- ^ Lonsdale, K. (1931). "An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method". Proceedings of the Royal Society. 133A (822): 536–553. Bibcode:1931RSPSA.133..536L. doi:10.1098/rspa.1931.0166
 .
.
- ^ See:
- Wilhelm Körner (1867) "Faits pour servir à la détermination du lieu chimique dans la série aromatique" (Facts to be used in determining chemical location in the aromatic series), Bulletins de l'Académie royale des sciences, des lettres et des beaux-arts de Belgique, 2nd series, 24 : 166–185; see especially p. 169. From p. 169: "On distingue facilement ces trois séries, dans lesquelles les dérivés bihydroxyliques ont leurs terms correspondants, par les préfixes ortho-, para- et mêta-." (One easily distinguishes these three series – in which the dihydroxy derivatives have their corresponding terms – by the prefixes ortho-, para- and meta-.)
- Hermann von Fehling, ed., Neues Handwörterbuch der Chemie [New concise dictionary of chemistry] (Braunschweig, Germany: Friedrich Vieweg und Sohn, 1874), vol. 1, p. 1142.
- ^ Graebe (1869) "Ueber die Constitution des Naphthalins" (On the structure of naphthalene), Annalen der Chemie und Pharmacie, 149 : 20–28; see especially p. 26.
- ^ Victor Meyer (1870) "Untersuchungen über die Constitution der zweifach-substituirten Benzole" (Investigations into the structure of di-substituted benzenes), Annalen der Chemie und Pharmacie, 156 : 265–301; see especially pp. 299–300.
- ^ Williams, P.R.D.; Knutsen, J.S.; Atkinson, C.; Madl, A.K.; Paustenbach, D.J. (2007). "Airborne Concentrations of Benzene Associated with the Historical Use of Some Formulations of Liquid Wrench". Journal of Occupational and Environmental Hygiene. 4 (8): 547–561. doi:10.1080/15459620701446642.
- ^ a b Hillis O. Folkins (2005). "Benzene". Ullmann's Encyclopedia of Industrial Chemistry. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_475. ISBN 978-3527306732.
- ^ Bacon, G. E.; Curry, N.; Wilson, S. (1964). "A Crystallographic Study of Solid Benzene by Neutron Diffraction". Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 279: 98–110. Diakses tanggal April 22, 2020 – via JSTOR.
- ^ Moran D, Simmonett AC, Leach FE, Allen WD, Schleyer PV, Schaefer HF (2006). "Popular Theoretical Methods Predict Benzene and Arenes To Be Nonplanar". Journal of the American Chemical Society. 128 (29): 9342–3. doi:10.1021/ja0630285. PMID 16848464.
- ^ Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "The electronic structure of the benzene molecule". Nature. 323 (6090): 699–701. Bibcode:1986Natur.323..699C. doi:10.1038/323699a0.
- ^ Pauling, Linus (1987). "Electronic structure of the benzene molecule". Nature. 325 (6103): 396. Bibcode:1987Natur.325..396P. doi:10.1038/325396d0.
- ^ Messmer, Richard P.; Schultz, Peter A. (1987). "The electronic structure of the benzene molecule". Nature. 329 (6139): 492. Bibcode:1987Natur.329..492M. doi:10.1038/329492a0.
- ^ Harcourt, Richard D. (1987). "The electronic structure of the benzene molecule". Nature. 329 (6139): 491–492. Bibcode:1987Natur.329..491H. doi:10.1038/329491b0.
- ^ "Unicode Character 'BENZENE RING' (U+232C)". fileformat.info. Diakses tanggal 2009-01-16.
- ^ "Unicode Character 'BENZENE RING WITH CIRCLE' (U+23E3)". fileformat.info. Diakses tanggal 2009-01-16.
- ^ "Heterocyclic Chemistry: Heterocyclic Compounds". Michigan State University, Department of Chemistry.
- ^ "Market Study: Benzene (2nd edition), Ceresana, August 2014". ceresana.com. Diarsipkan dari versi asli tanggal 2017-12-21. Diakses tanggal 2015-02-10.
- ^ "Market Study: Toluene, Ceresana, January 2015". ceresana.com. Diakses tanggal 2015-02-10.
- ^ Kolmetz, Gentry, Guidelines for BTX Revamps, AIChE 2007 Spring Conference
- ^ "Control of Hazardous Air Pollutants From Mobile Sources". U.S. Environmental Protection Agency. 2006-03-29. hlm. 15853. Diarsipkan dari versi asli tanggal 2008-12-05. Diakses tanggal 2008-06-27.
- ^ Stranks, D. R.; M. L. Heffernan; K. C. Lee Dow; P. T. McTigue; G. R. A. Withers (1970). Chemistry: A structural view. Carlton, Victoria: Melbourne University Press. hlm. 347. ISBN 978-0-522-83988-3.
- ^ Welch, Vincent A.; Fallon, Kevin J. and Gelbke, Heinz-Peter (2005) "Ethylbenzene" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, doi:10.1002/14356007.a10_035.pub2
- ^ Kasper, Dennis L.et al. (2004) Harrison's Principles of Internal Medicine, 16th ed., McGraw-Hill Professional, p. 618, ISBN 0071402357.
- ^ Merck Manual, Home Edition, "Overview of Leukemia".
- ^ Bard, D (2014). "Traffic-related air pollution and the onset of myocardial infarction: disclosing benzene as a trigger? A small-area case-crossover study". PLOS One. 9 (6): 6. Bibcode:2014PLoSO...9j0307B. doi:10.1371/journal.pone.0100307. PMC 4059738
 . PMID 24932584.
. PMID 24932584.
- ^ a b Smith, Martyn T. (2010). "Advances in understanding benzene health effects and susceptibility". Annu Rev Public Health. 31: 133–48. doi:10.1146/annurev.publhealth.012809.103646. PMC 4360999
 . PMID 20070208.
. PMID 20070208.
- ^ American Petroleum Institute, API Toxicological Review, Benzene, September 1948, Agency for Toxic Substances and Disease Registry, Department of Health and Human Services
- ^ Smith, Martyn T. (2010-01-01). "Advances in Understanding Benzene Health Effects and Susceptibility". Annual Review of Public Health. 31 (1): 133–148. doi:10.1146/annurev.publhealth.012809.103646. PMC 4360999
 . PMID 20070208.
. PMID 20070208.
- ^ WHO. International Agency for Research on Cancer, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs Diarsipkan 2008-03-06 di Wayback Machine., Volumes 1 to 42, Supplement 7
- ^ Huff J (2007). "Benzene-induced cancers: abridged history and occupational health impact". Int J Occup Environ Health. 13 (2): 213–21. doi:10.1179/oeh.2007.13.2.213. PMC 3363002
 . PMID 17718179.
. PMID 17718179.
- ^ Rana SV; Verma Y (2005). "Biochemical toxicity of benzene". J Environ Biol. 26 (2): 157–68. PMID 16161967.
- ^ Agency for Toxic Substances and Disease Registry. (2007). Benzene: Patient information sheet.
- ^ Yardley-Jones, A.; Anderson, D.; Parke, D. V. (1991). "The toxicity of benzene and its metabolism and molecular pathology in human risk assessment". British Journal of Industrial Medicine. 48 (7): 437–44. doi:10.1136/oem.48.7.437. PMC 1035396
 . PMID 1854646.
. PMID 1854646.
- ^ Occupational Safety and Health Standards, Toxic and Hazardous Substances, 1910.1028. Osha.gov. Retrieved on 2011-11-23.
- ^ Public Health Statement for Benzene, Agency for Toxic Substances and Disease Registry. (August 2007). Benzene: Patient information sheet. Atsdr.cdc.gov (2011-03-03). Retrieved on 2011-11-23.
- ^ Drinking Water Contaminants|Organic Chemicals|Benzene. Water.epa.gov. Retrieved on 2014-04-17.
- ^ Chemical Sampling Information Benzene Diarsipkan 2015-06-29 di Wayback Machine.. Osha.gov. Retrieved on 2011-11-23.
- ^ Benzene Toxicity: Standards and Regulations|ATSDR – Environmental Medicine & Environmental Health Education – CSEM. Atsdr.cdc.gov (2000-06-30). Retrieved on 2010-10-09.
- ^ NIOSH respirator selection logic Diarsipkan 2017-08-29 di Wayback Machine. (October 2004). Cincinnati, OH: U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occupational Safety and Health, DHHS (NIOSH). Publication No. 2005-100.
- ^ Documentation for Immediately Dangerous to Life or Health Concentrations (IDLH): Introduction. Cdc.gov. Retrieved on 2011-11-23.
- ^ "Public Health Statement for Benzene" U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occupational Safety and Health. Atsdr.cdc.gov (2011-03-03). Retrieved on 2011-11-23.
- ^ PERATURAN MENTERI KESEHATAN REPUBLIK INDONESIA NOMOR 70 TAHUN 2016 TENTANG STANDAR DAN PERSYARATAN KESEHATAN LINGKUNGAN KERJA INDUSTRI (PDF), diarsipkan dari versi asli (PDF) tanggal 2020-02-27, diakses tanggal 2020-05-02
- ^ Ashley, DL; Bonin, MA; Cardinali, FL; McCraw, JM; Wooten, JV (1994). "Blood concentrations of volatile organic compounds in a nonoccupationally exposed US population and in groups with suspected exposure" (PDF). Clinical Chemistry. 40 (7 Pt 2): 1401–4. doi:10.1093/clinchem/40.7.1401. PMID 8013127.
- ^ Fustinoni S, Buratti M, Campo L, Colombi A, Consonni D, Pesatori AC, Bonzini M, Farmer P, Garte S, Valerio F, Merlo DF, Bertazzi PA (2005). "Urinary t,t-muconic acid, S-phenylmercapturic acid and benzene as biomarkers of low benzene exposure". Chemico-Biological Interactions. 153–154: 253–6. doi:10.1016/j.cbi.2005.03.031. PMID 15935823.
- ^ ACGIH (2009). 2009 TLVs and BEIs. American Conference of Governmental Industrial Hygienists, Cincinnati, Ohio.
- ^ Baselt, R. (2008) Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, pp. 144–148, ISBN 0962652377.
- ^ Snyder, R; Hedli, C.C. (1996). "An overview of benzene metabolism". Environ Health Perspect. 104 (Suppl 6): 1165–1171. doi:10.1289/ehp.96104s61165. PMC 1469747
 . PMID 9118888.
. PMID 9118888.
- ^ Dougherty, D; Garte, S; Barchowsky, A; Zmuda, J; Taioli, E (2008). "NQO1, MPO, CYP2E1, GSTT1 and STM1 polymorphisms and biological effects of benzene exposure—a literature review". Toxicology Letters. 182 (1–3): 7–17. doi:10.1016/j.toxlet.2008.09.008. PMID 18848868.
- ^ Fracasso ME, Doria D, Bartolucci GB, Carrieri M, Lovreglio P, Ballini A, Soleo L, Tranfo G, Manno M (2010). "Low air levels of benzene: Correlation between biomarkers of exposure and genotoxic effects". Toxicol Lett. 192 (1): 22–8. doi:10.1016/j.toxlet.2009.04.028. PMID 19427373.
- ^ Eastmond, D.A.; Rupa, DS; Hasegawa, LS (2000). "Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes". Mutat Res. 322 (1): 9–20. doi:10.1016/0165-1218(94)90028-0. PMID 7517507.
- ^ Garte, S; Taioli, E; Popov, T; Bolognesi, C; Farmer, P; Merlo, F (2000). "Genetic susceptibility to benzene toxicity in humans". J Toxicol Environ Health A. 71 (22): 1482–1489. doi:10.1080/15287390802349974. PMID 18836923.
- ^ ToxFAQs for Benzene, Agency for Toxic Substances and Disease Registry, Department of Health and Human Services Diarsipkan 2008-03-09 di Wayback Machine.
- ^ ToxGuide for Benzene, Agency for Toxic Substances and Disease Registry, Department of Health and Human Services
- ^ Public Health Statement. Benzene, Division of Toxicology and Environmental Medicine, August 2007
- ^ Benzene, CASRN: 71-43-2. Hazardous Substances Data Bank, U.S. National Library of Medicine. National Institutes of Health.
- ^ "FDA: Too Much Benzene In Some Drinks", CBS News, May 19, 2006. Retrieved July 11, 2006.
- ^ "100 tonnes of pollutants spilled into Chinese river". The Guardian. 25 November 2005. Diakses tanggal 7 January 2020.
- ^ "Selections and lethal injections"
- ^ "A Former Nazi Labor Camp in Austria, Now Billed as a Tourist Site ", Haaretz, May 3, 2019.
Bacaan lebih lanjut
[sunting | sunting sumber]- Johari, J.M.C. (2007). Kimia 3 SMA dan MA Untuk Kelas XII. Jakarta: Esis/Erlangga. ISBN 974-734-721-4. (Indonesia)
Pranala luar
[sunting | sunting sumber]- Benzene at The Periodic Table of Videos (University of Nottingham)
- International Chemical Safety Card 0015
- USEPA Summary of Benzene Toxicity
- NIOSH Pocket Guide to Chemical Hazards
- Benzene dari PubChem
- Dept. of Health and Human Services: TR-289: Toxicology and Carcinogenesis Studies of Benzene
- Video Podcast of Sir John Cadogan giving a lecture on Benzene since Faraday, in 1991
- Substance profile
- Benzena in the ChemIDplus database
- NLM Hazardous Substances Databank – Benzene
- Senyawa kimia
- Benzena
- Modulator alosterik positif reseptor GABAA
- Anulena
- Hidrokarbon aromatik
- Cincin aromatik sederhana
- Karsinogen IARC Golongan 1
- Pelarut hidrokarbon
- Imunotoksin
- Mutagen
- Teratogen
- Kesehatan dan keselamatan kerja
- Karsinogen
- Bahan kimia komoditas
- Petrokimia
- Pelarut aromatik
- Cincin bersuku enam
- Pencemaran tanah
- Pencemaran udara
- Pencemaran air