Elektrokimia: Perbedaan antara revisi
sunting isi |
sunting isi |
||
| Baris 1: | Baris 1: | ||
[[Berkas:Lead acid cell.svg|jmpl|[[Baterai]] asam-timbal|199x199px]] |
|||
'''Elektrokimia''' adalah cabang ilmu kimia fisik yang mempelajari aspek [[elektronik]] dari reaksi kimia. [[Elemen]] yang digunakan dalam [[reaksi kimia|reaksi]] elektrokimia dikarakterisasikan dengan banyaknya [[elektron]] yang dimiliki. Secara umum elektronika terbagi dalam dua kelompok, yaitu [[sel galvani]] dan [[sel elektrolisis]]. Reaksi elektrokimia dapat berlangsung secara spontan, yaitu ketika dua elektrode yang direndam di dalam cairan elektrolit dihubungkan dengan untai [[listrik]].<ref>{{Cite web|title=Electrochemical reaction {{!}} chemistry|url=https://www.britannica.com/science/electrochemical-reaction|website=Encyclopedia Britannica|language=en|access-date=2020-09-13}}</ref><ref>{{Cite web|title=Electrochemistry {{!}} Encyclopedia.com|url=https://www.encyclopedia.com/science-and-technology/chemistry/chemistry-general/electrochemistry#:~:text=Electrochemistry%20deals%20with%20the%20links,electric%20energy%20by%20chemical%20reactions.|website=www.encyclopedia.com|access-date=2020-09-13}}</ref> |
'''Elektrokimia''' adalah cabang ilmu kimia fisik yang mempelajari aspek [[elektronik]] dari reaksi kimia. [[Elemen]] yang digunakan dalam [[reaksi kimia|reaksi]] elektrokimia dikarakterisasikan dengan banyaknya [[elektron]] yang dimiliki. Secara umum elektronika terbagi dalam dua kelompok, yaitu [[sel galvani]] dan [[sel elektrolisis]]. Reaksi elektrokimia dapat berlangsung secara spontan, yaitu ketika dua elektrode yang direndam di dalam cairan elektrolit dihubungkan dengan untai [[listrik]].<ref>{{Cite web|title=Electrochemical reaction {{!}} chemistry|url=https://www.britannica.com/science/electrochemical-reaction|website=Encyclopedia Britannica|language=en|access-date=2020-09-13}}</ref><ref>{{Cite web|title=Electrochemistry {{!}} Encyclopedia.com|url=https://www.encyclopedia.com/science-and-technology/chemistry/chemistry-general/electrochemistry#:~:text=Electrochemistry%20deals%20with%20the%20links,electric%20energy%20by%20chemical%20reactions.|website=www.encyclopedia.com|access-date=2020-09-13}}</ref> |
||
== Redoks == |
|||
[[Berkas:Redox reaction.png|jmpl|Ilustrasi reaksi redoks]] |
|||
[[Redoks]] merupakan istilah yang menjelaskan berubahnya [[bilangan oksidasi]] (keadaan oksidasi) atom-atom dalam sebuah [[reaksi kimia]]. Istilah redoks berasal dari dua konsep, yaitu '''red'''uksi dan '''oks'''idasi.<ref>{{Cite web|title=Redox Reactions|url=http://www.chemistry.wustl.edu/~coursedev/Online%20tutorials/Redox.htm|website=www.chemistry.wustl.edu|access-date=2020-09-14}}</ref><ref>{{Cite web|title=Oxidation-reduction reaction {{!}} chemical reaction|url=https://www.britannica.com/science/oxidation-reduction-reaction|website=Encyclopedia Britannica|language=en|access-date=2020-09-14}}</ref><ref>{{Cite web|title=Definitions of oxidation and reduction (redox)|url=https://www.chemguide.co.uk/inorganic/redox/definitions.html|website=www.chemguide.co.uk|access-date=2020-09-14}}</ref> |
|||
* '''''Oksidasi''''' menjelaskan '''''pelepasan''''' [[elektron]] oleh sebuah [[molekul]], [[atom]], atau [[ion]] |
|||
* '''''Reduksi''''' menjelaskan '''''penambahan''''' [[elektron]] oleh sebuah [[molekul]], [[atom]], atau [[ion]]. |
|||
=== [[Oksidator]] dan [[reduktor]] === |
|||
Oksidator adalah zat yang mengoksidasi zat lain dalam suatu reaksi redoks. Sedangkan reduktor adalah zat yang mereduksi zat lain dalam suatu reaksi redoks.<ref>{{Cite web|title=Oxidizing agent|url=https://www.sciencedaily.com/terms/oxidizing_agent.htm|website=ScienceDaily|language=en|access-date=2020-09-14}}</ref><ref>{{Cite web|title=Oxidizing and Reducing Agents|url=https://chemed.chem.purdue.edu/genchem/topicreview/bp/ch19/oxred_3.php|website=chemed.chem.purdue.edu|access-date=2020-09-14}}</ref> |
|||
* '''Oksidator''' adalah zat yang '''mengalami reduksi'''. |
|||
* '''Reduktor''' adalah zat yang '''mengalami oksidasi'''. |
|||
== Lihat pula == |
== Lihat pula == |
||
* Kimia fisik |
* [[Kimia fisik]] |
||
* Redoks |
|||
== Referensi == |
== Referensi == |
||
Revisi per 14 September 2020 01.57

Elektrokimia adalah cabang ilmu kimia fisik yang mempelajari aspek elektronik dari reaksi kimia. Elemen yang digunakan dalam reaksi elektrokimia dikarakterisasikan dengan banyaknya elektron yang dimiliki. Secara umum elektronika terbagi dalam dua kelompok, yaitu sel galvani dan sel elektrolisis. Reaksi elektrokimia dapat berlangsung secara spontan, yaitu ketika dua elektrode yang direndam di dalam cairan elektrolit dihubungkan dengan untai listrik.[1][2]
Redoks
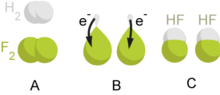
Redoks merupakan istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia. Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi.[3][4][5]
Oksidator adalah zat yang mengoksidasi zat lain dalam suatu reaksi redoks. Sedangkan reduktor adalah zat yang mereduksi zat lain dalam suatu reaksi redoks.[6][7]
- Oksidator adalah zat yang mengalami reduksi.
- Reduktor adalah zat yang mengalami oksidasi.
Lihat pula
- Kimia fisik
- Redoks
Referensi
- ^ "Electrochemical reaction | chemistry". Encyclopedia Britannica (dalam bahasa Inggris). Diakses tanggal 2020-09-13.
- ^ "Electrochemistry | Encyclopedia.com". www.encyclopedia.com. Diakses tanggal 2020-09-13.
- ^ "Redox Reactions". www.chemistry.wustl.edu. Diakses tanggal 2020-09-14.
- ^ "Oxidation-reduction reaction | chemical reaction". Encyclopedia Britannica (dalam bahasa Inggris). Diakses tanggal 2020-09-14.
- ^ "Definitions of oxidation and reduction (redox)". www.chemguide.co.uk. Diakses tanggal 2020-09-14.
- ^ "Oxidizing agent". ScienceDaily (dalam bahasa Inggris). Diakses tanggal 2020-09-14.
- ^ "Oxidizing and Reducing Agents". chemed.chem.purdue.edu. Diakses tanggal 2020-09-14.
