Proteasom: Perbedaan antara revisi
| Baris 26: | Baris 26: | ||
===Proteolisis=== |
===Proteolisis=== |
||
===Degradasi tidak tergantung ubiquitin=== |
===Degradasi tidak tergantung ubiquitin=== |
||
Meskipun sebagian besar substrat proteasomal harus ada di-ubiquitinasi sebelum didegradasi, ada beberapa pengecualian untuk aturan umum ini, terutama ketika proteasom memainkan peran normal dalam pemrosesan protein pasca-[[Translasi (genetik)|translasi]]. Aktivasi proteasomal NF-kB dengan memproses [[NFLB1|p105]] menjadi p50 melalui proteolisis internal merupakan salah satu contoh utama.<ref name="Rape">{{Cite journal|date=May 2002|title=Taking a bite: proteasomal protein processing|journal=Nature Cell Biology|volume=4|issue=5|pages=E113–6|doi=10.1038/ncb0502-e113|pmid=11988749|vauthors=Rape M, Jentsch S}}</ref> Beberapa protein yang dihipotesiskan menjadi tidak stabil karena daerah yang tidak terstruktur secara intrinsik,<ref name="Asher">{{Cite journal|date=August 2006|title=20S proteasomes and protein degradation "by default"|journal=BioEssays|volume=28|issue=8|pages=844–9|doi=10.1002/bies.20447|pmid=16927316|vauthors=Asher G, Reuven N, Shaul Y}}</ref> terdegradasi secara tidak bergantung ubiquitin. Contoh paling terkenal dari substrat proteasom yang tidak bergantung pada ubiquitin yaitu enzim ornitin dekarboksilase.<ref name="autogenerated1">{{Cite journal|date=April 2003|title=Determinants of proteasome recognition of ornithine decarboxylase, a ubiquitin-independent substrate|journal=The EMBO Journal|volume=22|issue=7|pages=1488–96|doi=10.1093/emboj/cdg158|pmc=152902|pmid=12660156|vauthors=Zhang M, Pickart CM, Coffino P}}</ref> Mekanisme tidak bergantung ubiquitin yang menargetkan regulator [[siklus sel]] utama seperti [[p53]] juga telah dilaporkan, meskipun p53 juga sasaran pada degradasi yang bergantung pada ubiquitin.<ref name="Asher2">{{Cite journal|date=August 2005|title=p53 proteasomal degradation: poly-ubiquitination is not the whole story|journal=Cell Cycle|volume=4|issue=8|pages=1015–8|doi=10.4161/cc.4.8.1900|pmid=16082197|vauthors=Asher G, Shaul Y}}</ref> Akhirnya, protein yang secara struktural abnormal, salah lipatan, atau sangat teroksidasi juga sasaran pada degradasi tidak bergantung ubiquitin dan tidak bergantung 19S dalam kondisi stres seluler.<ref name="Shringarpure2">{{Cite journal|date=January 2003|title=Ubiquitin conjugation is not required for the degradation of oxidized proteins by proteasome|journal=The Journal of Biological Chemistry|volume=278|issue=1|pages=311–8|doi=10.1074/jbc.M206279200|pmid=12401807|vauthors=Shringarpure R, Grune T, Mehlhase J, Davies KJ}}</ref> |
|||
==Evolusi== |
==Evolusi== |
||
Revisi per 18 Februari 2022 15.45
Proteasom adalah kompleks protein yang mendegradasi suatu protein yang tidak dibutuhkan atau rusak dengan cara proteolisis (reaksi kimia yang memutuskan ikatan peptida). Enzim yang membantu reaksi tersebut disebut protease.
Proteasom adalah bagian dari mekanisme utama di dalam sel yang mengatur konsentrasi protein tertentu dan mendegradasi protein yang gagal melipat. Untuk didegradasi, protein akan ditandai oleh protein kecil disebut ubiquitin. Reaksi penandaan tersebut dikatalisis oleh enzim yang disebut ubiquitin ligase. Setelah protein ditandai, hal tersebut memberi sinyal ke ligase lain untuk menempelkan molekul ubiquitin tambahan. Hasilnya yaitu rantai poliubiquitin yang diikat oleh proteasom, yang memungkinkannya untuk mendegradasi protein yang ditandai. Proses degradasi menghasilkan peptida dengan panjang sekitar tujuh hingga delapan asam amino, yang kemudian dapat didegradasi lebih lanjut menjadi rangkaian asam amino yang lebih pendek dan digunakan dalam mensintesis protein baru.[1]
Proteasom ditemukan pada semua eukariota dan arkea, dan pada beberapa bakteri. Pada eukariota, proteasom terletak baik di dalam nukleus maupun di dalam sitoplasma.[2]
Secara struktur, proteasom adalah kompleks silindris yang mengandung "inti" dari empat cincin bertumpuk yang membentuk pori pusat. Setiap cincin terdiri dari tujuh protein tunggal. Dua cincin bagian dalam terbuat dari tujuh β subunit yang mengandung tiga hingga tujuh situs aktif protease. Situs-situs ini terletak pada permukaan interior cincin, sehingga protein target harus masuk ke pori pusat sebelum terdegradasi. Dua cincin luar masing-masing berisi tujuh α subunit yang berfungsi untuk mempertahankan "gerbang" melalui protein-protein yang memasuki tabung. Subunit ini dikendalikan dengan mengikat struktur "tutup" atau partikel pengatur yang mengenali tag poliubiquitin yang melekat pada substrat protein dan memulai proses degradasi. Sistem keseluruhan ubiquitinasi dan degradasi proteasomal dikenal sebagai sistem ubiquitin-proteasom (ubiquitin–proteasome system, UPS).[3]
Jalur degradasi proteasomal sangat penting untuk banyak proses seluler, termasuk siklus sel, regulasi ekspresi gen, dan respons terhadap stres oksidatif. Pentingnya degradasi proteolitik di dalam sel dan peran ubiquitin dalam jalur proteolitik diakui dalam Penghargaan Nobel Kimia 2004 kepada Aaron Ciechanover, Avram Hershko, dan Irwin Rose.[4]
Penemuan
Sebelum penemuan sistem ubiquitin-proteasom, degradasi protein dalam sel diperkirakan terutama bergantung pada lisosom, suatu organel terikat membran dengan interior asam dan berisi protease yang dapat mendegradasi dan kemudian mendaur ulang protein eksogen dan organel tua atau rusak.[5] Namun, publikasi Joseph Etlinger dan Alfred L. Goldberg pada 1977 tentang degradasi protein yang bergantung pada ATP dalam retikulosit, yang kekurangan lisosom, menyarankan adanya mekanisme degradasi intraseluler kedua.[6] Hal ini ditunjukkan pada 1978 terdiri dari beberapa rantai protein yang berbeda, hal baru di antara protease pada saat itu.[7] Pekerjaan selanjutnya pada modifikasi histon mengarah pada identifikasi modifikasi kovalen yang tidak terduga dari protein histon oleh ikatan antara rantai samping lisin histon dan residu glisin terminal-C dari ubiquitin, protein yang tidak memiliki fungsi yang diketahui.[8] Kemudian ditemukan bahwa protein yang sebelumnya diidentifikasi terkait dengan degradasi proteolitik, yang dikenal sebagai ATP-dependent proteolysis factor 1 (APF-1), adalah protein yang sama dengan ubiquitin.[9] Aktivitas proteolitik sistem ini diisolasi sebagai kompleks multi-protein yang awalnya disebut kompleks proteinase multikatalitik oleh Sherwin Wilk dan Marion Orlowski.[10] Kemudian, kompleks proteolitik yang bergantung pada ATP yang bertanggung jawab untuk degradasi protein yang bergantung pada ubiquitin ditemukan dan disebut proteasom 26S.[11][12]
Struktur dan organisasi
Partikel inti 20S
Partikel pengatur 19S
Perubahan konformasi dari 19S
Regulasi 20S oleh 19S
Partikel pengatur lainnya
Perakitan
Proses degradasi protein
Ubikitinasi dan penargetan
Pembukaan dan translokasi
Proteolisis
Degradasi tidak tergantung ubiquitin
Meskipun sebagian besar substrat proteasomal harus ada di-ubiquitinasi sebelum didegradasi, ada beberapa pengecualian untuk aturan umum ini, terutama ketika proteasom memainkan peran normal dalam pemrosesan protein pasca-translasi. Aktivasi proteasomal NF-kB dengan memproses p105 menjadi p50 melalui proteolisis internal merupakan salah satu contoh utama.[13] Beberapa protein yang dihipotesiskan menjadi tidak stabil karena daerah yang tidak terstruktur secara intrinsik,[14] terdegradasi secara tidak bergantung ubiquitin. Contoh paling terkenal dari substrat proteasom yang tidak bergantung pada ubiquitin yaitu enzim ornitin dekarboksilase.[15] Mekanisme tidak bergantung ubiquitin yang menargetkan regulator siklus sel utama seperti p53 juga telah dilaporkan, meskipun p53 juga sasaran pada degradasi yang bergantung pada ubiquitin.[16] Akhirnya, protein yang secara struktural abnormal, salah lipatan, atau sangat teroksidasi juga sasaran pada degradasi tidak bergantung ubiquitin dan tidak bergantung 19S dalam kondisi stres seluler.[17]
Evolusi
Proteasom 20S ada di mana-mana dan penting dalam eukariota dan arkaea. Ordo bakteri Actinomycetales, juga berbagi homolog dari proteasom 20S, sedangkan sebagian besar bakteri memiliki gen kejutan panas hslV dan hslU, yang produk gennya adalah protease multimerik yang tersusun dalam cincin dua lapis dan ATPase.[18] Protein hslV telah dihipotesiskan menyerupai nenek moyang proteasom 20S.[19] Secara umum, HslV tidak esensial pada bakteri, dan tidak semua bakteri memilikinya, sedangkan beberapa protista memiliki sistem 20S dan hslV.[18] Banyak bakteri juga memiliki homolog lain dari proteasom dan ATPase terkait, terutama ClpP dan ClpX. Redundansi ini menjelaskan mengapa sistem HslUV tidak penting.
Analisis urutan menunjukkan bahwa subunit katalitik menyimpang lebih awal dalam evolusi daripada subunit yang dominan struktural. Pada bakteri yang mengekspresikan proteasom 20S, subunit memiliki identitas urutan yang tinggi terhadap subunit arkea dan eukariotik, sedangkan identitas urutan jauh lebih rendah. Adanya proteasom 20S pada bakteri dapat berasal dari transfer gen horizontal, sedangkan diversifikasi subunit di antara eukariota dianggap berasal dari beberapa peristiwa duplikasi gen.[20]
Peran pada proses seluler
Kontrol siklus sel
Progresi siklus sel dikendalikan oleh aksi berurutan dari cyclin-dependent kinase (CDK), diaktifkan oleh siklin spesifik yang membatasi fase-fase siklus sel. Siklin mitosis, yang bertahan di dalam sel hanya beberapa menit, memiliki salah satu rentang hidup terpendek dari semua protein intraseluler. Setelah kompleks CDK-siklin menjalankan fungsinya, siklin tersebut dipoliubiquitinasi dan dihancurkan oleh proteasom, yang memberikan arah untuk siklus sel. Secara khusus, keluar dari mitosis membutuhkan disosiasi tergatung proteasom dari komponen regulasi siklin B dari kompleks faktor pemicu mitosis.[21] Dalam sel vertebrata, "pelinciran" melalui pos pemeriksaan mitosis yang mengarah ke fase keluar M prematur dapat terjadi meskipun penundaan keluar ini oleh pos pemeriksaan gelendong.[22]
Pos pemeriksaan siklus sel sebelumnya seperti pemeriksaan titik pasca-pembatasan antara fase G1 dan fase S juga melibatkan degradasi proteasomal dari cyclin A, yang ubiquitinasinya dipromosikan oleh kompleks pemacu anafase (APC), sebuah ligase ubiquitin E3.[23] APC dan kompleks protein Skp1/Cul1/F-box (kompleks SCF) adalah dua pengatur utama degradasi cyclin dan kontrol pos pemeriksaan; SCF sendiri diatur oleh APC melalui ubiquitinasi protein adaptor, Skp2, yang mencegah aktivitas SCF sebelum transisi G1-S.[24]
Komponen individu dari partikel 19S memiliki peran pengaturannya sendiri. Gankyrin, oncoprotein yang baru-baru ini diidentifikasi, merupakan salah satu subkomponen 19S yang juga mengikat erat CDK4 kinase yang bergantung pada siklin dan memainkan peran kunci dalam mengenali p53 yang ada di mana-mana, melalui afinitasnya terhadap ubiquitin ligase MDM2. Gankyrin bersifat anti-apoptosis dan telah terbukti diekspresikan secara berlebihan pada beberapa jenis sel tumor seperti karsinoma hepatoseluler.[25]
Seperti eukariota, beberapa archaea juga menggunakan proteasom untuk mengontrol siklus sel, khususnya dengan mengontrol pembelahan sel yang dimediasi ESCRT-III.[26]
Apoptosis
Baik sinyal internal maupun eksternal dapat menyebabkan induksi apoptosis, atau kematian sel terprogram. Dekonstruksi komponen seluler yang dihasilkan terutama dilakukan oleh protease khusus yang dikenal sebagai caspase, tetapi proteasom juga memainkan peran penting dan beragam dalam proses apoptosis. Keterlibatan proteasom dalam proses ini ditunjukkan oleh peningkatan ubiquitinasi protein, dan enzim E1, E2, dan E3 yang diamati jauh sebelum apoptosis.[27][28][29] Selama apoptosis, proteasom yang terlokalisasi pada nukleus juga telah diamati bertranslokasi ke blebs membran luar yang merupakan karakteristik dari apoptosis.[30]
Penghambatan proteasom memiliki efek yang berbeda pada induksi apoptosis pada jenis sel yang berbeda. Secara umum, proteasom tidak diperlukan untuk apoptosis, meskipun menghambatnya pro-apoptosis di sebagian besar jenis sel yang telah dipelajari. Apoptosis dimediasi melalui gangguan degradasi diatur protein siklus sel pro-pertumbuhan. Namun, beberapa sel - khususnya, kultur primer sel fase G0 dan berdiferensiasi seperti timosit dan neuron - dicegah dari menjalani apoptosis pada paparan inhibitor proteasom. Mekanisme untuk efek ini tidak jelas, tetapi dihipotesiskan spesifik untuk sel dalam keadaan fase G0, atau sebagai hasil dari aktivitas diferensial JNK pro-apoptosis kinase.[31] Kemampuan inhibitor proteasom untuk menginduksi apoptosis pada sel yang membelah dengan cepat telah dimanfaatkan dalam beberapa agen kemoterapi yang dikembangkan baru-baru ini seperti bortezomib dan salinosporamide A.
Respons pada stres seluler
Sebagai respons terhadap tekanan seluler – seperti infeksi, sengatan panas, atau kerusakan oksidatif –diekspresikan protein kejutan panas yang mengidentifikasi protein yang salah lipatan atau tidak dilipat dan menargetkannya untuk degradasi proteasomal. Baik Hsp27 dan Hsp90 — protein pendamping telah terlibat dalam meningkatkan aktivitas sistem ubiquitin-proteasom, meskipun mereka bukan peserta langsung dalam proses tersebut.[32] Hsp70, di sisi lain, mengikat tambalan hidrofobik yang terbuka pada permukaan protein yang salah lipatan dan merekrut ligase ubiquitin E3 seperti CHIP untuk menandai protein untuk degradasi proteasomal.[33] Protein CHIP (carboxyl terminus dari protein yang berinteraksi dengan Hsp70) sendiri diatur melalui penghambatan interaksi antara enzim E3 CHIP dan mitra pengikatan E2-nya.[34]
Mekanisme serupa ada untuk mempromosikan degradasi protein yang rusak secara oksidatif melalui sistem proteasom. Secara khusus, proteasom yang terlokalisasi pada nukleus diatur oleh PARP dan secara aktif menurunkan histon yang teroksidasi secara tidak tepat.[35] Protein teroksidasi, yang sering membentuk agregat amorf besar di dalam sel, dapat didegradasi langsung oleh partikel inti 20S tanpa tutup pengatur 19S dan tidak memerlukan hidrolisis ATP atau penandaan dengan ubiquitin.[36] Namun, tingkat kerusakan oksidatif yang tinggi meningkatkan tingkat ikatan silang antara fragmen protein, membuat agregat tahan terhadap proteolisis. Jumlah dan ukuran yang lebih besar dari agregat yang sangat teroksidasi tersebut berhubungan dengan penuaan.[37]
Disregulasi sistem proteasom ubiquitin dapat berkontribusi pada beberapa penyakit saraf. Ini dapat menyebabkan tumor otak seperti astrositoma.[38] Pada beberapa penyakit neurodegeneratif awitan lambat yang berbagi agregasi protein yang gagal melipat sebagai fitur umum, seperti penyakit Parkinson dan penyakit Alzheimer, agregat besar protein yang gagal melipat dapat terbentuk dan kemudian mengakibatkan neurotoksisitas, melalui mekanisme yang belum dipahami dengan baik. Penurunan aktivitas proteasom telah disarankan sebagai penyebab agregasi dan pembentukan badan Lewy pada Parkinson.[39] Hipotesis ini didukung oleh pengamatan bahwa model ragi Parkinson lebih rentan terhadap toksisitas dari α-synuclein, komponen protein utama badan Lewy, dalam kondisi aktivitas proteasom rendah.[40] Gangguan aktivitas proteasomal dapat mendasari gangguan kognitif seperti gangguan spektrum autisme, dan penyakit otot dan saraf seperti inklusi miopati tubuh.[38]
Peran pada sistem imun
Proteasom memainkan peran langsung tetapi penting dalam fungsi sistem imun adaptif. Antigen peptida ditampilkan oleh protein kompleks histokompatibilitas utama (MHC) kelas I pada permukaan sel penyaji antigen. Peptida ini adalah produk degradasi protein proteasomal yang berasal dari patogen yang menyerang. Meskipun proteasom yang diekspresikan secara konstitutif dapat berpartisipasi dalam proses ini, kompleks khusus yang terdiri dari protein, yang ekspresinya diinduksi oleh interferon gamma, merupakan produsen utama peptida yang optimal dalam ukuran dan komposisi untuk pengikatan MHC. Protein ini yang ekspresinya meningkat selama respons imun termasuk partikel pengatur 11S, yang peran biologis utamanya adalah mengatur produksi ligan MHC, dan subunit khusus yang disebut β1i, β2i, dan β5i dengan spesifisitas substrat yang berubah. Kompleks yang dibentuk dengan subunit β khusus dikenal sebagai imunoproteasom.[41] Subunit varian β5i lainnya, β5t, diekspresikan dalam timus, yang mengarah ke "thymoproteasome" spesifik-timus yang fungsinya masih belum jelas.[42]
Kekuatan ikatan ligan MHC kelas I tergantung pada komposisi ligan C-terminus, karena peptida terikat oleh ikatan hidrogen dan dengan kontak dekat dengan daerah yang disebut "kantong B" pada permukaan MHC. Banyak alel MHC kelas I lebih menyukai residu terminal-C hidrofobik, dan kompleks imunoproteasom lebih cenderung menghasilkan terminal-C hidrofobik.[43]
Karena perannya dalam menghasilkan bentuk aktif NF-kB, pengatur ekspresi sitokin anti-apoptosis dan proinflamasi, aktivitas proteasomal telah dikaitkan dengan penyakit inflamasi dan autoimun. Peningkatan tingkat aktivitas proteasome berkorelasi dengan aktivitas penyakit dan telah terlibat dalam penyakit autoimun termasuk lupus eritematosus sistemik dan rheumatoid arthritis.[44]
Proteasom juga terlibat dalam proteolisis yang dimediasi antibodi intraseluler dari virion yang terikat antibodi. Dalam jalur netralisasi ini, TRIM21 (protein dari keluarga motif tripartit) berikatan dengan imunoglobulin G untuk mengarahkan virion ke proteasom di mana ia terdegradasi.[45]
Peran pada penyakit
Proteasom dan subunitnya memiliki signifikansi klinis karena perakitan kompleks yang dikompromikan atau proteasom disfungsional dapat dikaitkan dengan patofisiologi yang mendasari penyakit tertentu, dan proteasom dapat dimanfaatkan sebagai target obat untuk terapi. Baru-baru ini, juga banyak upaya telah dilakukan untuk mempertimbangkan proteasom untuk pengembangan penanda dan strategi diagnostik baru.
Proteasom membentuk komponen penting untuk sistem ubiquitin-proteasom (UPS)[46] dan kontrol kualitas protein seluler (protein quality control, PQC) yang sesuai. Ubiquitinasi protein dan proteolisis dan degradasi selanjutnya oleh proteasom merupakan mekanisme penting dalam regulasi siklus sel, pertumbuhan dan diferensiasi sel, transkripsi gen, transduksi sinyal dan apoptosis.[47] Selanjutnya, perakitan dan fungsi kompleks proteasom yang dikompromikan menyebabkan berkurangnya aktivitas proteolitik dan akumulasi spesies protein yang rusak atau salah lipat. Akumulasi protein tersebut dapat berkontribusi pada patogenesis dan karakteristik fenotipik pada penyakit neurodegeneratif,[48][49] penyakit kardiovaskular,[50][51] respons inflamasi dan penyakit autoimun,[52] dan respons kerusakan DNA sistemik yang mengarah pada keganasan.[53]
Beberapa penelitian eksperimental dan klinis telah menunjukkan bahwa penyimpangan dan deregulasi UPS berkontribusi pada patogenesis beberapa gangguan neurodegeneratif dan myodegeneratif, termasuk penyakit Alzheimer,[54] penyakit Parkinson[55] dan penyakit Pick,[56] amyotrophic lateral sclerosis (ALS),[57] penyakit Huntington,[58] penyakit Creutzfeldt-Jakob,[59] dan penyakit neuron motorik, penyakit poliglutamin (PolyQ), distrofi otot,[60] dan beberapa bentuk penyakit neurodegeneratif yang jarang terkait dengan demensia.[61]
Sebagai bagian dari sistem ubiquitin-proteasom (UPS), proteasom mempertahankan homeostasis protein jantung dan dengan demikian memainkan peran penting dalam cedera iskemik jantung,[62] hipertrofi ventrikel,[63] dan gagal jantung.[64]
Selain itu, bukti terakumulasi bahwa UPS memainkan peran penting dalam transformasi keganasan. Proteolisis UPS memainkan peran utama dalam respons sel kanker terhadap sinyal stimulasi yang sangat penting untuk perkembangan kanker. Oleh karena itu, ekspresi gen melalui degradasi faktor transkripsi, seperti p53, c-jun, c-Fos, NF-κB, c-Myc, HIF-1α, MATα2, STAT3, protein pengikat elemen yang diatur sterol dan reseptor androgen semuanya dikendalikan oleh UPS dan dengan demikian terlibat dalam perkembangan berbagai keganasan.[65] Selain itu, UPS mengatur degradasi produk gen supresor tumor seperti adenomatous polyposis coli (APC) pada kanker kolorektal, retinoblastoma (Rb), dan penekan tumor von Hippel–Lindau (VHL), serta sejumlah proto-onkogen (Raf, Myc, Myb, Rel, Src, Mos, ABL). UPS juga terlibat dalam regulasi respon inflamasi. Aktivitas ini biasanya dikaitkan dengan peran proteasom dalam aktivasi NF-κB yang selanjutnya mengatur ekspresi sitokin pro-inflamasi seperti TNF-α, IL-β, IL-8, molekul adhesi (ICAM-1, VCAM-1, P-selectin) dan prostaglandin dan oksida nitrat (NO).[66] Selain itu, UPS juga berperan dalam respons inflamasi sebagai pengatur proliferasi leukosit, terutama melalui proteolisis siklin dan degradasi inhibitor CDK.[67] Terakhir, pasien penyakit autoimun dengan SLE, sindrom Sjögren dan rheumatoid arthritis (RA) secara dominan menunjukkan proteasom yang bersirkulasi yang dapat diterapkan sebagai biomarker klinis.[68]
Inhibitor proteasom
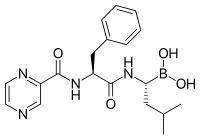
Inhibitor proteasom memiliki aktivitas anti-tumor yang efektif dalam kultur sel yaitu menginduksi apoptosis dengan mengganggu degradasi yang diatur dari protein siklus sel pro-pertumbuhan. Pendekatan selektif menginduksi apoptosis dalam sel tumor telah terbukti efektif dalam model hewan dan percobaan manusia.
Laktasistin, suatu produk alami yang disintesis oleh bakteri Streptomyces, merupakan inhibitor proteasom non-peptida pertama yang ditemukan[69] dan digunakan secara luas sebagai bahan penelitian dalam biokimia dan biologi sel. Laktasistin secara kovalen memodifikasi treonin terminal amino dari subunit katalitik dari proteasom, khususnya subunit 5 yang bertanggung jawab atas aktivitas mirip kimotripsin proteasom. Penemuan ini membantu menetapkan proteasom sebagai kelas protease baru yang mekanistik: protease treonin terminal amino.
Bortezomib (Boronated MG132), sebuah molekul yang dipasarkan sebagai Velcade, adalah inhibitor proteasom pertama yang dalam penggunaan klinis sebagai agen kemoterapi. Bortezomib digunakan dalam pengobatan multiple myeloma.[70] Khususnya, multiple myeloma telah diamati menghasilkan peningkatan kadar peptida turunan proteasom dalam serum darah yang menurun ke tingkat normal sebagai respons terhadap kemoterapi yang berhasil.[71] Penelitian pada hewan telah menunjukkan bahwa bortezomib mungkin juga memiliki efek klinis yang signifikan pada kanker pankreas.[72][73] Penelitian pra-klinis dan klinis awal telah dimulai untuk menguji efektivitas bortezomib dalam mengobati kanker terkait sel B lainnya,[74] khususnya beberapa jenis limfoma non-Hodgkin.[75] Hasil klinis juga tampaknya membenarkan penggunaan inhibitor proteasom yang dikombinasikan dengan kemoterapi, untuk leukemia limfoblastik akut sel B.[76] Inhibitor proteasom dapat membunuh beberapa jenis sel leukemia yang resisten terhadap glukokortikoid.[77]
Ritonavir dikembangkan sebagai inhibitor protease dan digunakan untuk menargetkan infeksi HIV. Namun, telah terbukti menghambat proteasom serta protease bebas; secara spesifik, aktivitas proteasom yang mirip kimotripsin dihambat oleh ritonavir, sedangkan aktivitas mirip tripsin agak meningkat.[78] Studi pada model hewan menunjukkan bahwa ritonavir mungkin memiliki efek penghambatan pada pertumbuhan sel glioma.[79]
Inhibitor proteasom juga menjanjikan dalam mengobati penyakit autoimun pada model hewan. Misalnya, penelitian pada tikus yang membawa cangkok kulit manusia menemukan pengurangan ukuran lesi dari psoriasis setelah pengobatan dengan inhibitor proteasom.[80] Inhibitor juga menunjukkan efek positif pada model asma tikus.[81]
Referensi
- ^ Molecular cell biology. Harvey F. Lodish, Arnold Berk, Chris Kaiser, Monty Krieger, Matthew P. Scott, Anthony Bretscher (edisi ke-6th ed). New York: W.H. Freeman. 2008. ISBN 0-7167-4366-3. OCLC 83758878.
- ^ Peters, J. M.; Franke, W. W.; Kleinschmidt, J. A. (1994-03-11). "Distinct 19 S and 20 S subcomplexes of the 26 S proteasome and their distribution in the nucleus and the cytoplasm". The Journal of Biological Chemistry. 269 (10): 7709–7718. ISSN 0021-9258. PMID 8125997.
- ^ Nassif, Nicholas D.; Cambray, Samantha E.; Kraut, Daniel A. (2014-05). "Slipping up: partial substrate degradation by ATP-dependent proteases". IUBMB life. 66 (5): 309–317. doi:10.1002/iub.1271. ISSN 1521-6551. PMID 24823973.
- ^ "The Nobel Prize in Chemistry 2004". NobelPrize.org (dalam bahasa Inggris). Diakses tanggal 2022-02-18.
- ^ Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J (2004). "3". Molecular cell biology (edisi ke-5th). New York: W.H. Freeman and CO. hlm. 66–72. ISBN 978-0-7167-4366-8.
- ^ Etlinger JD, Goldberg AL (January 1977). "A soluble ATP-dependent proteolytic system responsible for the degradation of abnormal proteins in reticulocytes". Proceedings of the National Academy of Sciences of the United States of America. 74 (1): 54–8. Bibcode:1977PNAS...74...54E. doi:10.1073/pnas.74.1.54. PMC 393195
 . PMID 264694.
. PMID 264694.
- ^ Ciehanover A, Hod Y, Hershko A (April 1978). "A heat-stable polypeptide component of an ATP-dependent proteolytic system from reticulocytes". Biochemical and Biophysical Research Communications. 81 (4): 1100–5. doi:10.1016/0006-291X(78)91249-4. PMID 666810.
- ^ Goldknopf IL, Busch H (March 1977). "Isopeptide linkage between nonhistone and histone 2A polypeptides of chromosomal conjugate-protein A24". Proceedings of the National Academy of Sciences of the United States of America. 74 (3): 864–8. Bibcode:1977PNAS...74..864G. doi:10.1073/pnas.74.3.864. PMC 430507
 . PMID 265581.
. PMID 265581.
- ^ Ciechanover A (September 2005). "Early work on the ubiquitin proteasome system, an interview with Aaron Ciechanover. Interview by CDD". Cell Death and Differentiation. 12 (9): 1167–77. doi:10.1038/sj.cdd.4401691. PMID 16094393.
- ^ Wilk S, Orlowski M (November 1980). "Cation-sensitive neutral endopeptidase: isolation and specificity of the bovine pituitary enzyme". Journal of Neurochemistry. 35 (5): 1172–82. doi:10.1111/j.1471-4159.1980.tb07873.x. PMID 6778972.
- ^ Arrigo AP, Tanaka, K, Goldberg F, Welch WJ (1988). "Identity of 19S prosome particle with the large multifunctional protease complex of mammalian cells". Nature. 331 (6152): 192–94. doi:10.1038/331192a0. PMID 3277060.Tanaka K, Waxman L, Goldberg AL (June 1983). "ATP serves two distinct roles in protein degradation in reticulocytes, one requiring and one independent of ubiquitin". The Journal of Cell Biology. 96 (6): 1580–5. doi:10.1083/jcb.96.6.1580. PMC 2112434
 . PMID 6304111.
. PMID 6304111.
- ^ Hough R, Pratt G, Rechsteiner M (June 1987). "Purification of two high molecular weight proteases from rabbit reticulocyte lysate". The Journal of Biological Chemistry. 262 (17): 8303–13. doi:10.1016/S0021-9258(18)47564-3. PMID 3298229.
- ^ Rape M, Jentsch S (May 2002). "Taking a bite: proteasomal protein processing". Nature Cell Biology. 4 (5): E113–6. doi:10.1038/ncb0502-e113. PMID 11988749.
- ^ Asher G, Reuven N, Shaul Y (August 2006). "20S proteasomes and protein degradation "by default"". BioEssays. 28 (8): 844–9. doi:10.1002/bies.20447. PMID 16927316.
- ^ Zhang M, Pickart CM, Coffino P (April 2003). "Determinants of proteasome recognition of ornithine decarboxylase, a ubiquitin-independent substrate". The EMBO Journal. 22 (7): 1488–96. doi:10.1093/emboj/cdg158. PMC 152902
 . PMID 12660156.
. PMID 12660156.
- ^ Asher G, Shaul Y (August 2005). "p53 proteasomal degradation: poly-ubiquitination is not the whole story". Cell Cycle. 4 (8): 1015–8. doi:10.4161/cc.4.8.1900. PMID 16082197.
- ^ Shringarpure R, Grune T, Mehlhase J, Davies KJ (January 2003). "Ubiquitin conjugation is not required for the degradation of oxidized proteins by proteasome". The Journal of Biological Chemistry. 278 (1): 311–8. doi:10.1074/jbc.M206279200. PMID 12401807.
- ^ a b Gille C, Goede A, Schlöetelburg C, Preissner R, Kloetzel PM, Göbel UB, Frömmel C (March 2003). "A comprehensive view on proteasomal sequences: implications for the evolution of the proteasome". Journal of Molecular Biology. 326 (5): 1437–48. doi:10.1016/S0022-2836(02)01470-5. PMID 12595256.
- ^ Bochtler M, Ditzel L, Groll M, Hartmann C, Huber R (1999). "The proteasome". Annual Review of Biophysics and Biomolecular Structure. 28 (1): 295–317. doi:10.1146/annurev.biophys.28.1.295. PMID 10410804.
- ^ Gille C, Goede A, Schlöetelburg C, Preissner R, Kloetzel PM, Göbel UB, Frömmel C (March 2003). "A comprehensive view on proteasomal sequences: implications for the evolution of the proteasome". Journal of Molecular Biology. 326 (5): 1437–48. doi:10.1016/S0022-2836(02)01470-5. PMID 12595256.
- ^ Chesnel, Franck; Bazile, Franck; Pascal, Aude; Kubiak, Jacek Z. (2006-08). "Cyclin B dissociation from CDK1 precedes its degradation upon MPF inactivation in mitotic extracts of Xenopus laevis embryos". Cell Cycle (Georgetown, Tex.). 5 (15): 1687–1698. doi:10.4161/cc.5.15.3123. ISSN 1551-4005. PMID 16921258.
- ^ Brito, Daniela A.; Rieder, Conly L. (2006-06-20). "Mitotic checkpoint slippage in humans occurs via cyclin B destruction in the presence of an active checkpoint". Current biology: CB. 16 (12): 1194–1200. doi:10.1016/j.cub.2006.04.043. ISSN 0960-9822. PMC 2749311
 . PMID 16782009.
. PMID 16782009.
- ^ Havens, Courtney G.; Ho, Alan; Yoshioka, Naohisa; Dowdy, Steven F. (2006-06). "Regulation of late G1/S phase transition and APC Cdh1 by reactive oxygen species". Molecular and Cellular Biology. 26 (12): 4701–4711. doi:10.1128/MCB.00303-06. ISSN 0270-7306. PMC 1489138
 . PMID 16738333.
. PMID 16738333.
- ^ Bashir, Tarig; Dorrello, N. Valerio; Amador, Virginia; Guardavaccaro, Daniele; Pagano, Michele (2004-03-11). "Control of the SCF(Skp2-Cks1) ubiquitin ligase by the APC/C(Cdh1) ubiquitin ligase". Nature. 428 (6979): 190–193. doi:10.1038/nature02330. ISSN 1476-4687. PMID 15014502.
- ^ Higashitsuji, Hiroaki; Liu, Yu; Mayer, R. John; Fujita, Jun (2005-10). "The oncoprotein gankyrin negatively regulates both p53 and RB by enhancing proteasomal degradation". Cell Cycle (Georgetown, Tex.). 4 (10): 1335–1337. doi:10.4161/cc.4.10.2107. ISSN 1551-4005. PMID 16177571.
- ^ Tarrason Risa, Gabriel; Hurtig, Fredrik; Bray, Sian; Hafner, Anne E.; Harker-Kirschneck, Lena; Faull, Peter; Davis, Colin; Papatziamou, Dimitra; Mutavchiev, Delyan R. (2020-08-07). "The proteasome controls ESCRT-III-mediated cell division in an archaeon". Science (New York, N.Y.). 369 (6504): eaaz2532. doi:10.1126/science.aaz2532. ISSN 1095-9203. PMC 7116001
 . PMID 32764038.
. PMID 32764038.
- ^ Haas, A. L.; Baboshina, O.; Williams, B.; Schwartz, L. M. (1995-04-21). "Coordinated induction of the ubiquitin conjugation pathway accompanies the developmentally programmed death of insect skeletal muscle". The Journal of Biological Chemistry. 270 (16): 9407–9412. doi:10.1074/jbc.270.16.9407. ISSN 0021-9258. PMID 7721865.
- ^ Schwartz, L. M.; Myer, A.; Kosz, L.; Engelstein, M.; Maier, C. (1990-10). "Activation of polyubiquitin gene expression during developmentally programmed cell death". Neuron. 5 (4): 411–419. doi:10.1016/0896-6273(90)90080-y. ISSN 0896-6273. PMID 2169771.
- ^ Löw, P.; Bussell, K.; Dawson, S. P.; Billett, M. A.; Mayer, R. J.; Reynolds, S. E. (1997-01-06). "Expression of a 26S proteasome ATPase subunit, MS73, in muscles that undergo developmentally programmed cell death, and its control by ecdysteroid hormones in the insect Manduca sexta". FEBS letters. 400 (3): 345–349. doi:10.1016/s0014-5793(96)01413-5. ISSN 0014-5793. PMID 9009228.
- ^ Pitzer, F.; Dantes, A.; Fuchs, T.; Baumeister, W.; Amsterdam, A. (1996-09-23). "Removal of proteasomes from the nucleus and their accumulation in apoptotic blebs during programmed cell death". FEBS letters. 394 (1): 47–50. doi:10.1016/0014-5793(96)00920-9. ISSN 0014-5793. PMID 8925925.
- ^ Orlowski, R. Z. (1999-04). "The role of the ubiquitin-proteasome pathway in apoptosis". Cell Death and Differentiation. 6 (4): 303–313. doi:10.1038/sj.cdd.4400505. ISSN 1350-9047. PMID 10381632.
- ^ Garrido C, Brunet M, Didelot C, Zermati Y, Schmitt E, Kroemer G (November 2006). "Heat shock proteins 27 and 70: anti-apoptotic proteins with tumorigenic properties". Cell Cycle. 5 (22): 2592–601. doi:10.4161/cc.5.22.3448. PMID 17106261.
- ^ Park SH, Bolender N, Eisele F, Kostova Z, Takeuchi J, Coffino P, Wolf DH (January 2007). "The cytoplasmic Hsp70 chaperone machinery subjects misfolded and endoplasmic reticulum import-incompetent proteins to degradation via the ubiquitin-proteasome system". Molecular Biology of the Cell. 18 (1): 153–65. doi:10.1091/mbc.E06-04-0338. PMC 1751312
 . PMID 17065559.
. PMID 17065559.
- ^ Dai Q, Qian SB, Li HH, McDonough H, Borchers C, Huang D, Takayama S, Younger JM, Ren HY, Cyr DM, Patterson C (November 2005). "Regulation of the cytoplasmic quality control protein degradation pathway by BAG2". The Journal of Biological Chemistry. 280 (46): 38673–81. doi:10.1074/jbc.M507986200. PMID 16169850.
- ^ Bader N, Grune T (2006). "Protein oxidation and proteolysis". Biological Chemistry. 387 (10–11): 1351–5. doi:10.1515/BC.2006.169. PMID 17081106.
- ^ Shringarpure R, Grune T, Mehlhase J, Davies KJ (January 2003). "Ubiquitin conjugation is not required for the degradation of oxidized proteins by proteasome". The Journal of Biological Chemistry. 278 (1): 311–8. doi:10.1074/jbc.M206279200. PMID 12401807.
- ^ Davies KJ (2003). "Degradation of oxidized proteins by the 20S proteasome". Biochimie. 83 (3–4): 301–10. doi:10.1016/S0300-9084(01)01250-0. PMID 11295490.
- ^ a b Lehman NL (September 2009). "The ubiquitin proteasome system in neuropathology". Acta Neuropathologica. 118 (3): 329–47. doi:10.1007/s00401-009-0560-x. PMC 2716447
 . PMID 19597829.
. PMID 19597829.
- ^ McNaught KS, Jackson T, JnoBaptiste R, Kapustin A, Olanow CW (May 2006). "Proteasomal dysfunction in sporadic Parkinson's disease". Neurology. 66 (10 Suppl 4): S37–49. doi:10.1212/01.wnl.0000221745.58886.2e. PMID 16717251.
- ^ Sharma N, Brandis KA, Herrera SK, Johnson BE, Vaidya T, Shrestha R, Debburman SK (2006). "alpha-Synuclein budding yeast model: toxicity enhanced by impaired proteasome and oxidative stress". Journal of Molecular Neuroscience. 28 (2): 161–78. doi:10.1385/JMN:28:2:161. PMID 16679556.
- ^ Wang J, Maldonado MA (August 2006). "The ubiquitin-proteasome system and its role in inflammatory and autoimmune diseases". Cellular & Molecular Immunology. 3 (4): 255–61. PMID 16978533.
- ^ Murata S, Sasaki K, Kishimoto T, Niwa S, Hayashi H, Takahama Y, Tanaka K (June 2007). "Regulation of CD8+ T cell development by thymus-specific proteasomes". Science. 316 (5829): 1349–53. Bibcode:2007Sci...316.1349M. doi:10.1126/science.1141915. PMID 17540904.
- ^ Cascio P, Hilton C, Kisselev AF, Rock KL, Goldberg AL (May 2001). "26S proteasomes and immunoproteasomes produce mainly N-extended versions of an antigenic peptide". The EMBO Journal. 20 (10): 2357–66. doi:10.1093/emboj/20.10.2357. PMC 125470
 . PMID 11350924.
. PMID 11350924.
- ^ Wang J, Maldonado MA (August 2006). "The ubiquitin-proteasome system and its role in inflammatory and autoimmune diseases". Cellular & Molecular Immunology. 3 (4): 255–61. PMID 16978533.
- ^ Mallery DL, McEwan WA, Bidgood SR, Towers GJ, Johnson CM, James LC (November 2010). "Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21)". Proceedings of the National Academy of Sciences of the United States of America. 107 (46): 19985–19990. Bibcode:2010PNAS..10719985M. doi:10.1073/pnas.1014074107. PMC 2993423
 . PMID 21045130.
. PMID 21045130.
- ^ Kleiger, Gary; Mayor, Thibault (2014-06). "Perilous journey: a tour of the ubiquitin-proteasome system". Trends in Cell Biology. 24 (6): 352–359. doi:10.1016/j.tcb.2013.12.003. ISSN 1879-3088. PMC 4037451
 . PMID 24457024.
. PMID 24457024.
- ^ Goldberg, A. L.; Stein, R.; Adams, J. (1995-08). "New insights into proteasome function: from archaebacteria to drug development". Chemistry & Biology. 2 (8): 503–508. doi:10.1016/1074-5521(95)90182-5. ISSN 1074-5521. PMID 9383453.
- ^ Sulistio, Yanuar Alan; Heese, Klaus (2016-03). "The Ubiquitin-Proteasome System and Molecular Chaperone Deregulation in Alzheimer's Disease". Molecular Neurobiology. 53 (2): 905–931. doi:10.1007/s12035-014-9063-4. ISSN 1559-1182. PMID 25561438.
- ^ Ortega, Zaira; Lucas, Jose J. (2014). "Ubiquitin-proteasome system involvement in Huntington's disease". Frontiers in Molecular Neuroscience. 7: 77. doi:10.3389/fnmol.2014.00077. ISSN 1662-5099. PMC 4179678
 . PMID 25324717.
. PMID 25324717.
- ^ Sandri, Marco; Robbins, Jeffrey (2014-06). "Proteotoxicity: an underappreciated pathology in cardiac disease". Journal of Molecular and Cellular Cardiology. 71: 3–10. doi:10.1016/j.yjmcc.2013.12.015. ISSN 1095-8584. PMC 4011959
 . PMID 24380730.
. PMID 24380730.
- ^ Wang, Zhao V.; Hill, Joseph A. (2015-02-03). "Protein quality control and metabolism: bidirectional control in the heart". Cell Metabolism. 21 (2): 215–226. doi:10.1016/j.cmet.2015.01.016. ISSN 1932-7420. PMC 4317573
 . PMID 25651176.
. PMID 25651176.
- ^ Karin, M.; Delhase, M. (2000-02). "The I kappa B kinase (IKK) and NF-kappa B: key elements of proinflammatory signalling". Seminars in Immunology. 12 (1): 85–98. doi:10.1006/smim.2000.0210. ISSN 1044-5323. PMID 10723801.
- ^ Ermolaeva, Maria A.; Dakhovnik, Alexander; Schumacher, Björn (2015-09). "Quality control mechanisms in cellular and systemic DNA damage responses". Ageing Research Reviews. 23 (Pt A): 3–11. doi:10.1016/j.arr.2014.12.009. ISSN 1872-9649. PMC 4886828
 . PMID 25560147.
. PMID 25560147.
- ^ Checler, F.; da Costa, C. A.; Ancolio, K.; Chevallier, N.; Lopez-Perez, E.; Marambaud, P. (2000-07-26). "Role of the proteasome in Alzheimer's disease". Biochimica Et Biophysica Acta. 1502 (1): 133–138. doi:10.1016/s0925-4439(00)00039-9. ISSN 0006-3002. PMID 10899438.
- ^ Chung, K. K.; Dawson, V. L.; Dawson, T. M. (2001-11). "The role of the ubiquitin-proteasomal pathway in Parkinson's disease and other neurodegenerative disorders". Trends in Neurosciences. 24 (11 Suppl): S7–14. doi:10.1016/s0166-2236(00)01998-6. ISSN 0166-2236. PMID 11881748.
- ^ Ikeda, Kenji; Akiyama, Haruhiko; Arai, Tetsuaki; Ueno, Hideki; Tsuchiya, Kuniaki; Kosaka, Kenji (2002-07). "Morphometrical reappraisal of motor neuron system of Pick's disease and amyotrophic lateral sclerosis with dementia". Acta Neuropathologica. 104 (1): 21–28. doi:10.1007/s00401-001-0513-5. ISSN 0001-6322. PMID 12070660.
- ^ Ikeda, Kenji; Akiyama, Haruhiko; Arai, Tetsuaki; Ueno, Hideki; Tsuchiya, Kuniaki; Kosaka, Kenji (2002-07). "Morphometrical reappraisal of motor neuron system of Pick's disease and amyotrophic lateral sclerosis with dementia". Acta Neuropathologica. 104 (1): 21–28. doi:10.1007/s00401-001-0513-5. ISSN 0001-6322. PMID 12070660.
- ^ Chung, K. K.; Dawson, V. L.; Dawson, T. M. (2001-11). "The role of the ubiquitin-proteasomal pathway in Parkinson's disease and other neurodegenerative disorders". Trends in Neurosciences. 24 (11 Suppl): S7–14. doi:10.1016/s0166-2236(00)01998-6. ISSN 0166-2236. PMID 11881748.
- ^ Manaka, H.; Kato, T.; Kurita, K.; Katagiri, T.; Shikama, Y.; Kujirai, K.; Kawanami, T.; Suzuki, Y.; Nihei, K. (1992-05-11). "Marked increase in cerebrospinal fluid ubiquitin in Creutzfeldt-Jakob disease". Neuroscience Letters. 139 (1): 47–49. doi:10.1016/0304-3940(92)90854-z. ISSN 0304-3940. PMID 1328965.
- ^ Mathews, Katherine D.; Moore, Steven A. (2003-01). "Limb-girdle muscular dystrophy". Current Neurology and Neuroscience Reports. 3 (1): 78–85. doi:10.1007/s11910-003-0042-9. ISSN 1528-4042. PMID 12507416.
- ^ Mayer, R. John (2003-03). "From neurodegeneration to neurohomeostasis: the role of ubiquitin". Drug News & Perspectives. 16 (2): 103–108. doi:10.1358/dnp.2003.16.2.829327. ISSN 0214-0934. PMID 12792671.
- ^ Calise, Justine; Powell, Saul R. (2013-02-01). "The ubiquitin proteasome system and myocardial ischemia". American Journal of Physiology. Heart and Circulatory Physiology. 304 (3): H337–349. doi:10.1152/ajpheart.00604.2012. ISSN 1522-1539. PMC 3774499
 . PMID 23220331.
. PMID 23220331.
- ^ Predmore, Jaime M.; Wang, Ping; Davis, Frank; Bartolone, Sarah; Westfall, Margaret V.; Dyke, David B.; Pagani, Francis; Powell, Saul R.; Day, Sharlene M. (2010-03-02). "Ubiquitin proteasome dysfunction in human hypertrophic and dilated cardiomyopathies". Circulation. 121 (8): 997–1004. doi:10.1161/CIRCULATIONAHA.109.904557. ISSN 1524-4539. PMC 2857348
 . PMID 20159828.
. PMID 20159828.
- ^ Powell, Saul R. (2006-07). "The ubiquitin-proteasome system in cardiac physiology and pathology". American Journal of Physiology. Heart and Circulatory Physiology. 291 (1): H1–H19. doi:10.1152/ajpheart.00062.2006. ISSN 0363-6135. PMID 16501026.
- ^ Adams, Julian (2003-04-01). "Potential for proteasome inhibition in the treatment of cancer". Drug Discovery Today. 8 (7): 307–315. doi:10.1016/s1359-6446(03)02647-3. ISSN 1359-6446. PMID 12654543.
- ^ Karin, M.; Delhase, M. (2000-02). "The I kappa B kinase (IKK) and NF-kappa B: key elements of proinflammatory signalling". Seminars in Immunology. 12 (1): 85–98. doi:10.1006/smim.2000.0210. ISSN 1044-5323. PMID 10723801.
- ^ Ben-Neriah, Yinon (2002-01). "Regulatory functions of ubiquitination in the immune system". Nature Immunology. 3 (1): 20–26. doi:10.1038/ni0102-20. ISSN 1529-2908. PMID 11753406.
- ^ Egerer, Karl; Kuckelkorn, Ulrike; Rudolph, Paul E.; Rückert, Jens C.; Dörner, Thomas; Burmester, Gerd-R.; Kloetzel, Peter-M.; Feist, Eugen (2002-10). "Circulating proteasomes are markers of cell damage and immunologic activity in autoimmune diseases". The Journal of Rheumatology. 29 (10): 2045–2052. ISSN 0315-162X. PMID 12375310.
- ^ Fenteany, G.; Standaert, R. F.; Lane, W. S.; Choi, S.; Corey, E. J.; Schreiber, S. L. (1995-05-05). "Inhibition of proteasome activities and subunit-specific amino-terminal threonine modification by lactacystin". Science (New York, N.Y.). 268 (5211): 726–731. doi:10.1126/science.7732382. ISSN 0036-8075. PMID 7732382.
- ^ Fisher, Richard I.; Bernstein, Steven H.; Kahl, Brad S.; Djulbegovic, Benjamin; Robertson, Michael J.; de Vos, Sven; Epner, Elliot; Krishnan, Amrita; Leonard, John P. (2006-10-20). "Multicenter phase II study of bortezomib in patients with relapsed or refractory mantle cell lymphoma". Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. 24 (30): 4867–4874. doi:10.1200/JCO.2006.07.9665. ISSN 1527-7755. PMID 17001068.
- ^ Jakob, Christian; Egerer, Karl; Liebisch, Peter; Türkmen, Seval; Zavrski, Ivana; Kuckelkorn, Ulrike; Heider, Ulrike; Kaiser, Martin; Fleissner, Claudia (2007-03-01). "Circulating proteasome levels are an independent prognostic factor for survival in multiple myeloma". Blood. 109 (5): 2100–2105. doi:10.1182/blood-2006-04-016360. ISSN 0006-4971. PMID 17095627.
- ^ Shah, S. A.; Potter, M. W.; McDade, T. P.; Ricciardi, R.; Perugini, R. A.; Elliott, P. J.; Adams, J.; Callery, M. P. (2001 Apr 2-27). "26S proteasome inhibition induces apoptosis and limits growth of human pancreatic cancer". Journal of Cellular Biochemistry. 82 (1): 110–122. doi:10.1002/jcb.1150. ISSN 0730-2312. PMID 11400168.
- ^ Nawrocki, Steffan T.; Sweeney-Gotsch, Bridget; Takamori, Ryan; McConkey, David J. (2004-01). "The proteasome inhibitor bortezomib enhances the activity of docetaxel in orthotopic human pancreatic tumor xenografts". Molecular Cancer Therapeutics. 3 (1): 59–70. ISSN 1535-7163. PMID 14749476.
- ^ Schenkein, David (2002-06). "Proteasome inhibitors in the treatment of B-cell malignancies". Clinical Lymphoma. 3 (1): 49–55. doi:10.3816/clm.2002.n.011. ISSN 1526-9655. PMID 12141956.
- ^ O'Connor, Owen A.; Wright, John; Moskowitz, Craig; Muzzy, Jamie; MacGregor-Cortelli, Barbara; Stubblefield, Michael; Straus, David; Portlock, Carol; Hamlin, Paul (2005-02-01). "Phase II clinical experience with the novel proteasome inhibitor bortezomib in patients with indolent non-Hodgkin's lymphoma and mantle cell lymphoma". Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. 23 (4): 676–684. doi:10.1200/JCO.2005.02.050. ISSN 0732-183X. PMID 15613699.
- ^ Messinger, Yoav H.; Gaynon, Paul S.; Sposto, Richard; van der Giessen, Jeannette; Eckroth, Elena; Malvar, Jemily; Bostrom, Bruce C.; Therapeutic Advances in Childhood Leukemia & Lymphoma (TACL) Consortium (2012-07-12). "Bortezomib with chemotherapy is highly active in advanced B-precursor acute lymphoblastic leukemia: Therapeutic Advances in Childhood Leukemia & Lymphoma (TACL) Study". Blood. 120 (2): 285–290. doi:10.1182/blood-2012-04-418640. ISSN 1528-0020. PMID 22653976.
- ^ Lambrou, George I.; Papadimitriou, Lina; Chrousos, George P.; Vlahopoulos, Spiros A. (2012-04). "Glucocorticoid and proteasome inhibitor impact on the leukemic lymphoblast: Multiple, diverse signals converging on a few key downstream regulators". Molecular and Cellular Endocrinology (dalam bahasa Inggris). 351 (2): 142–151. doi:10.1016/j.mce.2012.01.003.
- ^ Schmidtke, G.; Holzhütter, H. G.; Bogyo, M.; Kairies, N.; Groll, M.; de Giuli, R.; Emch, S.; Groettrup, M. (1999-12-10). "How an inhibitor of the HIV-I protease modulates proteasome activity". The Journal of Biological Chemistry. 274 (50): 35734–35740. doi:10.1074/jbc.274.50.35734. ISSN 0021-9258. PMID 10585454.
- ^ Laurent, Nathalie; de Boüard, Sophie; Guillamo, Jean-Sébastien; Christov, Christo; Zini, Roland; Jouault, Hélène; Andre, Patrice; Lotteau, Vincent; Peschanski, Marc (2004-02). "Effects of the proteasome inhibitor ritonavir on glioma growth in vitro and in vivo". Molecular Cancer Therapeutics. 3 (2): 129–136. ISSN 1535-7163. PMID 14985453.
- ^ Zollner, Thomas M.; Podda, Maurizio; Pien, Christine; Elliott, Peter J.; Kaufmann, Roland; Boehncke, Wolf-Henning (2002-03). "Proteasome inhibition reduces superantigen-mediated T cell activation and the severity of psoriasis in a SCID-hu model". The Journal of Clinical Investigation. 109 (5): 671–679. doi:10.1172/JCI12736. ISSN 0021-9738. PMC 150886
 . PMID 11877475.
. PMID 11877475.
- ^ Elliott, P. J.; Pien, C. S.; McCormack, T. A.; Chapman, I. D.; Adams, J. (1999-08). "Proteasome inhibition: A novel mechanism to combat asthma". The Journal of Allergy and Clinical Immunology. 104 (2 Pt 1): 294–300. doi:10.1016/s0091-6749(99)70369-6. ISSN 0091-6749. PMID 10452747.
