Beta-laktam: Perbedaan antara revisi
Tidak ada ringkasan suntingan Tag: Suntingan perangkat seluler Suntingan peramban seluler Suntingan seluler lanjutan |
Tidak ada ringkasan suntingan Tag: Suntingan perangkat seluler Suntingan peramban seluler Suntingan seluler lanjutan |
||
| Baris 25: | Baris 25: | ||
==Reaksi== |
==Reaksi== |
||
Karena regangan cincin, β-laktam lebih mudah |
Karena regangan cincin, β-laktam lebih mudah di[[hidrolisis]] dibandingkan [[Amida]] linier atau laktam yang lebih besar. Strain ini semakin meningkat melalui fusi ke cincin kedua, seperti yang ditemukan pada sebagian besar antibiotik β-laktam. Kecenderungan ini disebabkan oleh karakter Amida dari β-laktam yang tereduksi oleh aplanaritas sistem. Atom nitrogen dari Amida ideal terhibridisasi sp2 karena resonansi, dan atom terhibridisasi sp2 mempunyai geometri ikatan trigonal planar. Ketika geometri ikatan [[Limas|piramidal]] dipaksakan pada atom nitrogen oleh regangan cincin, [[Resonansi (kimia)|resonansi]] ikatan Amida berkurang, dan karbonil menjadi lebih mirip [[keton]]. [[Daftar penerima nobel|Peraih Nobel]] [[Robert Burns Woodward]] menggambarkan parameter h sebagai ukuran tinggi piramida trigonal yang ditentukan oleh nitrogen (sebagai [[Titik puncak (geometri)|puncak]]) dan tiga atom yang berdekatan. h sesuai dengan kekuatan ikatan β-laktam dengan angka yang lebih rendah (lebih planar; lebih mirip amino ideal) menjadi lebih kuat dan kurang reaktif.<ref>{{cite journal | vauthors = Woodward RB | title = Penems and related substances | journal = Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences | volume = 289 | issue = 1036 | pages = 239–50 | date = May 1980 | pmid = 6109320 | doi = 10.1098/rstb.1980.0042 | bibcode = 1980RSPTB.289..239W | doi-access = free }}</ref> Monobaktam memiliki nilai h antara 0,05 dan 0,10 [[ångström]] (Å). Cephem memiliki nilai h sebesar 0,20–0,25 Å. Penam memiliki nilai dalam kisaran 0,40–0,50 Å, sedangkan karbapenem dan kladam memiliki nilai 0,50–0,60 Å, menjadi β-laktam yang paling reaktif terhadap hidrolisis.<ref name = "Nangia_1996">{{cite journal | vauthors = Nangia A, Biradha K, Desiraju GR | year = 1996 | title = Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters: A Cambridge database study | journal = J. Chem. Soc. Perkin Trans. | volume = 2 | issue = 5| pages = 943–53 | doi=10.1039/p29960000943}}</ref> |
||
==Referensi== |
==Referensi== |
||
Revisi per 29 April 2024 15.34
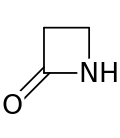
Cincin beta-laktam (β-laktam) adalah laktam beranggota empat.[1] Laktam adalah suatu amida siklik, dan beta-laktam dinamakan demikian karena atom nitrogen terikat pada atom karbon β relatif terhadap karbonil. β-laktam yang paling sederhana adalah 2-azetidinon. β-laktam adalah unit struktural penting dari obat-obatan seperti yang dimanifestasikan dalam banyak antibiotik beta-laktam.[2] Hingga tahun 1970, sebagian besar penelitian β-laktam berkaitan dengan kelompok penisilin dan sefalosporin, namun sejak itu, beragam struktur telah dijelaskan.[3][4]
Signifikansi klinis
Sintesis
β-laktam sintetik pertama dibuat oleh Hermann Staudinger pada tahun 1907 melalui reaksi basa Schiff dari anilin dan benzaldehida dengan difenilketena[5][6] dalam sikloadisi [2+2] (Ph menunjukkan gugus fungsi fenil):
 Banyak metode telah dikembangkan untuk sintesis β-laktam.[7][8][9]
Banyak metode telah dikembangkan untuk sintesis β-laktam.[7][8][9]
Sintesis Breckpot β-laktam[10] menghasilkan β-laktam tersubstitusi melalui siklisasi ester asam amino beta dengan menggunakan pereaksi Grignard.[11] Pereaksi Mukaiyama juga digunakan dalam sintesis Breckpot yang dimodifikasi.[10]

Reaksi
Karena regangan cincin, β-laktam lebih mudah dihidrolisis dibandingkan Amida linier atau laktam yang lebih besar. Strain ini semakin meningkat melalui fusi ke cincin kedua, seperti yang ditemukan pada sebagian besar antibiotik β-laktam. Kecenderungan ini disebabkan oleh karakter Amida dari β-laktam yang tereduksi oleh aplanaritas sistem. Atom nitrogen dari Amida ideal terhibridisasi sp2 karena resonansi, dan atom terhibridisasi sp2 mempunyai geometri ikatan trigonal planar. Ketika geometri ikatan piramidal dipaksakan pada atom nitrogen oleh regangan cincin, resonansi ikatan Amida berkurang, dan karbonil menjadi lebih mirip keton. Peraih Nobel Robert Burns Woodward menggambarkan parameter h sebagai ukuran tinggi piramida trigonal yang ditentukan oleh nitrogen (sebagai puncak) dan tiga atom yang berdekatan. h sesuai dengan kekuatan ikatan β-laktam dengan angka yang lebih rendah (lebih planar; lebih mirip amino ideal) menjadi lebih kuat dan kurang reaktif.[12] Monobaktam memiliki nilai h antara 0,05 dan 0,10 ångström (Å). Cephem memiliki nilai h sebesar 0,20–0,25 Å. Penam memiliki nilai dalam kisaran 0,40–0,50 Å, sedangkan karbapenem dan kladam memiliki nilai 0,50–0,60 Å, menjadi β-laktam yang paling reaktif terhadap hidrolisis.[13]
Referensi
- ^ Gilchrist T (1987). Heterocyclic Chemistry. Harlow: Longman Scientific. ISBN 978-0-582-01421-3.
- ^ Fisher, J. F.; Meroueh, S. O.; Mobashery, S. (2005). "Bacterial resistance to β-lactam antibiotics: compelling opportunism, compelling opportunity". Chemical Reviews. 105 (2): 395–424. doi:10.1021/cr030102i. PMID 15700950.
- ^ Flynn EH (1972). Cephalosporins and Penicillins : Chemistry and Biology. New York and London: Academic Press.
- ^ Hosseyni S, Jarrahpour A (October 2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry. 16 (38): 6840–6852. doi:10.1039/c8ob01833b. PMID 30209477.
- ^ Tidwell TT (2008). "Hugo (Ugo) Schiff, Schiff bases, and a century of beta-lactam synthesis". Angewandte Chemie. 47 (6): 1016–20. doi:10.1002/anie.200702965. PMID 18022986.
- ^ Staudinger H (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1–2): 51–123. doi:10.1002/jlac.19073560106. Diarsipkan dari versi asli tanggal 2020-08-02. Diakses tanggal 2019-06-27.
- ^ Alcaide, Benito; Almendros, Pedro; Aragoncillo, Cristina (2007). "Β-Lactams: Versatile Building Blocks for the Stereoselective Synthesis of Non-β-Lactam Products". Chemical Reviews. 107 (11): 4437–4492. doi:10.1021/cr0307300. PMID 17649981.
- ^ Hosseyni, Seyedmorteza; Jarrahpour, Aliasghar (2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry (dalam bahasa Inggris). 16 (38): 6840–6852. doi:10.1039/C8OB01833B. ISSN 1477-0520. PMID 30209477.
- ^ Pitts, Cody Ross; Lectka, Thomas (2014-08-27). "Chemical Synthesis of β-Lactams: Asymmetric Catalysis and Other Recent Advances". Chemical Reviews (dalam bahasa Inggris). 114 (16): 7930–7953. doi:10.1021/cr4005549. ISSN 0009-2665. PMID 24555548. Diarsipkan dari versi asli tanggal 2022-07-21. Diakses tanggal 2020-12-17.
- ^ a b "Breckpot β-Lactam Synthesis", Comprehensive Organic Name Reactions and Reagents (dalam bahasa Inggris), Hoboken, NJ, USA: John Wiley & Sons, Inc., hlm. 521–524, 2010-09-15, doi:10.1002/9780470638859.conrr115, ISBN 978-0-470-63885-9, diarsipkan dari versi asli tanggal 2024-01-16, diakses tanggal 2021-02-04
- ^ Bogdanov B, Zdravkovski Z, Hristovski K. "Breckpot Synthesis". Institute of Chemistry Skopje. Diarsipkan dari versi asli tanggal 2015-11-06. Diakses tanggal 2014-12-30.
- ^ Woodward RB (May 1980). "Penems and related substances". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 289 (1036): 239–50. Bibcode:1980RSPTB.289..239W. doi:10.1098/rstb.1980.0042
 . PMID 6109320.
. PMID 6109320.
- ^ Nangia A, Biradha K, Desiraju GR (1996). "Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters: A Cambridge database study". J. Chem. Soc. Perkin Trans. 2 (5): 943–53. doi:10.1039/p29960000943.
