Kalium ferosianida: Perbedaan antara revisi
Fitur saranan suntingan: 3 pranala ditambahkan. |
k (GR) File renamed: File:Potassium ferrocyanide.jpg → File:Potassium hexacyanidoferrate(II).jpg Criterion 4 |
||
| Baris 7: | Baris 7: | ||
| ImageFile1 = Structure of potassium ferrocyanide.png |
| ImageFile1 = Structure of potassium ferrocyanide.png |
||
| ImageFile2 = Potassium Ferrocyanide.png |
| ImageFile2 = Potassium Ferrocyanide.png |
||
| ImageFile3 = Potassium |
| ImageFile3 = Potassium hexacyanidoferrate(II).jpg |
||
| ImageSize3 = 150px |
| ImageSize3 = 150px |
||
| ImageName3 = Potassium ferrocyanide trihydrate |
| ImageName3 = Potassium ferrocyanide trihydrate |
||
Revisi terkini sejak 13 Juni 2024 16.49

| |
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Kalium heksasianidoferat(II)
| |
| Nama lain | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| K4[Fe(CN)6] | |
| Massa molar | 368,35 g/mol (anhidrat) 422,388(0) g/mol (trihidrat) |
| Penampilan | Kuning muda, kristal granul |
| Densitas | 1,85 g/cm3 (trihidrat) |
| Titik didih | (terdekomposisi) |
| trihidrat 28,9 g/100 mL (20 °C) | |
| Kelarutan | tidak larut dalam etanol, eter |
| −130,0·10−6 cm3/mol | |
| Bahaya | |
| Frasa-R | R32, R52, R53 |
| Frasa-S | S50(B), S61 |
| Titik nyala | Tidak mudah terbakar |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
6400 mg/kg (oral, tikus)[3] |
| Senyawa terkait | |
Anion lain
|
Kalium ferisianida |
Kation lainnya
|
Natrium ferosianida Biru Prusia |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kalium ferosianida adalah senyawa organik dengan rumus K4[Fe(CN)6] • 3H2O. Ia adalah garam kalium dari kompleks koordinasi [Fe(CN)6]4−. Garam ini berbentuk kristal monoklinik berwarna kuning lemon.
Sintesis
[sunting | sunting sumber]Pada tahun 1752, kimiawan Perancis Pierre Joseph Macquer (1718–1784) melaporkan untuk pertama kalinya preparasi kalium ferosianida, yang diperolehnya melalui reaksi antara biru Prusia (besi(III) ferosianida) dengan kalium karbonat.[4][5]
Produksi modern
[sunting | sunting sumber]Kalium ferosianida dibuat dalam skala industri dari hidrogen sianida, fero klorida, dan kalsium hidroksida, yang reaksinya menghasilkan Ca2[Fe(CN)6] • 11H2O. Larutan ini kemudian diberi perlakuan dengan garam kalium untuk mengendapkan campuran garam kalsium-kalium CaK2[Fe(CN)6], yang kemudian diberi perlakuan dengan kalium karbonat untuk menghasilkan garam tetrakaliumnya.[6]
Produksi dalam sejarah
[sunting | sunting sumber]Secara historis, senyawa ini dibuat dari senyawa organik yang mengandung nitrogen, besi, dan kalium karbonat.[7] Sumber nitrogen dan karbon yang umum adalah tanduk, limbah kulit hewan, jeroan, atau darah kering.
Reaksi kimia
[sunting | sunting sumber]Perlakuan kalium ferosianida dengan asam nitrat menghasilkan H2[Fe(NO)(CN)5]. Setelah netralisasi zat antara ini dengan natrium karbonat, terbentuk kristal merah natrium nitroprusida yang dapat dikristalkan secara selektif.[8]
Pada saat perlakuan dengan gas klorin, kalium ferosianida berubah menjadi kalium ferisianida:
Reaksi ini dapat digunakan untuk menghilangkan kalium ferosianida dari larutan.
Reaksi yang terkenal melibatkan perlakuan dengan garam besi(III) menghasilkan biru Prusia. Dengan komposisi KFe2(CN)6 yang sesuai, bahan berwarna gelap yang tak larut ini adalah pewarna biru dalam cetak biru.
Aplikasi
[sunting | sunting sumber]Kalium ferosianida menemukan banyak aplikasi ceruk di dunia industri. Ia dan garam natriumnya banyak digunakan sebagai anti kempal baik untuk garam teknis maupun garam meja. Kalium dan natrium ferosianida juga digunakan dalam pemurnian timah dan pemisahan tembaga dari bijih molibdenum. Kalium ferosianida digunakan dalam produksi wine dan asam sitrat.[6]
Di Uni Eropa, ferosianida (E 535–538), per 2018, dijual resmi dalam dua kategori makanan sebagai pengganti garam. Ginjal adalah organ yang terpengaruh oleh toksisitas ferosianida.[9]
Ia juga dapat digunakan sebagai pakan hewan.[10]
Dalam skala laboratorium, kalium ferosianida digunakan untuk menentukan konsentrasi kalium permanganat, suatu senyawa yang sering digunakan dalam titrasi berdasarkan reaksi redoks. Kalium ferosianida digunakan dalam campuran dengan kalium ferisianida dan larutan dapar fosfat untuk menghasilkan dapar untuk beta-galaktosidase mengikat targetnya. Jika sireaksikan dengan Fe(III), ia menghasilkan warna biru Prusia. Oleh karena itu pereaksi ini digunakan untuk mengidentifikasi besi di laboratorium.
Kalium ferosianida dapat digunakan sebagai pupuk tanaman.
Sebelum 1900 Masehi, sebelum penemuan proses Castner, kalium ferosianida adalah sumber sianida logam alkali yang paling penting.[6] Dalam proses bersejarah ini, kalium sianida diproduksi dengan mendekomposisi kalium ferosianida:[7]
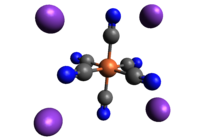
Struktur
[sunting | sunting sumber]Seperti sianida logam lainnya, kalium ferosianida padat, baik sebagai garam hidrat dan anhidrat, memiliki struktur polimer yang rumit. Polimer terdiri dari pusat oktahedral [Fe(CN)6]4− yang berikatan silang dengan ion K+ yang terikat pada ligan CN.[11] Ikatan K+---NC pecah ketika padatan dilarutkan dalam air.
Toksisitas
[sunting | sunting sumber]Kalium ferosianida tidak beracun, dan tidak terdekomposisi menjadi sianida di dalam tubuh. Toksisitas pada tikus adalah rendah, dengan dosis letal (LD50) adalah 6.400 mg/kg.[2]
Lihat juga
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ https://play.google.com/books/reader?printsec=frontcover&output=reader&id=gXwPAAAAYAAJ&pg=GBS.PA8
- ^ a b "POTASSIUM FERROCYANIDE MSDS Number: P5763 - Effective Date: 12/08/96". J. T. Baker Inc. Diakses tanggal 2012-04-08.
- ^ http://chem.sis.nlm.nih.gov/chemidplus/rn/13943-58-3
- ^ Macquer (1752). "Éxamen chymique de bleu de Prusse" [Chemical examination of Prussian blue]. Histoire de l'Académie royale des sciences … , § Mémoires de l'Académie royale des Sciences (dalam bahasa French): 60–77. From pp. 63-64: "Après avoir essayé ainsi inutilement de décomposer le bleu de Prusse par les acides, … n'avoit plus qu'une couleur jaune un peu rousse." (After having tried so vainly to decompose Prussian blue by acids, I made recourse to alkalies. I put a half ounce of this [Prussian] blue in a flask, and I poured on it ten ounces of a solution of nitre fixed by tartar [i.e., potassium nitrate (nitre) which is mixed with crude cream of tartar and then ignited, producing potassium carbonate]. As soon as these two substances had been mixed together, I saw with astonishment that, without the aid of heat, the blue color had entirely disappeared; the powder [i.e., precipitate] at the bottom of the flask had only a rather gray color: having put this vessel on a sand bath in order to heat the solution until it simmered, this gray color also disappeared entirely, and all that was contained in the flask, both the powder [i.e., precipitate] and the solution, had only a yellow color [that was] a little red.)
- ^ Munroe, Charles E.; Chatard, Thomas M. (1902). "Manufactures: Chemicals and Allied Products". Twelfth Census of the United States: Bulletins (210): 1–306.; see p. 31.
- ^ a b c Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M.; Kellens, R.; Reddy, J.; Steier, N.; Hasenpusch, W. (October 2011). "Cyano Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_159.pub3.
- ^ a b Von Wagner, Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co. hlm. 474 & 477.
- ^ Seel, F. (1965). "Sodium Nitrosyl Cyanoferrate". Dalam Brauer, G. Handbook of Preparative Inorganic Chemistry. 2 (edisi ke-2nd). New York: Academic Press. hlm. 1768. LCCN 63-14307. Diarsipkan dari versi asli tanggal 2010-03-07. Diakses tanggal 2020-03-28.
- ^ Peter Aggett, Fernando Aguilar, Riccardo Crebelli, Birgit Dusemund, Metka Filipič, Maria Jose Frutos, Pierre Galtier, David Gott, Ursula Gundert‐Remy, Gunter Georg Kuhnle, Claude Lambré, Jean‐Charles Leblanc, Inger Therese Lillegaard, Peter Moldeus, Alicja Mortensen, Agneta Oskarsson, Ivan Stankovic, Ine Waalkens‐Berendsen, Rudolf Antonius Woutersen, Matthew Wright and Maged Younes. (2018). "Re‐evaluation of sodium ferrocyanide (E 535), potassium ferrocyanide (E 536) and calcium ferrocyanide (E 538) as food additives". EFSA Journal. 16 (7): 5374. doi:10.2903/j.efsa.2018.5374.
- ^ "EuSalt Expert Meeting on E 535 and E 536 as Feed Additives". EUSalt. Diarsipkan dari versi asli tanggal 2019-05-12. Diakses tanggal 2020-03-28.
- ^ Willans, M.J.; Wasylishen, R.E.; McDonald, R. "Polymorphism of potassium ferrocyanide trihydrate as studied by solid-state multinuclear NMR spectroscopy and X-ray diffraction" Inorganic Chemistry 2009, volume 48, p4342-4353
Pranala luar
[sunting | sunting sumber]- "Cyanide (inorganic) compounds fact sheet". National Pollutant Inventory Australia.
- "Potassium Ferrocyanide in Salt Is Entirely Safe To Consume". rediff.com.[pranala nonaktif permanen]

![{\displaystyle {\ce {2K4[Fe(CN)6] + Cl2 -> 2K3[Fe(CN)6] + 2KCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59baf6716c2f8bd172c3e90c0597825178961433)
![{\displaystyle {\ce {K4[Fe(CN)6] -> 4 KCN + FeC2 + N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/49f45afaf31c655d77c9153a37e5cbef4310b7bd)