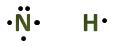Struktur Lewis
struktur lewis adalah diagram yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Struktur Lewis digunakan untuk menggambarkan ikatan kovalen dan ikatan kovalen koordinasi.
Struktur Lewis dikembangkan oleh Gilbert N. Lewis, yang menyatakan bahwa atom-atom bergabung untuk mencapai konfigurasi elektron yang lebih stabil.
Untuk menyusun struktur Lewis dari suatu atom atau unsur, dapat dengan cara menuliskan simbol titik pada sekeliling atom. Setiap titik mewakili satu elektron yang terdapat pada kulit valensi atom tersebut. Elektron yang terlibat dalam ikatan ini hanya elektron-elektron yang terdapat pada kulit terluar dan jumlah total elektron yang terlibat dalam pembentukan ikatan ini tidak mengalami perubahan (merupakan jumlah total elektron valensi dari atom-atom yang berikatan).
Pada umumnya, jumlah elektron pada kulit valensi sama dengan golongan dari suatu atom. Oleh karena itu, jumlah titik pada simbol Lewis sama dengan golongan dari atom tersebut. Namun untuk logam transisi, lantanida, dan aktinida yang mempunyai kulit dalam yang tidak terisi penuh, titik Lewis dari unsur-unsur tersebut tidak dapat dituliskan secara sederhana.
Penulisan struktur lewis
Walaupun aturan oktet dan struktur lewis tidak dapat menggambarkan ikatan kovalen secara lengkap, keduanya sangat membantu untuk menjelaskan bentuk ikatan dalam beberapa senyawa dan menjelaskan sifat-sifatnya dan reaksi molekulnya.[1] Rumus lewis untuk beberapa molekul kovalen dan ion sangat berguna, antara lain untuk mempelajari geometri suatu molekul.[2] Penulisan struktur lewis mengikuti tahap-tahap sebagai berikut:[1]
- Tulislah kerangka struktur dari senyawa bersangkutan, yang teridiri dari lambang kimia atom-atom yang terlibat dan menempatkan atom-atom yang berikatan secara berdekatan satu sama lain. Tahap ini cukup mudah dikerjakan untuk senyawa yang sederhana, tetapi untuk senyawa yang lebih rumit harus ada informasi yang sudah diketahui atau dengan membuat kerangka yang paling mungkin. Secara umum, atom dengan keelektronegatifan terkecil menempati posisi di tengah (pusat). Hidrogen dan fluorin biasanya menempati posisi ujung pada struktur lewis.
- Hitunglah jumlah total elektron valensi dari semua atom yang terlibat. Untuk anion poliatomik, tambahkan juga perlu muatan negatifnya ke dalam jumlah elektron valensi. (misalnya, untuk ion CO32- kita tambahkan 2 elektron karena muatan 2- menunjukan bahwa terdapat dua elektron tambahan daripada yang diberikan oleh atom netral). Untuk kation poliatomik jumlah elektron valensi dikurangi jumlah muatan positifnya. (misalnya, untuk kation NH4+ jumlah elektron valensi dikurangi satu karena muatan 1+ menandakan lepasnya satu elektron dari atom netral).
- Gambarlah ikatan kovalen tunggal antara atom pusat dengan semua atom di sekitarnya. Lengkapi oktet dari semua atom yang terikat pada atom pusat. (ingat bahwa kulit valensi atom hidrogen maksimum ditempati hany oleh dua elektron.) elektron dari atom pusat atau atom sekitar harus dituliskan sebagai pasangan elektron bebas jika elektron tersebut tidak terlibat dalam pembentukaan ikatan. Jumlah total elektron yang digunakan untuk ikatan adalah jumlah yang telah dihitung pada tahap 2 di atas.
- Jika aturan oktet belum tercapai pada atom pusat, gunakan pasangan elektron bebas dari atom-atom di sekitarnya untuk menambahkan ikatan rangkap dua atau rangkap tiga di antara atom pusat dan atom di sekitarnya sampai aturan terpenuhi

Penggunaan untuk atom-atom yang berikatan
Pada ikatan kovalen tunggal
- Ikatan kovalen pada H2

- Ikatan kovalen pada F2

Pada ikatan kovalen rangkap dua
Pada ikatan kovalen rangkap dua, ditunjukkan oleh garis rangkap dua (=), yang artinya terdapat dua pasangan elektron ikatan, contohnya pada ikatan rangkap dua pada molekul CO2.

Pada ikatan ion
- Ikatan ion pada NaCl
Atom Na memberikan 1 elektronnya pada atom Cl, sehingga Na bermuatan positif dan Cl bermuatan negatif. Keduanya telah memenuhi kaidah oktet.

- Ikatan ion pada MgO
Atom Mg memberikan 2 elektronnya pada atom O, sehingga Mg bermuatan positif 2 dan O bermuatan negatif 2. Keduanya telah memenuhi kaidah oktet.

Penggambaran
Langkah-langkah dalam menggambarkan struktur Lewis:
- Menghitung valensi atom yang akan dibuat struktur Lewisnya, contoh NH3.
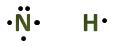
Valensi Atom N dan H pada NH3 - Membuat kerangka strukturnya, di mana atom pusatnya biasanya adalah atom pertama dalam rumus kimia molekul tersebut.
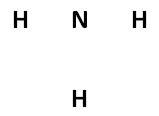
- Menempatkan satu elektron pada sisi di mana terdapat atom lain. Jika terdapat sisa elektron, letakkan elektron-elektron tersebut secara berpasangan.

- Menulis semua elektron valensi dari atom-atom yang terlibat dengan menggunakan lambang titik (•).

- Melengkapi bentuk duplet atau oktet dari ikatan atom ke atom pusat.

- Bila atom pusat masih belum memenuhi kaidah oktet maka dapat digunakan ikatan rangkap agar setiap atom dapat memenuhi oktet.
- Jika sudah sesuai, ganti setiap pasangan elektron tersebut dengan garis tunggal (ikatan tunggal). Apabila terdapat dua pasangan elektron, maka ganti dengan garis rangkap dua (ikatan rangkap dua). Jika terdapat 3 pasangan elektron, ganti dengan garis rangkap tiga (ikatan rangkap tiga).