Kondensasi Knoevenagel
Reaksi kondensasi Knoevenagel adalah sebuah reaksi organik yang dinamakan dari Emil Knoevenagel. Reaksi ini merupakan modifikasi dari reaksi kondensasi aldol [1].
Kondensasi Knoevenagel adalah adisi nukleofilik senyawa hidrogen aktif ke sebuah gugus karbonil yang diikuti oleh reaksi dehidrasi. Produk reaksi sering merupakan enon berkonjugasi alfa, beta.

Pada reaksi ini, gugus karbonilnya adalah aldehida atau keton. Katalis yang digunakan biasanya merupakan amina basa lemah. Komponen hidrogen aktifnya mempunyai bentuk[2]
- Z-CH2-Z atau Z-CHR-Z, sebagai contohnya dietil malonat, asam Meldrum, etil asetoasetat atau asam malonat.
- Z-CHR1R2, contohnya nitrometana.
Dengan Z adalah gugus fungsi penarik elektron. Z haruslah cukup kuat untuk memfasilitasi abstraksi hidrogen ke ion enolat, bahkan dengan basa yang moderat. Penggunakan basa kuat pada reaksi ini akan menyebabkan swakondensasi aldehida atau keton.
Sintesis piridina Hantzsch, reaksi Gewald, dan sintesis furan Feist-Benary semuanya mengandung tahap reaksi Knoevenagel. Reaksi ini juga berperan dalam penemuan gas 2-klorobenzalmalononitril.
Modifikasi Doebner

Dengan senyawa malonat, produk reaksi dapat melepaskan karbon dioksida. Dalam modifikasi Doebner[3] ini, basa yang diperlukan adalah piridina. Sebagai contoh, produk reaksi akrolein dan asam malonat dalam piridina adalah asam trans-2,4-pentadienoat dengan satu gugus asam karboksilat dan bukannya dua[4].
Ruang lingkup
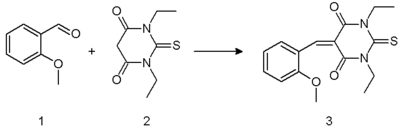
Kondensasi Knoevenagel dapat terlihat pada reaksi 2-metoksibenzaldehida 1 dengan asam barbiturat 2 dalam etanol menggunakan piperidina sebagai basa [5]. Enon 3 yang dihasilkan merupakan molekul kompleks pemindahan muatan.
Kondensasi Knoevenagel merupakan langkah kunci dalam produksi komersial obat antimalaria lumefantrina (komponen Coartem) [6]:

Produk reaksi awalnya merupakan campuran 50:50 isomer E dan Z, namun karena kedua isomer memiliki kesetimbangan yang cepat di sekitar prekursor hidroksilnya, Z-isomer yang lebih stabil pada akhirnya bisa didapatkan secara penuh.
Reaksi multikomponen yang melibatkan kondensasi Knoevenagel dapat dilihat pada sintesis MORE dengan sikloheksanon, malononitril, dan 3-amino-1,2,4-triazola [7]:

Lihat pula
Referensi
- ^ Emil Knoevenagel (1898). "Condensation von Malonsäure mit Aromatiachen Aldehyden durch Ammoniak und Amine". Berichte der deutschen chemischen Gesellschaft. 31: 2596–2619. doi:10.1002/cber.18980310308.
- ^ March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and Structure (dalam bahasa Inggris) (edisi ke-3). John Wiley & Sons. ISBN 0-471-85472-7.
- ^ O. Doebner (1902). "Ueber die der Sorbinsäure homologen, ungesättigten Säuren mit zwei Doppelbindungen". Berichte der deutschen chemischen Gesellschaft. 35: 1136–1136. doi:10.1002/cber.190203501187.
- ^ Peter J. Jessup, C. Bruce Petty, Jan Roos, and Larry E. Overman (1988). "1-N-Acylamino-1,3-dienes from 2,4-pentadienoic acids by the curtius rearrangement: benzyl trans-1,3-butadiene-1-carbamate". Org. Synth.; Coll. Vol. 6: 95.
- ^ 1,3-Diethyl-5-(2-methoxybenzylidene)-2-thioxodihydropyrimidine-4,6(1H,5H)-dione Abdullah Mohamed Asiria, Khaled Ahmed Alamrya Abraham F. Jalboutb, Suhong Zhang Molbank 2004, M359 [1] publication.
- ^ An Improved Manufacturing Process for the Antimalaria Drug Coartem. Part II Ulrich Beutler, Peter C. Fuenfschilling, and Andreas Steinkemper Org. Process Res. Dev.; 2007; 11(3) pp 341 - 345; (Article) doi:10.1021/op060244p
- ^ Mild and ecofriendly tandem synthesis of 1,2,4-triazolo[4,3-a]pyrimidines in aqueous medium Arkivoc 2007 (06-2251BP) Anshu Dandia, Pritima Sarawgi, Kapil Arya, and Sarita Khaturia Link
