Besi(II) oksalat
Tampilan

| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Besi(II) oksalat
| |
| Nama lain
Besi oksalat
Ferro oksalat | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| FeC2O4 (anhidrat) FeC2O42H2O (dihidrat) | |
| Massa molar | 143.86 g/mol (anhidrat) 179.89 g/mol (dihidrat) |
| Penampilan | bubuk kuning |
| Bau | tidak berbau |
| Densitas | 2.28 g/cm3 |
| Titik lebur | 190 °C (374 °F; 463 K) (anhidrat)[1] 150–160 °C (302–320 °F; 423–433 K) (dihydrate) decomposes |
| Titik didih | 3.651 °C (6.604 °F; 3.924 K) (anhydrous)[1] |
| dihydrate: 0.097 g/100ml (25 °C)[2] | |
| Bahaya | |
| Piktogram GHS |  [3] [3]
|
| Keterangan bahaya GHS | {{{value}}} |
| H302, H312[3] | |
| P280[3] | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Besi(II) oksalat adalah senyawa anorganik dengan rumus FeC2O4 x H2O di mana x biasanya 2. Ini adalah senyawa berwarna jingga, sukar larut dalam air.
Struktur
Dihidrat FeC2O4.2H2O adalah polimer koordinasi, yang terdiri dari rantai pusat besi yang dijembatani oksalat, masing-masing dengan dua ligan aquo..[4]
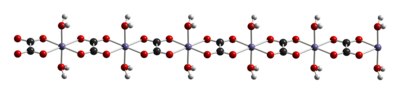
Saat dipanaskan, ia mengalami dehidrasi dan terurai menjadi campuran oksida besi dan logam besi piroforik , dengan pelepasan karbon dioksida, karbon monoksida, dan air. [5]
Keberadaan di alam
Besi(II) oksalat anhidrat belum diketahui (2020) di antara mineral. Namun, dihidratnya dikenal sebagai humboldtin. [6][7] Mineral terkait, meskipun jauh lebih kompleks adalah stepanovit , Na[Mg(H2O)6][Fe(C2O4)3]·3H2O - sebuah contoh dari trioksalatoferat(II). [8][7]
Lihat juga
Referensi
- ^ a b "CAS 516-03-0 products price,suppliers".
- ^ "Iron(II) oxalate dihydrate".
- ^ a b c Sigma-Aldrich Co., Iron(II) oxalate dihydrate. Diakses tanggal 2014-05-03.
- ^ Echigo, Takuya; Kimata, Mitsuyoshi (2008). "Single-crystal X-ray diffraction and spectroscopic studies on humboldtine and lindbergite: weak Jahn–Teller effect of Fe2+ ion". Physics and Chemistry of Minerals. 35 (8): 467–475. Bibcode:2008PCM....35..467E. doi:10.1007/s00269-008-0241-7.
- ^ Hermanek, Martin; Zboril, Radek; Mashlan, Miroslav; et al. (2006). "Thermal behaviour of iron(II) oxalate dihydrate in the atmosphere of its conversion gases". J. Mater. Chem. 16 (13): 1273–1280. doi:10.1039/b514565a.
- ^ "Humboldtine".
- ^ a b "List of Minerals". 21 March 2011.
- ^ "Stepanovite".
