Isotop iodin
Artikel ini membutuhkan rujukan tambahan agar kualitasnya dapat dipastikan. (Juli 2022) |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar Ar°(I) |
| |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Ada 37 isotop iodin (53I) yang diketahui, mulai dari 108I hingga 144I; semuanya mengalami peluruhan radioaktif kecuali 127I, yang stabil. Dengan demikian, iodin merupakan unsur monoisotop.
Isotop radioaktifnya yang berumur paling panjang, 129I, memiliki waktu paruh 15,7 juta tahun, yang terlalu pendek untuk eksis sebagai nuklida primordial. Sumber kosmogenik 129I menghasilkan jumlah yang sangat kecil yang terlalu kecil untuk mempengaruhi pengukuran berat atom; dengan demikian iodin juga merupakan unsur mononuklida—unsur yang hanya memiliki satu nuklida yang dapat ditemukan di alam. Sebagian besar radioaktivitas turunan 129I di Bumi adalah buatan manusia, produk sampingan berumur panjang yang tidak diinginkan dari uji coba nuklir awal dan kecelakaan fisi nuklir.
Semua radioisotop iodin lainnya memiliki waktu paruh kurang dari 60 hari, dan empat di antaranya digunakan sebagai pelacak dan agen terapeutik dalam pengobatan. Mereka adalah 123I, 124I, 125I, dan 131I. Semua produksi industri isotop iodin yang radioaktif melibatkan keempat radionuklida yang berguna ini.
Isotop 135I memiliki waktu paruh kurang dari tujuh jam, yang terlalu pendek untuk digunakan dalam biologi. Produksi in situ yang tidak dapat dihindari dari isotop ini penting dalam pengendalian reaktor nuklir, karena ia meluruh menjadi 135Xe, penyerap neutron paling kuat yang diketahui, dan nuklida yang bertanggung jawab atas apa yang disebut fenomena biji iodin.
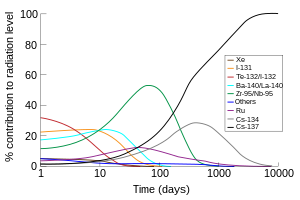
Selain produksi komersial, 131I (waktu paruh 8 hari) merupakan salah satu produk fisi radioaktif umum dari fisi nuklir, dan diproduksi secara tidak sengaja dalam jumlah yang sangat besar di dalam reaktor nuklir. Karena volatilitasnya, waktu paruhnya yang pendek, dan kelimpahannya yang tinggi dalam produk fisi, 131I (bersama dengan isotop iodin berumur pendek 132I, yang dihasilkan dari peluruhan 132Te dengan waktu paruh 3 hari) bertanggung jawab atas bagian terbesar dari kontaminasi radioaktif selama minggu pertama setelah kontaminasi lingkungan yang tidak disengaja dari limbah radioaktif dari pembangkit listrik tenaga nuklir. Jadi, suplemen iodin dosis tinggi (biasanya kalium iodida) diberikan kepada masyarakat setelah kecelakaan nuklir atau ledakan (dan dalam beberapa kasus sebelum kejadian seperti mekanisme pertahanan sipil) untuk mengurangi penyerapan senyawa iodin radioaktif oleh tiroid sebelum isotop radioaktif memiliki waktu untuk meluruh.
Daftar isotop
| Nuklida [n 1] |
Z | N | Massa isotop (Da) [n 2][n 3] |
Waktu paruh [n 4] |
Mode peluruhan [n 5] |
Isotop anak [n 6][n 7] |
Spin dan paritas [n 8][n 4] |
Kelimpahan alami (fraksi mol) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Energi eksitasi[n 4] | Proporsi normal | Rentang variasi | |||||||||||||||||
| 108I | 53 | 55 | 107,94348(39)# | 36(6) mdtk | α (90%) | 104Sb | (1)# | ||||||||||||
| β+ (9%) | 108Te | ||||||||||||||||||
| p (1%) | 107Te | ||||||||||||||||||
| 109I | 53 | 56 | 108,93815(11) | 103(5) µdtk | p (99,5%) | 108Te | (5/2+) | ||||||||||||
| α (0,5%) | 105Sb | ||||||||||||||||||
| 110I | 53 | 57 | 109,93524(33)# | 650(20) mdtk | β+ (70,9%) | 110Te | 1+# | ||||||||||||
| α (17%) | 106Sb | ||||||||||||||||||
| β+, p (11%) | 109Sb | ||||||||||||||||||
| β+, α (1,09%) | 106Sn | ||||||||||||||||||
| 111I | 53 | 58 | 110,93028(32)# | 2,5(2) dtk | β+ (99,92%) | 111Te | (5/2+)# | ||||||||||||
| α (0,088%) | 107Sb | ||||||||||||||||||
| 112I | 53 | 59 | 111,92797(23)# | 3,42(11) dtk | β+ (99,01%) | 112Te | |||||||||||||
| β+, p (0,88%) | 111Sb | ||||||||||||||||||
| β+, α (0,104%) | 108Sn | ||||||||||||||||||
| α (0,0012%) | 108Sb | ||||||||||||||||||
| 113I | 53 | 60 | 112,92364(6) | 6,6(2) dtk | β+ (100%) | 113Te | 5/2+# | ||||||||||||
| α (3,3×10−7%) | 109Sb | ||||||||||||||||||
| β+, α | 109Sn | ||||||||||||||||||
| 114I | 53 | 61 | 113,92185(32)# | 2,1(2) dtk | β+ | 114Te | 1+ | ||||||||||||
| β+, p (langka) | 113Sb | ||||||||||||||||||
| 114mI | 265,9(5) keV | 6,2(5) dtk | β+ (91%) | 114Te | (7) | ||||||||||||||
| IT (9%) | 114I | ||||||||||||||||||
| 115I | 53 | 62 | 114,91805(3) | 1,3(2) mnt | β+ | 115Te | (5/2+)# | ||||||||||||
| 116I | 53 | 63 | 115,91681(10) | 2,91(15) dtk | β+ | 116Te | 1+ | ||||||||||||
| 116mI | 400(50)# keV | 3,27(16) µdtk | (7−) | ||||||||||||||||
| 117I | 53 | 64 | 116,91365(3) | 2,22(4) mnt | β+ | 117Te | (5/2)+ | ||||||||||||
| 118I | 53 | 65 | 117,913074(21) | 13,7(5) mnt | β+ | 118Te | 2− | ||||||||||||
| 118mI | 190,1(10) keV | 8,5(5) mnt | β+ | 118Te | (7−) | ||||||||||||||
| IT (langka) | 118I | ||||||||||||||||||
| 119I | 53 | 66 | 118,91007(3) | 19,1(4) mnt | β+ | 119Te | 5/2+ | ||||||||||||
| 120I | 53 | 67 | 119,910048(19) | 81,6(2) mnt | β+ | 120Te | 2− | ||||||||||||
| 120m1I | 72,61(9) keV | 228(15) ndtk | (1+, 2+, 3+) | ||||||||||||||||
| 120m2I | 320(15) keV | 53(4) mnt | β+ | 120Te | (7−) | ||||||||||||||
| 121I | 53 | 68 | 120,907367(11) | 2,12(1) jam | β+ | 121Te | 5/2+ | ||||||||||||
| 121mI | 2376,9(4) keV | 9,0(15) µdtk | |||||||||||||||||
| 122I | 53 | 69 | 121,907589(6) | 3,63(6) mnt | β+ | 122Te | 1+ | ||||||||||||
| 123I[n 9] | 53 | 70 | 122,905589(4) | 13,2235(19) jam | EC | 123Te | 5/2+ | ||||||||||||
| 124I[n 9] | 53 | 71 | 123,9062099(25) | 4,1760(3) hri | β+ | 124Te | 2− | ||||||||||||
| 125I[n 9] | 53 | 72 | 124,9046302(16) | 59,400(10) hri | EC | 125Te | 5/2+ | ||||||||||||
| 126I | 53 | 73 | 125,905624(4) | 12,93(5) hri | β+ (56,3%) | 126Te | 2− | ||||||||||||
| β− (43,7%) | 126Xe | ||||||||||||||||||
| 127I[n 10] | 53 | 74 | 126,904473(4) | Stabil[n 11] | 5/2+ | 1,0000 | |||||||||||||
| 128I | 53 | 75 | 127,905809(4) | 24,99(2) mnt | β− (93,1%) | 128Xe | 1+ | ||||||||||||
| β+ (6,9%) | 128Te | ||||||||||||||||||
| 128m1I | 137,850(4) keV | 845(20) ndtk | 4− | ||||||||||||||||
| 128m2I | 167,367(5) keV | 175(15) ndtk | (6)− | ||||||||||||||||
| 129I[n 10][n 12] | 53 | 76 | 128,904988(3) | 1,57(4)×107 thn | β− | 129Xe | 7/2+ | Renik[n 13] | |||||||||||
| 130I | 53 | 77 | 129,906674(3) | 12,36(1) jam | β− | 130Xe | 5+ | ||||||||||||
| 130m1I | 39,9525(13) keV | 8,84(6) mnt | IT (84%) | 130I | 2+ | ||||||||||||||
| β− (16%) | 130Xe | ||||||||||||||||||
| 130m2I | 69,5865(7) keV | 133(7) ndtk | (6)− | ||||||||||||||||
| 130m3I | 82,3960(19) keV | 315(15) ndtk | - | ||||||||||||||||
| 130m4I | 85,1099(10) keV | 254(4) ndtk | (6)− | ||||||||||||||||
| 131I[n 10][n 9] | 53 | 78 | 130,9061246(12) | 8,02070(11) hri | β− | 131Xe | 7/2+ | ||||||||||||
| 132I | 53 | 79 | 131,907997(6) | 2,295(13) jam | β− | 132Xe | 4+ | ||||||||||||
| 132mI | 104(12) keV | 1,387(15) jam | IT (86%) | 132I | (8−) | ||||||||||||||
| β− (14%) | 132Xe | ||||||||||||||||||
| 133I | 53 | 80 | 132,907797(5) | 20,8(1) jam | β− | 133Xe | 7/2+ | ||||||||||||
| 133m1I | 1634,174(17) keV | 9(2) dtk | IT | 133I | (19/2−) | ||||||||||||||
| 133m2I | 1729,160(17) keV | ~170 ndtk | (15/2−) | ||||||||||||||||
| 134I | 53 | 81 | 133,909744(9) | 52,5(2) mnt | β− | 134Xe | (4)+ | ||||||||||||
| 134mI | 316,49(22) keV | 3,52(4) mnt | IT (97,7%) | 134I | (8)− | ||||||||||||||
| β− (2,3%) | 134Xe | ||||||||||||||||||
| 135I[n 14] | 53 | 82 | 134,910048(8) | 6,57(2) jam | β− | 135Xe | 7/2+ | ||||||||||||
| 136I | 53 | 83 | 135,91465(5) | 83,4(10) dtk | β− | 136Xe | (1−) | ||||||||||||
| 136mI | 650(120) keV | 46,9(10) dtk | β− | 136Xe | (6−) | ||||||||||||||
| 137I | 53 | 84 | 136,917871(30) | 24,13(12) dtk | β− (92,86%) | 137Xe | (7/2+) | ||||||||||||
| β−, n (7,14%) | 136Xe | ||||||||||||||||||
| 138I | 53 | 85 | 137,92235(9) | 6,23(3) dtk | β− (94,54%) | 138Xe | (2−) | ||||||||||||
| β−, n (5,46%) | 137Xe | ||||||||||||||||||
| 139I | 53 | 86 | 138,92610(3) | 2,282(10) dtk | β− (90%) | 139Xe | 7/2+# | ||||||||||||
| β−, n (10%) | 138Xe | ||||||||||||||||||
| 140I | 53 | 87 | 139,93100(21)# | 860(40) mdtk | β− (90,7%) | 140Xe | (3)(−#) | ||||||||||||
| β−, n (9,3%) | 139Xe | ||||||||||||||||||
| 141I | 53 | 88 | 140,93503(21)# | 430(20) mdtk | β− (78%) | 141Xe | 7/2+# | ||||||||||||
| β−, n (22%) | 140Xe | ||||||||||||||||||
| 142I | 53 | 89 | 141,94018(43)# | ~200 mdtk | β− (75%) | 142Xe | 2−# | ||||||||||||
| β−, n (25%) | 141Xe | ||||||||||||||||||
| 143I | 53 | 90 | 142,94456(43)# | 100# mdtk [> 300 ndtk] | β− | 143Xe | 7/2+# | ||||||||||||
| 144I | 53 | 91 | 143,94999(54)# | 50# mdtk [> 300 ndtk] | β− | 144Xe | 1−# | ||||||||||||
| Header & footer tabel ini: | |||||||||||||||||||
- ^ mI – Isomer nuklir tereksitasi.
- ^ ( ) – Ketidakpastian (1σ) diberikan dalam bentuk ringkas dalam tanda kurung setelah digit terakhir yang sesuai.
- ^ # – Massa atom bertanda #: nilai dan ketidakpastian yang diperoleh bukan dari data eksperimen murni, tetapi setidaknya sebagian dari tren dari Permukaan Massa (trends from the Mass Surface, TMS).
- ^ a b c # – Nilai yang ditandai # tidak murni berasal dari data eksperimen, tetapi setidaknya sebagian dari tren nuklida tetangga (trends of neighboring nuclides, TNN).
- ^
Mode peluruhan:
EC: Penangkapan elektron IT: Transisi isomerik n: Emisi neutron p: Emisi proton - ^ Simbol miring tebal sebagai anak – Produk anak hampir stabil.
- ^ Simbol tebal sebagai anak – Produk anak stabil.
- ^ ( ) nilai spin – Menunjukkan spin dengan argumen penempatan yang lemah.
- ^ a b c d Memiliki kegunaan medis
- ^ a b c Produk fisi
- ^ Secara teoritis mampu mengalami fisi spontan
- ^ Dapat digunakan untuk penanggalan peristiwa awal tertentu dalam sejarah Tata Surya dan beberapa penggunaan penanggalan air tanah
- ^ Nuklida kosmogenik, juga ditemukan sebagai kontaminasi nuklir
- ^ Diproduksi sebagai produk peluruhan 135Te dalam reaktor nuklir, pada gilirannya meluruh menjadi 135Xe, yang jika dibiarkan menumpuk, dapat mematikan reaktor karena fenomena biji iodin
Radioisotop penting
Bagian ini membutuhkan rujukan tambahan agar kualitasnya dapat dipastikan. (Juli 2022) |
Radioisotop iodin disebut iodin radioaktif atau radioiodin. Terdapat lusinan radioiodin, tetapi sekitar setengah lusin dari merekalah yang paling menonjol dalam ilmu terapan seperti ilmu kehidupan dan tenaga nuklir, seperti yang dijelaskan di bawah ini. Penyebutan radioiodin dalam konteks pelayanan kesehatan lebih sering mengacu pada 131I daripada isotop lainnya.
Dari banyak isotop iodin, hanya dua yang biasanya digunakan dalam pengaturan medis: 123I dan 131I. Karena 131I memiliki mode peluruhan beta dan gama, ia dapat digunakan untuk radioterapi atau untuk pencitraan. 123I, yang tidak memiliki aktivitas beta, lebih cocok untuk pencitraan kedokteran nuklir rutin tiroid dan proses medis lainnya dan kurang merusak secara internal pada pasien. Ada beberapa situasi di mana 124I dan 125I juga digunakan dalam pengobatan.[3]
Karena pengambilan preferensi iodin oleh tiroid, radioiodin banyak digunakan dalam pencitraan dan, dalam kasus 131I, menghancurkan jaringan tiroid yang disfungsional. Jenis jaringan lain secara selektif mengambil penargetan jaringan yang mengandung 131I tertentu dan membunuh agen radiofarmasi (seperti MIBG). 125I adalah satu-satunya radioisotop iodin lain yang digunakan dalam terapi radiasi, tetapi hanya sebagai kapsul yang ditanamkan dalam brakiterapi, di mana isotop tidak pernah memiliki kesempatan untuk dilepaskan untuk interaksi kimia dengan jaringan tubuh.
Iodin-123 dan iodin-125
Isotop pemancar gama iodin-123 (waktu paruh 13 jam), dan (yang lebih jarang) iodin-125 yang berumur lebih panjang dan kurang energik (waktu paruh 59 hari) digunakan sebagai pelacak pencitraan nuklir untuk mengevaluasi anatomi dan fisiologis fungsi tiroid. Hasil yang abnormal dapat disebabkan oleh gangguan seperti penyakit Basedow atau tiroiditis Hashimoto. Kedua isotop ini meluruh dengan penangkapan elektron (electron capture, EC) menjadi nuklida telurium yang sesuai, tetapi dalam kedua kasus ini, tidak ada nuklida metastabil 123mTe dan 125mTe (yang memiliki energi lebih tinggi, dan tidak dihasilkan dari radioiodin). Sebaliknya, nuklida telurium yang tereksitasi langsung meluruh (waktu paruh mereka terlalu pendek untuk terdeteksi). Setelah EC, 123Te yang tereksitasi dari 123I memancarkan elektron konversi internal berkecepatan tinggi 127 keV (bukan sinar beta) sekitar 13% dari total waktu, tetapi ini tidak menyebabkan kerusakan seluler yang kecil karena waktu paruh nuklida yang pendek dan fraksi yang relatif kecil dari peristiwa semacam itu. Dalam sisa kasus ini, sinar gama 159 keV dipancarkan, yang sangat cocok untuk pencitraan gama.
125Te tereksitasi yang dihasilkan dari penangkapan elektron 125I juga memancarkan elektron konversi internal dengan energi yang jauh lebih rendah (35,5 keV), yang menyebabkan kerusakan yang relatif kecil karena energinya yang rendah, meskipun emisinya lebih umum. Energi gama yang relatif rendah dari peluruhan 125I/125Te kurang cocok untuk pencitraan, tetapi masih dapat dilihat, dan isotop yang berumur lebih panjang ini diperlukan dalam tes yang memerlukan pencitraan dalam beberapa hari, misalnya, pencitraan pemindaian fibrinogen untuk mendeteksi pembekuan darah.
Baik 123I maupun 125I memancarkan elektron Auger berenergi rendah yang berlebihan setelah peluruhannya, tetapi ini tidak menyebabkan kerusakan serius (pemutusan DNA untai ganda) dalam sel, kecuali nuklida digabungkan ke dalam obat yang terakumulasi dalam nukleus, atau ke dalam DNA (hal ini tidak pernah terjadi dalam kedokteran klinis, tetapi telah terlihat pada model hewan percobaan).[4]
125I juga biasa digunakan oleh ahli onkologi radiasi dalam brakiterapi tingkat dosis rendah dalam pengobatan kanker di tempat selain tiroid, terutama pada kanker prostat. Ketika 125I digunakan secara terapeutik, ia dikemas dalam biji titanium dan ditanamkan di area tumor, di mana ia tetap ada. Dalam hal ini, energi rendah dari spektrum gama membatasi kerusakan radiasi pada jaringan yang jauh dari kapsul yang ditanamkan. 125I, karena waktu paruhnya yang lebih lama dan spektrum gama yang lebih sedikit, juga sering lebih disukai untuk uji laboratorium yang mengandalkan iodin sebagai pelacak yang dihitung dengan pencacah gama, seperti dalam radioimunoasai.
125I digunakan sebagai radiolabel dalam menyelidiki ligan mana yang dituju reseptor pengenalan pola tanaman (pattern recognition receptors, PRRs).[5]
Iodin-124
Iodin-124 adalah isotop iodin yang kaya proton dengan waktu paruh 4,18 hari. Mode peluruhannya adalah: penangkapan elektron 74,4%, emisi positron 25,6%. 124I meluruh menjadi 124Te. 124I dapat dibuat dengan berbagai reaksi nuklir melalui siklotron. Bahan awal yang paling umum digunakan adalah 124Te.
124I sebagai garam iodida dapat digunakan untuk mencitrakan tiroid secara langsung menggunakan tomografi emisi positron (positron emission tomography, PET).[6] 124I juga dapat digunakan sebagai pelacak radioaktif PET dengan waktu paruh yang lebih lama dibandingkan dengan 18F.[7] Dalam penggunaan ini, nuklida ini secara kimia terikat pada farmasi untuk membentuk radiofarmasi pemancar positron, dan disuntikkan ke dalam tubuh, di mana lagi-lagi dicitrakan dengan pemindaian PET.
Iodin-129
Iodin-129 (waktu paruh 15,7 juta tahun) merupakan hasil spalasi sinar kosmik berbagai isotop xenon di atmosfer, interaksi muon sinar kosmik dengan 130Te, serta fisi uranium dan plutonium, baik pada batuan bawah permukaan dan reaktor nuklir. Proses nuklir buatan, khususnya pemrosesan ulang bahan bakar nuklir dan uji coba senjata nuklir di atmosfer, kini telah membanjiri sinyal alami untuk isotop ini. Namun demikian, ia sekarang berfungsi sebagai pelacak air tanah sebagai indikator dispersi limbah nuklir ke lingkungan alam. Dengan cara yang sama, 129I digunakan dalam studi air hujan untuk melacak produk fisi setelah bencana Chernobyl.
Dalam beberapa hal, 129I mirip dengan 36Cl. Ia adalah halogen yang larut, ada terutama sebagai anion yang tidak menyerap, dan diproduksi oleh reaksi kosmogenik, termonuklir, dan in-situ. Dalam studi hidrologi, konsentrasi 129I biasanya dilaporkan sebagai rasio 129I terhadap total I (yang hampir semuanya 127I). Seperti halnya dengan 36Cl/Cl, rasio 129I/I di alam cukup kecil, 10−14 hingga 10−10 (puncak termonuklir 129I/I selama 1960-an dan 1970-an mencapai sekitar 10−7). 129I berbeda dari 36Cl dalam hal waktu paruhnya yang lebih lama (15,7 vs. 0,301 juta tahun), sangat biofilik, dan terjadi dalam berbagai bentuk ionik (umumnya, I− dan IO3−), yang memiliki perilaku kimia yang berbeda. Hal ini membuat 129I cukup mudah memasuki biosfer karena tergabung ke dalam vegetasi, tanah, susu, jaringan hewan, dll. Kelebihan 129Xe yang stabil dalam meteorit telah terbukti sebagai akibat dari peluruhan 129I "primordial" yang diproduksi baru oleh supernova yang menciptakan debu dan gas yang membentuk Tata Surya. Isotop ini telah lama meluruh dan dengan demikian disebut sebagai "punah". Secara historis, 129I adalah radionuklida punah pertama yang diidentifikasi hadir di Tata Surya awal. Peluruhannya adalah dasar dari skema penanggalan radiometrik I-Xe iodin-xenon, yang mencakup 85 juta tahun pertama evolusi Tata Surya.
Iodin-131

Iodin-131 adalah isotop pemancar beta dengan waktu paruh delapan hari, dan radiasi beta yang relatif energik (rata-rata 190 keV dan energi maksimum 606 keV), yang menembus 0,6 hingga 2,0 mm dari tempat pengambilan. Radiasi beta ini dapat digunakan untuk penghancuran nodul tiroid atau hiperfungsi jaringan tiroid dan untuk menghilangkan sisa jaringan tiroid setelah operasi untuk pengobatan penyakit Basedow. Tujuan terapi ini, yang pertama kali dieksplorasi oleh Dr. Saul Hertz pada tahun 1941,[8] adalah untuk menghancurkan jaringan tiroid yang tidak dapat diangkat melalui pembedahan. Dalam prosedur ini, 131I diberikan baik secara intravena ataupun oral setelah pemindaian diagnostik. Prosedur ini juga dapat digunakan, dengan dosis radioiodin yang lebih tinggi, untuk mengobati pasien dengan kanker tiroid.
131I diambil ke dalam jaringan tiroid dan terkonsentrasi di sana. Partikel beta yang dipancarkan oleh radioisotop menghancurkan jaringan tiroid yang terkait dengan sedikit kerusakan pada jaringan sekitarnya (lebih dari 2,0 mm dari jaringan yang menyerap iodin). Karena penghancuran yang serupa, 131I adalah radioisotop iodin yang digunakan dalam radiofarmasi berlabel iodin yang larut dalam air lainnya (seperti MIBG) yang digunakan secara terapeutik untuk menghancurkan jaringan.
Radiasi beta energi tinggi (hingga 606 keV) dari 131I menyebabkannya menjadi isotop iodin yang paling karsinogenik. Ia diperkirakan menyebabkan sebagian besar kanker tiroid berlebih yang terlihat setelah kontaminasi fisi nuklir (seperti luruhan bom atau kecelakaan reaktor nuklir parah seperti bencana Chernobyl) Namun, efek epidemiologi tersebut terlihat terutama pada anak-anak, dan pengobatan orang dewasa dan anak-anak dengan 131I yang terapeutik, dan epidemiologi orang dewasa yang terpapar 131I dosis rendah belum menunjukkan karsinogenisitas.[9]
Iodin-135
Iodin-135 adalah isotop iodin dengan waktu paruh 6,6 jam. Ia adalah isotop penting dari sudut pandang fisika reaktor nuklir. Ia diproduksi dalam jumlah yang relatif besar sebagai produk fisi, dan meluruh menjadi 135Xe, yang merupakan racun nuklir dengan penampang neutron termal yang sangat besar, yang merupakan penyebab berbagai komplikasi dalam pengendalian reaktor nuklir. Proses penumpukan 135Xe dari akumulasi 135I untuk sementara dapat menghalangi reaktor yang dimatikan untuk dapat memulai kembali. Hal ini dikenal sebagai keracunan xenon atau "jatuh ke dalam biji iodin".
Iodin-128 dan isotop lainnya
Isotop hasil fisi iodin yang tidak dibahas di atas (iodin-128, iodin-130, iodin-132, dan iodin-133) memiliki waktu paruh beberapa jam atau menit, menjadikannya hampir tidak berguna di bidang lain yang dapat diterapkan. Mereka yang disebutkan di atas kaya akan neutron dan mengalami peluruhan beta menjadi isotop xenon. Iodin-128 (waktu paruh 25 menit) dapat meluruh menjadi 128Te melalui penangkapan elektron atau menjadi 128Xe melalui peluruhan beta. Ia memiliki radioaktivitas spesifik 2,177×106 TBq/g.
Iodida nonradioaktif (127I) sebagai perlindungan dari pengambilan radioiodin yang tidak diinginkan oleh tiroid
Bagian ini mungkin mengandung riset asli. |
Dalam bahasa sehari-hari, bahan radioaktif dapat digambarkan sebagai "panas," dan bahan non-radioaktif dapat digambarkan sebagai "dingin." Ada kasus di mana iodida dingin diberikan kepada orang-orang untuk mencegah penyerapan iodida panas oleh kelenjar tiroid. Misalnya, blokade pengambilan iodin tiroid dengan kalium iodida digunakan dalam skintigrafi kedokteran nuklir dan terapi dengan beberapa senyawa radioiodinasi yang tidak ditargetkan ke tiroid, seperti iobenguan (MIBG), yang digunakan untuk menggambarkan atau mengobati tumor jaringan saraf, atau fibrinogen iodinasi, yang digunakan dalam pemindaian fibrinogen untuk menyelidiki pembekuan. Senyawa-senyawa ini mengandung iodin, tetapi tidak dalam bentuk iodida. Namun, karena mereka pada akhirnya dapat dimetabolisme atau dipecah menjadi iodida radioaktif, adalah umum untuk memberikan kalium iodida non-radioaktif untuk memastikan bahwa metabolit dari radiofarmasi ini tidak diasingkan oleh kelenjar tiroid dan secara tidak sengaja memberikan dosis radiologis ke jaringan tersebut.
Kalium iodida telah didistribusikan ke populasi yang terkena kecelakaan fisi nuklir seperti bencana Chernobyl. Larutan iodida SSKI, saturated solution of potassium (K) iodide in water (larutan jenuh kalium iodida dalam air), telah digunakan untuk memblokir penyerapan radioiodin (tidak berpengaruh pada radioisotop lain dari fisi). Tablet yang mengandung kalium iodida sekarang juga diproduksi dan disimpan di lokasi pusat bencana oleh beberapa pemerintah untuk tujuan ini. Secara teori, banyak efek kanker akhir yang berbahaya dari luruhan nuklir dapat dicegah dengan cara ini, karena kelebihan kanker tiroid, mungkin karena penyerapan radioiodin, adalah satu-satunya efek kontaminasi radioisotop yang terbukti setelah kecelakaan fisi, atau dari kontaminasi oleh luruhan dari bom atom (radiasi cepat dari bom juga menyebabkan kanker lain, seperti leukemia, secara langsung). Mengambil sejumlah besar iodida akan menjenuhkan reseptor tiroid dan mencegah penyerapan sebagian besar radioaktif 131I yang mungkin ada dari paparan produk fisi (walaupun tidak melindungi dari radioisotop lain, atau dari bentuk radiasi langsung lainnya). Efek protektif KI berlangsung sekitar 24 jam, jadi harus diberikan setiap hari sampai risiko paparan signifikan terhadap radioiodin dari produk fisi tidak ada lagi.[10][11] 131I (radioiodin kontaminan yang paling umum pada luruhan) juga meluruh relatif cepat dengan waktu paruh delapan hari, sehingga 99,95% dari radioiodin asli telah hilang setelah tiga bulan.
Referensi
- ^ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure Appl. Chem. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ^ "Nuclear Data Evaluation Lab". Diarsipkan dari versi asli tanggal 21 Januari 2007. Diakses tanggal 8 Juli 2022.
- ^ Augustine George; James T Lane; Arlen D Meyers (17 Januari 2013). "Radioactive Iodine Uptake Testing". Medscape.
- ^ V. R. Narra; et al. (1992). "Radiotoxicity of Some Iodine-123, Iodine-125, and Iodine-131-Labeled Compounds in Mouse Testes: Implications for Radiopharmaceutical Design" (PDF). Journal of Nuclear Medicine. 33 (12): 2196–201. PMID 1460515.
- ^ Boutrot, Freddy; Zipfel, Cyril (4 Agustus 2017). "Function, Discovery, and Exploitation of Plant Pattern Recognition Receptors for Broad-Spectrum Disease Resistance". Annual Review of Phytopathology. Annual Reviews. 55 (1): 257–286. doi:10.1146/annurev-phyto-080614-120106. ISSN 0066-4286.
- ^ E. Rault; et al. (2007). "Comparison of Image Quality of Different Iodine Isotopes (I-123, I-124, and I-131)". Cancer Biotherapy & Radiopharmaceuticals. 22 (3): 423–430. doi:10.1089/cbr.2006.323. PMID 17651050.
- ^ BV Cyclotron VU, Amsterdam, 2016, Information on Iodine-124 for PET
- ^ Hertz, Barbara; Schuleller, Kristin (2010). "Saul Hertz, MD (1905 - 1950) A Pioneer in the Use of Radioactive Iodine". Endocrine Practice. 16 (4): 713–715. doi:10.4158/EP10065.CO. PMID 20350908.
- ^ Robbins, Jacob; Schneider, Arthur B. (2000). "Thyroid cancer following exposure to radioactive iodine". Reviews in Endocrine and Metabolic Disorders. 1 (3): 197–203. doi:10.1023/A:1010031115233. ISSN 1389-9155. PMID 11705004.
- ^ "Frequently Asked Questions on Potassium Iodide". BPOM AS. Diakses tanggal 8 Juli 2022.
- ^ "Potassium Iodide as a Thyroid Blocking Agent in Radiation Emergencies". Federal Register. BPOM AS. Diarsipkan dari versi asli tanggal 2 Oktober 2011. Diakses tanggal 8 Juli 2022.
- Massa isotop dari:
- Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- Komposisi isotop dan massa atom standar dari:
- de Laeter, John Robert; Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin J. R.; Taylor, Philip D. P. (2003). "Atomic weights of the elements. Review 2000 (IUPAC Technical Report)". Pure and Applied Chemistry. 75 (6): 683–800. doi:10.1351/pac200375060683
 .
. - Wieser, Michael E. (2006). "Atomic weights of the elements 2005 (IUPAC Technical Report)". Pure and Applied Chemistry. 78 (11): 2051–2066. doi:10.1351/pac200678112051
 .
.
- de Laeter, John Robert; Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin J. R.; Taylor, Philip D. P. (2003). "Atomic weights of the elements. Review 2000 (IUPAC Technical Report)". Pure and Applied Chemistry. 75 (6): 683–800. doi:10.1351/pac200375060683
- "News & Notices: Standard Atomic Weights Revised". International Union of Pure and Applied Chemistry. 19 Oktober 2005.
- Data waktu paruh, spin, dan isomer dipilih dari sumber-sumber berikut.
- Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- National Nuclear Data Center. "NuDat 2.x database". Laboratorium Nasional Brookhaven.
- Holden, Norman E. (2004). "11. Table of the Isotopes". Dalam Lide, David R. CRC Handbook of Chemistry and Physics (edisi ke-85). Boca Raton, Florida: CRC Press. ISBN 978-0-8493-0485-9.
