Kimia organotimah

Organotimah atau stanana adalah senyawa kimia berdasar timah dengan substituen hidrokarbon. Kimia organotimah adalah bagian dari bidang kimia organologam yang lebih luas. Senyawa organotimah pertama adalah dietiltimah diiodida ((C''";), ditemukan oleh Edward Frankland pada tahun 1849.[1] Bidang ini tumbuh dengan cepat pada tahun 1900-an, terutama setelah ditemukannya pereaksi Grignard, yang berguna untuk menghasilkan ikatan Sn-C. Bidang ini tetap kaya dengan banyak aplikasi di industri dan aktivitas berkelanjutan di laboratorium penelitian.[2]
Struktur senyawa organotimah
[sunting | sunting sumber]Senyawa organotimah umumnya diklasifikasikan sesuai tingkat oksidasinya. Senyawa timah(IV) adalah yang paling umum dan paling banyak kegunaannya.
Derivat organik timah(IV)
[sunting | sunting sumber]Derivat tetraorgano selalu tetrahedral. Senyawa tipe SnRR'RR' telah dipecahkan menjadi masing-masing enansiomernya.[3]
Halida organotimah
[sunting | sunting sumber]Organotimah klorida memiliki rumus R4−nSnCln dengan nilai n adalah 1 s/d 4. Bromida, iodida, dan fluorida juga diketahui tetapi kurang penting. Senyawa-senyawa ini dikenal karena banyaknya gugus R. Mereka selalu tetrahedral. Tri- dan dihalida membentuk aduk dengan basa Lewis yang baik seperti piridin. Fluoridanya cenderung berasosiasi sedemikian rupa sehingga dimetiltimah difluorida membentuk polimer seperti lembaran. Halida di- dan terutama triorganotimah, mis. T tributiltimah klorida, menunjukkan toksisitas mendekati hidrogen sianida.[4]
Hidrida organotimah
[sunting | sunting sumber]Hidrida organotimah memiliki rumus R4−nSnHn dengan nilai n sampai dengan 4. Anggota induk dari deret ini, stanana (SnH4), adalah gas tak berwarna yang tidak stabil. Kestabilannya berkorelasi dengan jumlah substituen organik. Tributiltimah hidrida digunakan sebagai sumber radikal hidrida dalam beberapa reaksi organik.
Oksida dan hidroksida organotimah
[sunting | sunting sumber]Oksida dan hidroksida organotimah adalah produk umum dari hidrolisis halida organotimah. Tidak seperti derivat kesesuaiannya dari silikon dan germanium, oksida dan hidroksida timah sering kali mengadopsi struktur dengan pusat timah penta- dan bahkan heksakoordinasi, terutama untuk turunan diorgano- dan monoorgano. Gugus Sn-O-Sn disebut stanoksana. Oksida dan hidroksida terstruktur paling sederhana adalah derivat triorganotimah. Suatu hidroksida triorganotimah yang penting secara komersial adalah akarisida Cyhexatin (disebut juga Plictran), (C)3SnOH. Hidroksida triorganotimah seperti itu ada dalam kesetimbangan dengan distanoksana:
- 2 R
 R + H
R + H
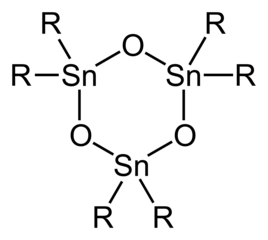
Dengan hanya dua substituen organik pada masing-masing pusat Sn, oksida dan hidroksida diorganotimah secara struktural lebih kompleks daripada turunan triorgano.[5] Geminal diol (R) dan monomer stananon (RSn=O) tidak diketahui. Oksida diorganotimah (R) adalah polimer kecuali jika substituen organiknya sangat besar, seperti dalam hal trimer siklik atau, dalam kasus R = dimer CH(SiMe''";, dengan cincin Sn dan Sn. Distanoksana berada sebagai dimer dari dimer dengan rumus [R''"; di mana gugus X (misalnya, klorida, hidroksida, karboksilat) dapat berupa terminal atau jembatan (lihat Tabel). Hidrolisis trihalida monoorganotimah berpotensi menghasilkan asam stananoat, RSnO. Sedangkan untuk oksida/hidroksida diorganotimah, spesies monoorganotimah membentuk kompleks struktural karena terjadinya dehidrasi/hidrasi, agregasi. Sebagai gambaran adalah hidrolisis butiltimah triklorida untuk menghasilkan [(BuSn)''";.
-
Struktur ideal trimer diorganotimah oksida.
-
Model bola-dan-tongkat untuk (t−
Bu''";. -
Struktur diorganotimah oksida, menyoroti ikatan intermolekul ekstensif.
Stanana hiperkoordinasi
[sunting | sunting sumber]Tidak seperti analog karbon(IV) tapi agak seperti senyawa silikon, timah(IV) juga bisa berkoordinasi menjadi lima dan bahkan enam atom, bukan empat seperti biasanya. Senyawa hiperkoordinasi ini biasanya memiliki substituen elektronegatif. Sejumlah contoh hipervalensi ditunjukkan oleh oksida organotimah dan karboksilat terkait serta turunan pseudohalida terkait.[5] Contoh aduk halida organotimah antara lain Me.
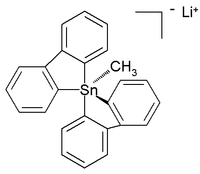
Semua penta- dan heksaorganostanat bahkan telah ditandai,[6] sementara pada tahun berikutnya dilaporkan senyawa tetraorganotimah enam koordinasi.[7] Struktur kristal seluruh karbon pentaorganostanana yang stabil pada suhu kamar (dalam argon) dilaporkan sebagai garam lithium dengan struktur berikut:[8]
Dalam struktur trigonal bipiramida terdistorsi ini, panjang ikatan karbon ke timah (2,26 Å apical; 2,17 Å ekuatorial) lebih besar daripada ikatan C-Sn reguler (2,14 Å). Hal ini mencerminkan sifat hipervalennya.
Kation triorganotimah
[sunting | sunting sumber]Beberapa reaksi halida triorganotimah melibatkan peran zat antara R. Kation semacam itu analog dengan karbokation. Mereka telah dikarakterisasi secara kristalografi untuk substituen organik yang besar, seperti 2,4,6-triisopropilfenil.[9]
Radikal timah (derivat organik dari timah(III))
[sunting | sunting sumber]Radikal timah, dengan rumus R3Sn, disebut radikal stanil.[2] Mereka berfungsi sebagai zat antara dalam reaksi pengalihan- atom tertentu. Misalnya, tributiltimah hidrida (tri-n-butil stanana) berfungsi sebagai sumber "atom hidrogen" yang berguna karena stabilitas radikal tributiltimah.[10]
Derivat organik dari timah(II)
[sunting | sunting sumber]Senyawa organotimah(II) agak langka. Senyawa dengan rumus empiris SnR2 agak rapuh dan berada sebagai cincin atau polimer bila R tidak besar. Polimernya, yang disebut polistanana, memiliki rumus (SnR''";n.
Pada prinsipnya senyawa timah divalen mungkin diharapkan membentuk analog alkena dengan ikatan ganda formal. Memang, senyawa dengan rumus Sn, disebut distanena, dikenal dengan substituen organik tertentu. Pusat Sn cenderung sangat piramidal. Senyawa monomer dengan rumus SnR2, analog dengan karbena, juga dikenal dalam beberapa kasus. Salah satu contohnya adalah Sn(SiR''";, dengan R adalah CH(SiMe''"; yang sangat besar (Me = metil). Spesies tersebut mengalami dimerisasi reversibel ke distanilena pada kristalisasi:[11]
- 2 R
 (R''";
(R''";
Stanena, senyawa dengan ikatan rangkap timah-karbon, dicontohkan oleh turunan stanabenzena. Stanola, analog struktural dari siklopentadiena, menunjukkan sedikit karakter ikatan ganda C-Sn.
Derivat organik dari timah(I)
[sunting | sunting sumber]Senyawa Sn(I) langka dan hanya teramati dengan ligan yang sangat besar. Salah satu keluarga khelat yang menonjol diakses dengan pirolisis tristanilena tersubstitusi 2,6-dietilfenil [Sn(C''";, yang menghasilkan cluster jenis kubana dan prismana. Khelat ini mengandung Sn(I) dan memiliki rumus [Sn(C''";n dengan n = 8, 10.[12] Sebuah stanuna berisi ikatan rangkap tiga karbon ke timah dan distanuna berisi sebuah ikatan rangkap tiga antara dua atom timah (RSn≡SnR). Distanuna hanya ada untuk substituen yang sangat besar. Tidak seperti alkuna, inti C-Sn-C dari distanuna ini tidak linier, meskipun planar. Jarak Sn-Sn adalah 3,066(1) Å, dan sudut Sn-Sn-C adalah 99.25(14)°. Senyawa tersebut dibuat dengan reduksi halida ariltimah(II) besar.[13]

Preparasi senyawa organotimah
[sunting | sunting sumber]Senyawa organotimah dapat disintesis dengan berbagai metode.[14] Klasiknya adalah reaksi pereaksi Grignard dengan halida timah misalnya timah tetraklorida. Contohnya adalah sintesis tetraetiltimah:[15]
- 4 EtMgBr + SnCl4 → Et4Sn + 4 MgClBr
Senyawa tetraorganotimah simetris, terutama turunan tetraalkil, kemudian dapat diubah menjadi berbagai macam campuran klorida melalui reaksi redistribusi (juga dikenal sebagai "komproporsionasi Kocheshkov" dalam kasus senyawa organotimah):
- 3 R4Sn + SnCl4 → 4 R3SnCl
- R4Sn + SnCl4 → 2 R
- R4Sn + 3 SnCl4 → 4 RSnCl3
Metode terkait melibatkan redistribusi timah halida dengan senyawa organoaluminium.
Senyawa campuran timah organo-halo dapat dikonversi menjadi campuran turunan organik, seperti yang digambarkan pada sintesis dibutildiviniltimah:[16]
- Bu + 2 C → Bu + 2 MgBrCl
Hidrida organotimah dihasilkan dengan mereduksi campuran klorida alkil. Sebagai contoh, perlakuan dibutiltimah diklorida dengan litium aluminium hidrida menghasilkan dibutiltimah dihidrida, minyak tak berwarna yang dapat disuling:[17]
Reaksi penggabungan ala Wurtz antara senyawa alkil natrium dengan halida timah menghasilkan senyawa tetraorganotimah.
Reaksi senyawa organotimah
[sunting | sunting sumber]Reaksi penting, yang dibahas di atas, biasanya berfokus pada halida organotimah dan pseudohalida dengan nukleofil. Dalam bidang sintesis organik, reaksi Stille dianggap penting. Ini memerlukan reaksi penggandengan dengan halida organik terhibridisasi sp2 yang dikatalisis oleh paladium:
dan adisi organostanana (adisi nukleofilik alil-, alenil-, atau propargilstanana menjadi suatu aldehida dan imina). Senyawa organotimah juga digunakan secara luas dalam kimia radikal (misalnya, siklisasi radikal, deoksigenasi Barton–McCombie, dekarboksilasi Barton, dll.).
Aplikasi
[sunting | sunting sumber]Senyawa organotimah secara komersial digunakan sebagai stabilisator dalam polivinil klorida. Dalam kapasitas ini, mereka menekan degradasi dengan menghilangkan gugus klorida alilik dan dengan menyerap hidrogen klorida. Aplikasi ini menghabiskan sekitar 20.000 ton timah setiap tahunnya. Kelas utama senyawa organotimah adalah diorganotimah ditiolat dengan rumus R. Ikatan Sn-S adalah komponen reaktif. Karboksilat diorganotimah, misalnya, dibutiltimah dilaurat, digunakan sebagai katalis untuk pembentukan poliuretan, untuk vulkanisasi silikon, dan transesterifikasi.[2]
n-Butiltimah triklorida digunakan dalam produksi lapisan timah dioksida pada botol kaca melalui deposisi uap kimia.
Aplikasi biologis
[sunting | sunting sumber]"Tributiltimah" digunakan sebagai biosida industri, misalnya sebagai zat antijamur pada tekstil dan kertas, pulp kayu dan sistem pabrik kertas, pabrik bir, serta sistem pendinginan industri. Turunan-turunan trifeniltimah digunakan sebagai komponen aktif cat antijamur dan fungisida pertanian. Triorganotimah lainnya digunakan sebagai mitisida dan akarisida. Tributiltimah oksida telah banyak digunakan sebagai pengawet kayu.[2][2]
Senyawa tributiltimah pernah banyak digunakan sebagai zat anti-biofouling untuk meningkatkan efisiensi kapal laut. Kekhawatiran atas toksisitas[18] senyawa ini (beberapa laporan menggambarkan efek biologis terhadap kehidupan laut pada konsentrasi 1 nanogram per liter) menyebabkan larangan di seluruh dunia oleh Organisasi Maritim Internasional.
Kompleks organotimah telah dipelajari sebagai terapi antikanker.[19]
- Senyawa organotimah
-
Minyak tak berwarna tributiltimah, prekursor untuk senyawa butil-timah lainnya
-
Tributiltimah oksida, larutan tak berwarna sampai kuning pucat yang digunakan dalam pengawetan kayu
-
Trifeniltimah klorida, padatan putih yang sangat beracun, digunakan sebagai biosida
-
Trimetiltimah klorida, suatu padatan putih beracun, pernah digunakan sebagai biosida
-
Trifeniltimah hidroksida, suatu serbuk putih, digunakan sebagai fungisida
-
Azosiklotin, sebuah padatan putih, digunakan sebagai akarisida untuk mengendalikan tungau laba-laba pada tanaman
-
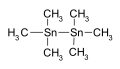
Heksametilditimah digunakan sebagai perantara dalam sintesis kimia
Toksisitas
[sunting | sunting sumber]Senyawa triorganotimah bisa sangat beracun. Tri-n-alkiltimah adalah fitotoksik dan oleh karena itu tidak dapat digunakan di pertanian. Bergantung pada kelompok organik, mereka bisa menjadi bakterisida dan fungisida yang kuat. Merefleksikan bioaktivitas mereka yang tinggi, "tributiltimah" pernah digunakan dalam cat anti-fouling di laut.[2]
Senyawa tetraorgano-, diorgano-, dan monoorganotimah umumnya menunjukkan toksisitas rendah dan aktivitas biologis rendah. Namun DBT mungkin bersifat imunotoksik.[21]
Lihat juga
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Caseri, Walter (2014). "Initial Organotin Chemistry". Journal of Organometallic Chemistry. 751: 20–24. doi:10.1016/j.jorganchem.2013.08.009.
- ^ a b c d e f Davies, Alwyn George (2004), Organotin Chemistry (edisi ke-2nd), Weinheim: Wiley-VCH, ISBN 978-3-527-31023-4
- ^ Gielen, Marcel (1973). "From kinetics to the synthesis of chiral tetraorganotin compounds". Acc. Chem. Res. 6: 198–202. doi:10.1021/ar50066a0.
- ^ Graf, G.G. (2005), "Tin, Tin Alloys, and Tin Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a27_049
- ^ a b Chandrasekhar, Vadapalli; Nagendran, Selvarajan; Baskar, Viswanathan (2002). "Organotin assemblies containing Sn/O bonds". Coordination Chemistry Reviews. 235: 1–52. doi:10.1016/S0010-8545(02)00178-9.
- ^ Reich, Hans J.; Phillips, Nancy H. (1986). "Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes". J. Am. Chem. Soc. 108: 2102. doi:10.1021/ja00268a067.
- ^ V. G. Kumar Das; Lo Kong Mun; Chen Wei; Thomas C. W. Mak (1987). "Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound". Organometallics. 6: 10. doi:10.1021/om00144a003.
- ^ Masaichi Saito; Sanae Imaizumi; Tomoyuki Tajima; Kazuya Ishimura & Shigeru Nagase (2007). "Synthesis and Structure of Pentaorganostannate Having Five Carbon Substituents". J. Am. Chem. Soc. 129: 10974–10975. doi:10.1021/ja072478.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ RajanBabu, T.V.; Page, P.C.B.; Buckley, B.R. (2004), "Tri-n-butylstannane", e-EROS Encyclopedia of Reagents for Organic Synthesis, doi:10.1002/047084289X.rt181.pub2
- ^ Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ^ Sita, Lawrence R. (1994). "Heavy-Metal Organic Chemistry: Building with Tin". Acc. Chem. Res. 27: 191–197. doi:10.1021/ar00043a002.
- ^ Power, Philip P. (2007). "Bonding and Reactivity of Heavier Group 14 Element Alkyne Analogues". Organometallics. 26: 4362–4372. doi:10.1021/om700365p.
- ^ Sander H.L. Thoonen; Berth-Jan Deelman; Gerard van Koten (2004). "Synthetic aspects of tetraorganotins and organotin(IV) halides" (PDF). Journal of Organometallic Chemistry (689): 2145–2157.
- ^ Der Kerk, G. J. M. Van; Luijten, J. G. A. (1956). "Tetraethyltin". Org. Synth. 36: 86ff. doi:10.15227/orgsyn.036.0086.
- ^ Seyferth, Dietmar (1959), "Di-n-butyldivinyltin", Org. Synth, 39: 10, doi:10.15227/orgsyn.039.0010
- ^ John Eisch, ed. (1981), Organometallic Syntheses: Nontransition-Metal Compounds, New York: Academic Press, ISBN 0122349504
- ^ Gajda, M.; Jancso, A. (2010). "Organotins, formation, use, speciation and toxicology". Metal ions in life sciences. Cambridge: RSC publishing. 7, Organometallics in environment and toxicology. ISBN 9781847551771.
- ^ S. Gómez-Ruiz; et al. (2008). "Study of the cytotoxic activity of di and triphenyltin(IV) carboxylate complexes". Journal of Inorganic Biochemistry. 102 (12): 2087–96. doi:10.1016/j.jinorgbio.2008.07.009. PMID 18760840.
- ^ Organic Syntheses, Coll. Vol. 4, p.881 (1963); Vol. 36, p.86 (1956). Link
- ^ C Gumy; et al. (2008). "Dibutyltin Disrupts Glucocorticoid Receptor Function and Impairs Glucocorticoid-Induced Suppression of Cytokine Production". PLoS ONE. 3: e3545. Bibcode:2008PLoSO...3.3545G. doi:10.1371/journal.pone.0003545. PMC 2568824
 . PMID 18958157.
. PMID 18958157.
Pranala luar
[sunting | sunting sumber]- (Inggris) National Pollutant Inventory Fact Sheet for organotins Diarsipkan 2006-04-11 di Wayback Machine.
- (Inggris) Industry information site
- (Inggris) Organotin chemistry in synthesis





![Stille reaction scheme {\displaystyle {\ce {R-X+R'-SnR''_{3}->[{\ce {katalis\ Pd}}]R-R'+XSnR''_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a379aef94a3faa5a650044dd11466554c89a8b3)







![Tetraetiltimah, titik didih 63–65° /12 mm adalah suatu katalis[20]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1e/Tetraethyltin.svg/120px-Tetraethyltin.svg.png)