Abakavir
| |
|---|---|
| |
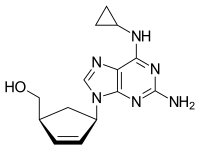
| Struktur kimia dari Abakavir | |
| Nama sistematis (IUPAC) | |
| {(1S,4R)-4-[2-amino-6-(cyclopropylamino)-9H-purin-9-yl]cyclopent-2-en-1-yl}methanol | |
| Data klinis | |
| Nama dagang | Ziagen |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a699012 |
| Kat. kehamilan | B3(AU) C(US) |
| Status hukum | POM (UK) ℞-only (US) |
| Rute | Peroral (larutan atau tablet) |
| Data farmakokinetik | |
| Bioavailabilitas | 83% |
| Metabolisme | Hepatik |
| Waktu paruh | 1.54 ± 0.63 jam |
| Ekskresi | Renal (1.2% abakavir, 30% metabolit 5'-asam karboksilat, 36% metabolit 5'-glukuronida, 15% metabolit minor tak diketahui). Feses (16%) |
| Pengenal | |
| Nomor CAS | 136470-78-5 |
| Kode ATC | J05AF06 |
| PubChem | CID 441300 |
| DrugBank | DB01048 |
| ChemSpider | 390063 |
| UNII | WR2TIP26VS |
| KEGG | D07057 |
| ChEBI | CHEBI:421707 |
| ChEMBL | CHEMBL1380 |
| NIAID ChemDB | AIDSNO:028596 |
| Data kimia | |
| Rumus | C14H18N6O |
| Massa mol. | 286.332 g/mol |
| SMILES | eMolecules & PubChem |
| |
| Data fisik | |
| Titik lebur | 165 °C (329 °F) |
Abakavir (ABC) merupakan obat antiretroviral yang digunakan untuk mencegah dan mengobati HIV/AIDS.[1] Galur virus yang resisten terhadap zidovudin (AZT) atau lamivudin (3TC) umumnya sensitif terhadap abakavir, walau tidak selalu demikian.
Obat ini dapat ditoleransi baik oleh tubuh. Efek samping utama dalam penggunaan obat ini adalah hipersensitivitas, yang dalam beberapa kejadian dapat menjadi parah dan hingga kematian. Hasil dari pengujian genetik pada manusia menunjukkan lebih dari 90% orang dapat mengonsumsi abakavir dengan aman tanpa adanya kemungkinan terjadi hipersensitivitas. Abakavir adalah salah satu obat golongan penghambat transkriptase balik analog nukleosida (NRTI) dengan kelas nukleosida karbosiklik.
Abakavir terdapat dalam daftar obat penting Organisasi Kesehatan Dunia (WHO), obat penting yang diperlukan dalam sistem kesehatan yang mendasar.[2] Obat ini tersedia dalam berbagai kombinasi dengan obat lainnya seperti abakavir/lamivudin/zidovudin, abakavir/dolutegravir/lamivudin, dan abakavir/lamivudin. Per tahun 2015 biaya untuk pengobatan bulanan dengan obat ini di Amerika Serikat mencapai lebih dari 200 USD.[3]
Kegunaan medis
[sunting | sunting sumber]
Tablet dan larutan peroral abakavir, dalam bentuk kombinasi dengan obat antiretroviral lain digunakan untuk pengobatan infeksi HIV-1.
Abakavir harus selalu digunakan dalam bentuk kombinasi dengan obat antiretroviral. Abakavir sebaiknya tidak diberikan dalam bentuk tunggal ketika regimen obat antiretroviral diganti karena menyebabkan hilangnya respons obat terhadap virus.
Efek samping
[sunting | sunting sumber]Reaksi yang umum terjadi antara lain mual, sakit kepala, rasa lelah, muntah, reaksi hipersensitivitas, diare, demam/meriang, depresi, ruam, rasa cemas, hipertrigliseridemia, dan lipodistrofi.[4]
Pasien dengan gangguan hati dianjurkan untuk berhati-hati dalam mengonsumsi abakavir karena dapat memperparah kondisi hati. Penggunaan obat-obatan analog nukleosida seperti abakavir dapat menyebabkan asidosis laktat walau kemungkinannya sangat jarang. Resistensi terhadap abakavir telah terjadi pada HIV yang diberikan perlakuan khusus di laboratorium, HIV tersebut juga resisten terhadap antiretrovirus spesifik-HIV lain seperti lamivudin, didanosin dan zalsitabin. Galur HIV yang resisten terhadap penghambat protease kemungkinan tidak akan resisten terhadap abakavir.
Abacavir dikontraindikasikan untuk penggunaan pada bayi dengan umur di bawah 3 bulan.
Hanya sedikit yang diketahui tentang efek dari overdosis abakavir. Pasien yang overdosis harus dibawa ke rumah sakit untuk perawatan lebih lanjut.
Sindrom hipersensitivitas
[sunting | sunting sumber]Hipersensitivitas setelah pemberian abakavir sangat terkait dengan alel spesifik pada salah satu lokus di antigen leukosit manusia B yaitu HLA-B*57:01.[5][6] Terdapat hubungan antara prevalensi dari HLA-B*5701 dan keturunan. Prevalensi dari alel diperkirakan rata-rata sekitar 3,4-5,8% pada populasi keturunan Eropa, 17,6% di India Amerika, 3,0% pada Hispanik Amerika, dan 1,2% di Tionghoa Amerika.[7][8] Terdapat keberagaman yang signifikan pada prevalensi dari HLA-B*5701 di antara populasi Afrika. Pada Afrika Amerika, prevalensi diperkirakan rata-rata 1,0%, 0% pada Yoruba dari Nigeria, 3,3% pada Luhya dari Kenya, dan 13,6% pada Masai dari Kenya.[9]
Gejala umum sindrom hipersensitivitas abakavir meliputi demam, rasa lemas, mual, dan diare; beberapa pasien juga mungkin mengalami ruam pada kulit.[10] Gejala dari hipersensitivitas ini biasanya muncul dalam waktu enam minggu pengobatan menggunakan abakavir. Gejala hipersensitivitas ini sangat mirip dengan gejala HIV.[11] FDA merilis peringatan mengenai abakavir dan obat-obatan mengandung abakavir lainnya pada 24 Juli 2008,[12] dan merekomendasikan untuk skrining alel HLA-B*5701 sebelum penggunaan abakavir, dan menggunakan terapi alternatif lain jika pasien mempunyai alel tersebut.[13] Selain itu, Clinical Pharmacogenetics Implementation Consortium (CPIC) dan Dutch Pharmacogenetics Working Group (DPWG) juga merekomendasikan hal yang serupa.[14][15]

Pengujian reaksi kulit juga dapat digunakan untuk menentukan apakah individu akan mengalami reaksi hipersensitivitas terhadap abakavir, hanya saja beberapa pasien yang kemungkinan mengalami reaksi hipersensitivitas tidak memberikan reaksi pada uji tempel.[16]
Pasien yang diduga menunjukkan reaksi hipersensitivitas terhadap abakavir harus segera menghentikan penggunaan abakavir, termasuk bagi pasien yang tidak memiliki alel HLA-B*5701. Pada 1 Maret 2011, FDA memberitahukan kepada masyarakat umum tentang peninjauan keamanan abakavir yang sedang berlangsung dan kemungkinan dapat meningkatkan risiko serangan jantung yang berhubungan dengan obat ini. Namun, dari hasil meta-analisis dari 26 studi yang dilakukan oleh FDA tidak menemukan adanya hubungan antara penggunaan abakavir dan risiko serangan jantung[17][18]
Imunopatogenesis
[sunting | sunting sumber]Mekanisme yang mendasari sindrom hipersensitivitas terhadap abakavir terkait dengan perubahan pada produk protein dari HLA-B*5701. Abakavir mengikat protein HLA-B*5701 dengan spesifisitas yang tinggi, mengubah bentuk dan sifat kimia dari celah pengikatan-antigen. Hal ini menghasilkan perubahan dalam toleransi imunologis dan aktivasi segera dari sel T sitotoksik yang spesifik terhadap abakavir, yang mengakibatkan reaksi hipersensitivitas.[19]
Mekanisme aksi obat
[sunting | sunting sumber]ABC merupakan nukleosida karbosiklik purina kiral, dan merupakan prodrug dari analog guanosin (-) karbovir.[20] Obat ini menghambat enzim transkriptase balik dari virus. ABC secara intraselular dikonversikan menjadi bentuk trifosfat dari (-)karbovir yang berkompetisi dengan guanosin trifosfat untuk bergabung dengan untai DNA. Ketika transkriptase balik disisipkan metabolit aktif dari ABC yaitu (-)karbovir triphosphate, transkripsi berhenti karena tidak ada gugus 3' hidroksil pada molekul untuk membentuk ikatan fosfodiester pada nukleotida di sekuens DNA.[21]
Farmakokinetika
[sunting | sunting sumber]Abakavir diberikan secara peroral dan memiliki bioavailabilitas yang tinggi (83%). Abakavir dimetabolisme melalui alkohol dehidrogenase atau glukuronil transferase. Abakavir mampu melewati sawar darah otak.
Sejarah
[sunting | sunting sumber]Penggunaan abakavir telah disetujui oleh Food and Drug Administration (FDA) pada 18 Desember 1998 dan dengan demikian menjadi obat antiretrovirus ke-15 yang disetujui di Amerika Serikat. Patennya di Amerika Serikat berakhir pada 26 Desember 2009.
Robert Vince, Susan Daluge, dan Mei Hua mengembangkan obat ini pada tahun 80-an.[22][23][20]
Sintesis
[sunting | sunting sumber]
Referensi
[sunting | sunting sumber]- ^ "Abacavir Sulfate". The American Society of Health-System Pharmacists. Diakses tanggal 31 July 2015.
- ^ "WHO Model List of EssentialMedicines" (PDF). World Health Organization. October 2013. Diakses tanggal 22 April 2014.
- ^ Hamilton, Richart (2015). Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition. Jones & Bartlett Learning. hlm. 64. ISBN 9781284057560.
- ^ "abacavir Adverse Reactions - Epocrates Online". online.epocrates.com.
- ^ Mallal, S., Phillips, E., Carosi, G.; et al. (2008). "HLA-B*5701 screening for hypersensitivity to abacavir". New England Journal of Medicine. 358 (6): 568–579. doi:10.1056/nejmoa0706135. PMID 18256392.
- ^ Rauch, A., Nolan, D., Martin, A.; et al. (2006). "Prospective genetic screening decreases the incidence of abacavir hypersensitivity reactions in the Western Australian HIV cohort study". Clinical Infectious Diseases. 43 (1): 99–102. doi:10.1086/504874. PMID 16758424.
- ^ Heatherington; et al. (2002). "Genetic variations in HLA-B region and hypersensitivity reactions to abacavir". Lancet. 359 (9312): 1121–1122. doi:10.1016/s0140-6736(02)08158-8. PMID 11943262.
- ^ Mallal; et al. (2002). "Association between presence of HLA*B5701, HLA-DR7, and HLA-DQ3 and hypersensitivity to HIV-1 reverse-transcriptase inhibitor abacavir". Lancet. 359 (9308): 727–732. doi:10.1016/s0140-6736(02)07873-x. PMID 11888582.
- ^ Rotimi, C.N.; Jorde, L.B. (2010). "Ancestry and disease in the age of genomic medicine". New England Journal of Medicine. 363 (16): 1551–1558. doi:10.1056/nejmra0911564. PMID 20942671.
- ^ Phillips, E., Mallal, S. (2009). "Successful translation of pharmacogenetics into the clinic". Molecular Diagnosis & Therapy. 13: 1–9. doi:10.1007/bf03256308.
- ^ Phillips, E., Mallal S. (2007). "Drug hypersensitivity in HIV". Current Opinion in Allergy and Clinical Immunology. 7 (4): 324–330. doi:10.1097/aci.0b013e32825ea68a. PMID 17620824.
- ^ http://www.fda.gov/drugs/drugsafety/postmarketdrugsafetyinformationforpatientsandproviders/ucm123927.htm Accessed November 29, 2013.
- ^ http://dailymed.nlm.nih.gov/dailymed/lookup.cfm?setid=ca73b519-015a-436d-aa3c-af53492825a1
- ^ Swen JJ, Nijenhuis M, de Boer A, et al. (May 2011). "Pharmacogenetics: from bench to byte--an update of guidelines". Clin Pharmacol Ther. 89 (5): 662–73. doi:10.1038/clpt.2011.34. PMID 21412232.
- ^ Martin MA, Hoffman JM, Freimuth RR, et al. (May 2014). "Clinical Pharmacogenetics Implementation Consortium Guidelines for HLA-B Genotype and Abacavir Dosing: 2014 update". Clin Pharmacol Ther. 95 (5): 499–500. doi:10.1038/clpt.2014.38. PMC 3994233
 . PMID 24561393.
. PMID 24561393.
- ^ Shear, N.H., Milpied, B., Bruynzeel, D.P.; et al. (2008). "A review of drug patch testing and implications for HIV clinicians". AIDS. 22 (9): 999–1007. doi:10.1097/qad.0b013e3282f7cb60. PMID 18520343.
- ^ http://www.drugs.com/fda/abacavir-ongoing-safety-review-possible-increased-risk-heart-attack-12914.html Accessed November 29, 2013.
- ^ Ding X, Andraca-Carrera E, Cooper C, et al. (December 2012). "No association of abacavir use with myocardial infarction: findings of an FDA meta-analysis". J Acquir Immune Defic Syndr. 61 (4): 441–7. doi:10.1097/QAI.0b013e31826f993c. PMID 22932321.
- ^ Illing, PT; et al. (2012). "Immune self-reactivity triggered by drug-modified HLA-peptide repertoire". Nature. doi:10.1038/nature11147.
- ^ a b Daluge SM, Good SS, Faletto MB, Miller WH, St Clair MH, Boone LR, Tisdale M, Parry NR, Reardon JE, Dornsife RE, Averett DR (May 1997). "1592U89, a novel carbocyclic nucleoside analog with potent, selective anti-human immunodeficiency virus activity". Antimicrobial agents and chemotherapy. 41 (5): 1082–1093. PMC 163855
 . PMID 9145874.
. PMID 9145874.
- ^ The Pharmacological Basics of Therapeutics, 12th Ed. Goodman and Gilman
- ^ "Dr. Robert Vince - 2010 Inductee". Minnesota Inventors Hall of Fame. Minnesota Inventors Hall of Fame. Diarsipkan dari versi asli tanggal 2016-02-15. Diakses tanggal 10 February 2016.
- ^ Vince, R. University of Minnesota. University of Minnesota http://drugdesign.umn.edu/bio/cdd-faculty-staff/robert-vince. Tidak memiliki atau tanpa
|title=(bantuan) - ^ Crimmins, M. T.; King, B. W. (1996). "An Efficient Asymmetric Approach to Carbocyclic Nucleosides: Asymmetric Synthesis of 1592U89, a Potent Inhibitor of HIV Reverse Transcriptase". The Journal of Organic Chemistry. 61 (13): 4192–4193. doi:10.1021/jo960708p. PMID 11667311.
