Reaksi Baylis-Hillman
Reaksi Baylis-Hillman adalah sebuah reaksi organik dari aldehida dengan gugus penarik elektron α,β-takjenuh yang dikatalisasi oleh DABCO (1,4-diazabisiklo[2.2.2]oktana), menghasilkan alkohol alilik [1]. Reaksi ini juga dikenal sebagai reaksi Morita-Baylis-Hillman atau reaksi MBH [2]. Nama ini berasal dari kimiawan Jepang, Kenichi Morita, dan kimiawan Jerman, Anthony B. Baylis dan Melville E. D. Hillman.
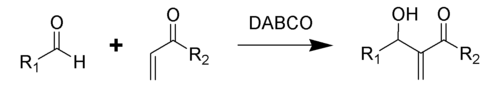
Selain DABCO, amina nukleofilik seperti DMAP, DBU, dan fosfina juga ditemukan dapat mengkatalisasi reaksi ini.
Mekanisme reaksi
Adisi nukleofilik DABCO 2 ke keton α,β-takjenuh 1 menghasilkan zat antara 3 yang bersifat zwitterion, yang kemudian akan mengalami adisi ke aldehida yang elektrofilik, menghasilkan keto-alkohol 4. Reaksi eliminasi dari DABCO menghasilkan alkohol alilik 5 yang diinginkan.

Terdapat sebuah hubungan yang sederhana antara pKa basa (sebagai konjugat asam) dengan laju reaksi. Kuinuklidina bahkan lebih efektif daripada DABCO. Aditif protik seperti metanol, trietanolamina, formida, dan air juga mempercepat reaksi[3].
Mekanisme alternatif, yang didasarkan pada data laju yang ekstensif, telah diajukan untuk beberapa aldehida.[4] [5] [6]. Mekanisme ini (lihat gambar di bawah), melibatkan kinetika berorde dua yang ditentukan secara eksperimen untuk aldehida dan efek isotop kinetik yang substansial untuk proton alfa enon. Pada mekanisme ini, molekul aldehida kedua beraksi membentuk sebuah hemiasetal (4) dan langkah ini diikuti dengan transfer proton yang menentukan laju reaksi, menghasilkan zat antara 5.

Eksperimen secara in silico mengkonfirmasikan mekanisme ini [7] dan juga menjelaskan bagaimana sebuah aditif protik dapat meningkatkan laju reaksi dengan memfasilitasi langkah transfer proton.
Reaksi lain yang terkait, yang sebenarnya lebih awal daripada reaksi Baylis-Hillman, menggunakan fosfina dan bukannya DABCO. Reaksi ini dikenal sebagai reaksi Rauhut-Currier.
Ruang lingkup
Reaksi MHB secara umum adalah reaksi alkena yang kekurangan elektron dengan elektrofil karbon yang memiliki hibridisasi sp2, misalnya aldehida, keton, dan aldimina, yang dikatalisasi oleh sebuah nukleofil. Di bawah kondisi reaksi yang khusus, reaksi ini juga ditemukan pada alkil halida sebagai reagen elektrofilik [8]. Pada variasi ini, nukleofil amina tidaklah cocok dan digunakan trialkil fosfina. Di bawah reaksi kondisi yang diberikan, fosfina ini tidak bereaksi secara langsung dengan alkil halida. Basa yang ditambahkan pada langkah kedua reaksi ini mempromosikan reaksi eliminasi enon.

Pada reaksi aza-Bayliss Hillman, elektrofilnya adalah imina.[9]
Batasan
Reaksi MBH dari fenil vinil keton dengan benzaldehida dan DABCO dalam DMF tidak terbatas pada produk monoaduk (monoadduct), karena aduk MBC bereaksi dengan molekul kedua fenil vinil keton pada adisi konjugat nukleofilik [10].
Referensi
- ^ Baylis, A. B.; Hillman, M. E. D. German Patent 2155113, 1972.
- ^ K. Morita, Z. Suzuki and H. Hirose, Bull. Chem. Soc. Jpn.,1968, 41, 2815.
- ^ Correlation between pKa and Reactivity of Quinuclidine-Based Catalysts in the Baylis-Hillman Reaction: Discovery of Quinuclidine as Optimum Catalyst Leading to Substantial Enhancement of Scope Aggarwal, V. K.; Emme, I.; Fulford, S. Y. J. Org. Chem. (Article); 2003; 68(3); 692-700. doi:10.1021/jo026671s
- ^ Baylis-Hillman Mechanism: A New Interpretation in Aprotic Solvents Price, K. E.; Broadwater, S. J.; Jung, H. M.; McQuade, D. T.; Org. Lett., 2005, 7(1), 147-150. doi:10.1021/ol047739o
- ^ A New Interpretation of the Baylis-Hillman Mechanism Price, K. E.; Broadwater, S. J.; Walker, B. J.; McQuade, D. T. J. Org. Chem. (Article); 2005; 70(10); 3980-3987. doi:10.1021/jo050202j
- ^ Synthetic potential of the tertiary-amine-catalysed reaction of activated vinyl carbanions with aldehydes Drewes, S. E.; Roos, G. H. P.; Tetrahedron 1988, 44, 4653-4670. doi:10.1016/S0040-4020(01)86168-8
- ^ Mechanism of the Morita-Baylis-Hillman Reaction: A Computational Investigation Raphael Robiette, Varinder K Aggarwal, and Jeremy N. Harvey J. AM. CHEM. SOC. 2007, 129, 15513-15525 doi:10.1021/ja0717865
- ^ Unprecedented reactivity in the Morita–Baylis–Hillman reaction; intramolecular -alkylation of enones using saturated alkyl halides Marie E. Krafft, Kimberly A. Seibert, Thomas F. N. Haxell and Chitaru Hirosawa Chemical Communications, 2005, (46), 5772 - 5774 DOI: 10.1039/b512665g Abstract
- ^ Enantioselective aza-Baylis-Hillman Reaction Vasco D.B. Bonifacio, Org. Chem. Highlights, 2006, Full Article
- ^ Different Reaction Patterns in the Baylis-Hillman Reaction of Aryl Aldehydes with Phenyl Vinyl Ketone, Phenyl Acrylate and Phenyl Thioacrylate Min Shi, Chao-Qun Li and Jian-Kang Jiang Molecules 2002, 7, 721-733 Full Article
