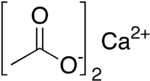
Kalsium asetat

| |
| |
| Nama | |
|---|---|
| Nama IUPAC
Kalsium etanoat
| |
| Nama lain
Asetat kapur
Kalsium diasetat | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Singkatan | Ca(OAc)2 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C4H6CaO4 | |
| Massa molar | 158,17 g·mol−1 |
| Penampilan | Padatan putih higroskopis |
| Bau | berbau mirip asam asetat |
| Densitas | 1,509 g/cm3 |
| Titik lebur | 160 °C |
| 37,4 g/100 mL (0°C) 34,7 g/100 mL (20°C) 29,7 g/100 mL (100°C) | |
| Kelarutan | dapat larut dalam metanol tak-larut dalam aseton, etanol, dan benzena |
| Keasaman (pKa) | 6,3-9,6 |
| Indeks bias (nD) | 1,55 |
| Bahaya | |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
4.280 mg/kg (oral, rat) |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kalsium asetat adalah garam kalsium dari asam asetat. Kalsium asetat memiliki rumus Ca(C2H3OO)2. Nama bakunya adalah kalsium asetat, sedangkan kalsium etanoat adalah nama sistematis IUPAC. Salah satu nama lamanya adalah asetat kapur. Bentuk keringnya sangatlah higroskopis; oleh sebab itulah monohidratnya, (Ca(CH3COO)2•H2O, CAS [5743-26-0]) merupakan wujudnya yang paling mudah ditemui.
Jika alkohol ditambahkan ke dalam larutan jenuh kalsium asetat, akan terbentuk gel semipadat yang mudah terbakar, produk ini dapat dijumpai di pasaran dan lazim dikenal sebagai sterno.[1] Guru kimia sering mempersiapkan "Bola Salju Kalifornia", campuran larutan kalsium asetat dan etanol. Gel yang dihasilkan berwarna keputih-putihan, dan dapat dibentuk menyerupai bola salju.
Kalklasit adalah nama praktis bagi kalsium asetat klorida pentahidrat, yang diperlakukan sebagai spesies mineral, tetapi memiliki asal usul antropogenik.
Sejarah
Karena berharga tidak mahal, kalsium asetat pernah menjadi bahan pemulai dalam proses sintesis aseton sebelum dikembangkannya proses cumene.[2] [3]
Kalsium asetat dapat dipersiapkan dengan merendam kalsium karbonat (dapat dijumpai pada cangkang telur, atau dalam batuan karbonat seperti batu kapur atau marmer) dalam cuka. Karena kedua-dua reagen ini telah tersedia sejak zaman prasejarah, senyawa kimia ini dapat diamati dalam bentuk kristal.
Penggunaan
Dalam nefropati, kadar fosfat dalam darah akan meningkat (disebut hiperfosfatemia) dan memicu masalah pada tulang. Kalsium asetat mengikat fosfat dalam makanan untuk memperendah kadar fosfat dalam darah. Efek samping perlakuan ini di antaranya gangguan lambung.
Kalsium asetat digunakan sebagai aditif makanan, sebagai pemantap, penyangga, dan sekuestran, utamanya dalam produk kembang gula. Kalsium asetat juga menetralkan florida dalam air.
Referensi
- ^ "Canned Heat" at Journal of Chemical Education "Chemistry comes alive!"
- ^ Leo Frank Goodwin and Edward Tyghe Sterne (1920). "Losses Incurred in the Preparation of Acetone by the Distillation of Acetate of Lime". Industrial & Engineering Chemistry. 12 (3): 240–243. doi:10.1021/ie50123a012.
- ^ E. G. R. Ardagh, A. D. Barbour, G. E. McClellan, and E. W. McBride (1924). "Distillation of Acetate of Lime". Industrial & Engineering Chemistry. 16 (11): 1133–1139. doi:10.1021/ie50179a013.
